肿瘤坏死因子相关凋亡诱导配体对实验性结肠炎小鼠Th17/Treg细胞平衡的影响*
2020-08-06夏盛隆金颖莉吴利敏卢光荣钟金伟全多多
夏盛隆 金颖莉 吴利敏 卢光荣 钟金伟 全多多 郑 波&
温州医科大学附属第二医院 育英儿童医院消化内科1(325000) 病理科2
背景:Th17/Treg细胞失衡可能是参与克罗恩病(CD)发生的重要环节。肿瘤坏死因子相关凋亡诱导配体(TRAIL)信号通路是影响包括CD在内的多种自身免疫性疾病的潜在机制之一。目的:探讨TRAIL基因敲除对实验性结肠炎小鼠Th17/Treg细胞平衡的影响。方法:采用CRISPR/Cas9基因敲除技术获得TRAIL-/- C57BL/6小鼠。分别将TRAIL-/-小鼠和同品系野生型(WT)小鼠各20只随机分为两组,一组不予处理,一组以三硝基苯磺酸(TNBS)诱导实验性结肠炎。评估各组小鼠结肠炎症程度,采用real-time PCR、蛋白质印迹法和ELISA法检测外周血和结肠组织中的Th17、Treg细胞相关转录因子RORγt、Foxp3和细胞因子白细胞介素-17(IL-17)、IL-10表达。结果:与未造模小鼠相比,造模小鼠体质量显著下降,结肠缩短,疾病活动指数评分和组织活动度指数评分升高(P<0.05),TRAIL-/-结肠炎小鼠上述表现更为明显(P<0.05)。WT结肠炎小鼠外周血和结肠组织中的RORγt、IL-17表达较未造模WT小鼠显著升高(P<0.05),Foxp3、IL-10表达显著降低(P<0.05)。TRAIL-/-结肠炎小鼠上述Th17、Treg细胞相关因子表达和RORγt/Foxp3比值均较WT结肠炎小鼠显著升高(P<0.05)。结论:TRAIL基因敲除可能通过Th17/Treg细胞比例上调加重实验性结肠炎小鼠的肠道炎症反应。
肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)属于肿瘤坏死因子(tumor necrosis factor,TNF)超家族,其与死亡受体(death receptors,DRs;人DR4、DR5,小鼠TRAIL-R)构成的信号通路能选择性诱导肿瘤细胞、病毒感染细胞和转化细胞发生凋亡,对正常细胞则几乎无凋亡诱导作用[1]。最新研究显示,TRAIL及其DRs广泛表达于T、B淋巴细胞、单核细胞、树突细胞等免疫细胞,在多种免疫应答和炎症反应中发挥重要调节作用,与类风湿关节炎、系统性红斑狼疮、多发性硬化等多种自身免疫性疾病密切相关[1-4]。Ikeda等[5]的研究发现,与野生型(wide-type,WT)小鼠相比,TRAIL-/-小鼠的实验性自身免疫性脑脊髓炎(EAE)发生更早,病情更重,其机制可能与TRAIL能抑制Th1细胞,同时增加调节性T细胞(regulatory T cells,Treg细胞)有关。另有研究[6]表明,TRAIL/DR5信号通路在Treg细胞抑制并杀伤效应T细胞中起关键作用,是Treg细胞调节免疫应答的机制之一。
克罗恩病(Crohn’s disease,CD)是一种累及全消化道的慢性非干酪性肉芽肿性疾病,其确切病因和发病机制至今不明。过去认为Th1/Th2细胞极化异常是CD发病的主要原因,但近年研究显示,对于包括CD在内的多种自身免疫性疾病而言,Th17/Treg细胞失衡可能比Th1/Th2细胞极化异常更为重要。研究[7]发现CD患者外周血中Th17细胞增多、Treg细胞减少,Th17/Treg细胞比例升高,并与疾病活动度和高复发风险密切相关,但导致CD中Th17/Treg细胞失衡的确切机制至今仍未阐明。本研究在TRAIL-/-小鼠中以三硝基苯磺酸(TNBS)诱导实验性结肠炎,探讨TRAIL基因敲除是否会影响模型小鼠外周血和结肠组织中的Th17和Treg细胞数量,进而影响肠道炎症反应,以期有助于揭示TRAIL信号通路影响CD的潜在机制,为以TRAIL为靶点的药物研发提供理论依据。
材料与方法
一、实验动物和主要试剂
1.实验动物:采用CRISPR/Cas9基因敲除技术获得TRAIL-/-C57BL/6小鼠(上海南方模式生物科技股份有限公司),PCR验证TRAIL-/-小鼠基因型(图1)。同品系WT小鼠购自北京维通利华实验动物技术有限公司。所有小鼠均饲养于温州医科大学实验动物中心。研究获温州医科大学实验动物伦理委员会审核批准(wydw2016-0215)。
2.主要试剂:TNBS(Sigma-Aldrich LLC.);TRIzol试剂(Invitrogen,Thermo Fisher Scientific);PrimeScriptTMRT试剂盒(Takara Bio Inc.);iTaqTMUniversal SYBR®Green Supermix(Bio-Rad Laborat-ories,Inc.);RORγt、白细胞介素-17(IL-17)、Foxp3、IL-10抗体(Abcam plc.);GAPDH抗体(Affinity Bioscience);RORγt、IL-17、Foxp3、IL-10 ELISA试剂盒(联科生物)。
二、方法
1.动物分组和结肠炎模型制备:6~8周龄、体质量20~22 g的雄性TRAIL-/-小鼠和WT小鼠各20只分别以随机数字表法分为两组,每组10只,一组不予处理,一组以TNBS诱导实验性结肠炎。造模前小鼠禁食、不禁水24 h。将5% TNBS与无水乙醇等体积混合,配制成2.5%的溶液,根据小鼠体质量按250 mg/kg灌肠1次[8]。灌肠前协助小鼠充分排出肠道内粪便,1.0%戊巴比妥(0.2 mL)腹腔注射麻醉。将经石蜡油润滑的直径约2 mm的硅胶管由肛门轻缓插入肠道约4 cm,缓慢注入TNBS-乙醇溶液,将小鼠倒立静置约30 s;缓慢抽出硅胶管,捏住肛门继续倒置约1 min后将小鼠放回鼠笼中,待麻醉清醒后正常喂养。
2.结肠炎症程度评估:每日观察并记录小鼠精神状态、进食和活动情况、体质量变化、粪便性状和次数,行疾病活动指数(disease activity index,DAI)评分[9]。造模第4天以颈椎脱臼法处死小鼠,眼眶静脉丛取血,置于EDTA抗凝管中,并收集炎症表现明显的结肠组织备用。部分结肠组织常规石蜡包埋,连续切片,行HE染色,光学显微镜下评估组织活动度指数(histology activity index,HAI)[9]。
3.Real-time PCR:提取小鼠外周血和结肠组织总RNA,分光光度计检测RNA浓度和纯度,反转录合成cDNA,行real-time PCR。PCR反应体系20 μL,含上、下游引物各0.8 μL,SYBR Green 10 μL,cDNA 2 μL,ddH2O 6.4 μL。反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,共40个循环。所有引物均由生工生物工程(上海)股份有限公司合成(表1)。2-△△Ct法计算目的基因mRNA相对表达量。

表1 Real-time PCR引物序列
4.蛋白质印迹法:蛋白质裂解液提取结肠组织总蛋白,BCA法测定蛋白浓度。蛋白样品在10%凝胶中电泳,转膜至0.45 μm PVDF膜上,5%脱脂奶粉封闭2 h后,将PVDF膜放入一抗(RORγt、IL-17、Foxp3、IL-10或GAPDH),4 ℃摇床孵育过夜,洗涤后二抗室温孵育1 h,显影,Image Lab软件分析目的蛋白相对表达量。
5.ELISA:取小鼠外周血,离心(3 000 r/min,15 min)后吸取上层血浆,参照ELISA试剂盒说明书进行操作,检测血浆IL-17、IL-10浓度。剩余部分加入PBS等比稀释混匀,加入等体积Ficoll分离液,离心(2 200 r/min,40 min,20 ℃慢升慢降),取云雾状外周血单个核细胞(PBMCs),经匀浆器充分匀浆后低速离心,取上清液,参照说明书检测RORγt、Foxp3浓度。
三、统计学分析
结 果
一、TRAIL基因敲除对小鼠结肠炎的影响
WT小鼠经TNBS灌肠后逐渐出现厌食、懒动、体质量减轻、粪便不成形或稀便,部分出现血便,症状随时间延长而加重;TRAIL-/-小鼠造模后出现蜷缩、懒动,肛门处有黑便黏附,并有血便,体质量明显减轻。结肠组织HE染色显示结肠炎模型小鼠肠黏膜中有大量炎性细胞浸润,可见黏膜缺损和溃疡面形成,黏膜充血水肿明显。与WT结肠炎小鼠相比,TRAIL-/-结肠炎小鼠体质量下降更为显著,结肠明显缩短,DAI和HAI评分明显升高,差异均有统计学意义(P<0.05;图2)。造模第4天,WT小鼠有2只死亡,TRAIL-/-小鼠有3只死亡。
未造模的WT和TRAIL-/-小鼠整个实验过程中体质量轻度增加,无自发性腹泻、便血等结肠炎症状,光学显微镜下未见结肠组织中有明显炎性细胞浸润和组织损伤(图2)。

A:***与WT结肠炎小鼠比较,P<0.001;C、E、F:两组间比较,*P<0.05,**P<0.01,***P<0.001A:体质量变化;B:肠道大体形态(从左至右依次为TRAIL-/-结肠炎小鼠、WT结肠炎小鼠、TRAIL-/-小鼠、WT小鼠);C:结肠长度比较;D:结肠组织病理学变化(左上:WT小鼠;左下:TRAIL-/-小鼠;右上:WT结肠炎小鼠;右下:TRAIL-/-结肠炎小鼠;HE染色,×200);E:DAI评分;F:HAI评分图2 TRAIL基因敲除对小鼠结肠炎的影响
二、TRAIL基因敲除对Th17细胞和Treg细胞的影响
Real-time PCR检测显示,与未造模WT小鼠相比,WT结肠炎小鼠外周血和结肠组织中的RORγt、IL-17 mRNA表达升高,Foxp3、IL-10 mRNA表达降低,差异均有统计学意义(P<0.05);与WT结肠炎小鼠相比,TRAIL-/-结肠炎小鼠外周血和结肠组织中的RORγt、IL-17、Foxp3、IL-10 mRNA表达均明显升高,差异有统计学意义(P<0.05);未造模WT小鼠与TRAIL-/-小鼠间外周血和结肠组织中上述基因mRNA表达均无明显差异(P>0.05;图3)。进一步采用ELISA法和蛋白质印迹法在外周血和结肠组织中验证上述基因蛋白表达,结果显示四组间蛋白表达变化与mRNA表达变化相一致(图4)。
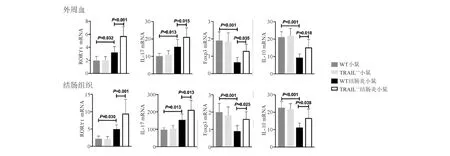
图3 各组小鼠外周血和结肠组织RORγt、IL-17、Foxp3、IL-10 mRNA表达比较

图4 各组小鼠外周血和结肠组织RORγt、IL-17、Foxp3、IL-10蛋白表达比较
在此基础上采用RORγt/Foxp3 mRNA比值反映Th17与Treg细胞之间的比例关系,结果显示WT结肠炎小鼠外周血和结肠组织中的RORγt/Foxp3比值较未造模WT小鼠明显升高,TRAIL-/-结肠炎小鼠的RORγt/Foxp3比值较WT结肠炎小鼠进一步升高,差异均有统计学意义(P<0.05;图5)。

图5 各组小鼠外周血和结肠组织RORγt/Foxp3比值比较
讨 论
大量研究表明,肠黏膜免疫异常激活参与了CD的发生、发展。传统观念认为,CD患者的肠黏膜炎症以分泌干扰素-γ(IFN-γ)、TNF-α的Th1型免疫反应为主,但近年研究发现Th17和Treg细胞在CD中可能起较Th1细胞更为重要的作用。Th17细胞主要分泌IL-17、IL-22、IL-23等促炎细胞因子,通过增强靶细胞通透性、诱导炎性细胞募集和活化,最终促进炎症发生,RORγt是控制Th17细胞分化的关键转录因子。Treg细胞作为一种免疫调节细胞,通过分泌IL-10等抗炎细胞因子直接或间接抑制过度激活的免疫应答,缓解肠道炎症,其特征性标志为高表达转录因子Foxp3。研究显示Th17/Treg细胞失衡可能是参与CD发生、发展和转归的重要环节,恢复Th17/Treg细胞平衡能明显缓解肠道炎症反应[7-8,10-11],本研究结果支持上述结论。目前认为TNBS-乙醇溶液诱导的结肠炎动物模型与人类CD的炎症模式类似,乙醇破坏肠黏膜屏障,使TNBS与肠道组织中的大分子蛋白共价结合形成自身完全抗原,激发以Th1、Th17细胞免疫为主的局部免疫应答和炎症反应,从而引发针对自身抗原的肠道迟发性超敏反应,最终导致类似CD的肠道炎症[12]。本研究中WT小鼠经TNBS-乙醇灌肠诱导结肠炎后,外周血和结肠组织中的Th17细胞数量增加,Treg细胞数量减少,Th17/Treg细胞比例升高。
本研究观察发现,与WT小鼠相比,TRAIL-/-小鼠造模后不仅更早出现结肠炎症状,病情亦更重,死亡数更多,与利用TRAIL-/-小鼠研究其他自身免疫性疾病的研究结果基本一致,如EAE、1型糖尿病和胶原诱导性关节炎[5,13-14],提示TRAIL信号通路是影响包括CD在内的多种自身免疫性疾病的潜在机制之一。Zhu等[15]的研究发现,与WT小鼠相比,TRAIL-R-/-小鼠对葡聚糖硫酸钠(DSS)诱导的结肠炎更易感,TRAIL-R-/-结肠炎小鼠结肠上皮细胞中存在JNK和NF-κB过度激活。另有一项对炎症性肠病(IBD)患者的研究[16]显示,TRAIL在炎性黏膜肠上皮细胞和固有层淋巴细胞中表达上调,体外机制研究表明TRAIL在维持肠上皮屏障稳态中发挥关键作用,在炎症情况下能促进肠上皮细胞凋亡。上述发现提示TRAIL信号可能具有强力抗炎活性,通过调节黏膜免疫反应和细胞凋亡对结肠损伤发挥保护作用。
在发现TRAIL-/-结肠炎小鼠的结肠炎症重于WT结肠炎小鼠的基础上,本研究进一步比较了两组小鼠的免疫学特征,结果显示尽管TRAIL-/-结肠炎小鼠外周血和结肠组织中的Th17细胞相关因子(RORγt、IL-17)和Treg细胞相关因子(Foxp3、IL-10)表达与WT结肠炎小鼠相比均明显上调,但反映Th17与Treg细胞比例的RORγt/Foxp3比值显著高于WT结肠炎小鼠,表明Th17细胞数量增加远多于Treg细胞。目前研究证实TRAIL介导的凋亡信号是调控免疫细胞凋亡的重要机制之一,而且不同CD4+T细胞亚群对TRAIL凋亡信号的敏感性可能存在差异,Th1细胞对之敏感,Th2细胞则存在抵抗[17]。由此推测,在TRAIL基因敲除小鼠中诱导实验性结肠炎,其体内Th17和Treg细胞凋亡均较WT结肠炎小鼠减少,但与发挥抗炎作用的Treg细胞相比,Th17细胞凋亡受抑更为显著,细胞数量异常增加,Th17/Treg细胞平衡被打破,最终导致肠道炎症发生。
Zhu等[15]对DSS结肠炎模型小鼠的研究发现,与WT结肠炎小鼠相比,TRAIL-R-/-结肠炎小鼠肠黏膜中CD3+T细胞数量增加,而Treg细胞数量无明显变化。在小鼠EAE模型中,TRAIL-/-小鼠脾脏和腹股沟淋巴结中的Treg细胞数量较WT小鼠显著减少,Th17细胞数量则无明显变化[5]。Park等[18]的研究采用TRAIL-R激动剂聚乙二醇化TRAIL(TRAILPEG)治疗小鼠实验性关节炎,发现其不仅能诱导caspase-3、caspase-7活性增加、促进炎性关节组织中的Th17细胞凋亡,还能直接促进Treg细胞增殖,进而缓解关节炎症。本研究中TRAIL-/-结肠炎小鼠的Th17和Treg细胞数量变化与上述发现有一定差异,可能与所研究的疾病背景、研究方法以及TRAIL信号通路干预措施不同有关。
综上所述,本研究结果提示TRAIL基因敲除能加重TNBS诱导的小鼠实验性结肠炎的肠道炎症反应,其机制可能与Th17/Treg细胞比例上调有关。TRAIL影响Th17和Treg细胞的确切机制有待后续体外研究进一步探索。
