质子泵抑制剂抑制糖酵解和谷氨酰胺代谢影响胃癌细胞增殖、凋亡机制的研究*
2020-08-06王卓婷邹晓平沈永华黄淑玲顾正宇
王卓婷 邹晓平 陈 敏 沈永华 黄淑玲 顾正宇
南京大学医学院附属南京鼓楼医院消化科(210008)
背景:已有研究发现质子泵抑制剂(PPI)可抑制空泡型质子泵(V-ATPases)表达、影响胃癌细胞糖酵解水平。V-ATPases对肿瘤恶性生物学行为具有重要意义。目的:探讨PPI通过抑制糖酵解和谷氨酰胺代谢作用于胃癌的机制。方法:在细胞实验部分,对胃癌细胞株进行PPI加药处理并沉默相关分子,以CCK-8法检测细胞增殖,流式细胞术检测细胞凋亡,定量PCR和蛋白质印迹法分别检测mRNA和蛋白表达。在动物实验部分,将裸鼠分为空白对照组、0.9% NaCl溶液灌胃组、泮托拉唑钠溶液灌胃组、PKM2干扰组,观察小鼠体质量、摄食行为、肿瘤大小以及肿瘤组织内相关通路分子表达情况。结果:PPI可抑制胃癌细胞增殖,诱导细胞凋亡;PPI可抑制胃癌细胞糖酵解和谷氨酰胺代谢相关分子表达;干扰PKM2或PI3K均可抑制胃癌细胞增殖,诱导细胞凋亡;沉默V-ATPases可抑制胃癌细胞糖酵解和谷氨酰胺代谢相关分子表达。PPI灌胃治疗荷瘤小鼠可延缓肿瘤生长、缓解小鼠恶病质情况。结论:PPI可抑制V-ATPases和PI3K信号通路表达,进而影响胃癌细胞糖酵解和谷氨酰胺代谢水平,影响胃癌细胞增殖和凋亡水平,从而发挥抗肿瘤作用。
低氧环境中肿瘤细胞依然进行糖酵解,消耗葡萄糖,并产生大量乳酸[1],这些特性被认为与肿瘤强大的增殖、侵袭和转移能力有关[2]。在酸性环境中,肿瘤细胞仍能保持中性胞内环境,可能与空泡型质子泵(V-ATPases)有关[3],其由V1和V0两个结构域组成,V1起酶催化作用,可水解ATP;而V0可转运质子,从而降低胞内由于糖酵解而产生的高酸水平。胞外pH值酸化可活化胞内PI3K/Akt信号通路,活化mTOR,上调HIF-1α,进而促进PKM2表达使糖酵解水平增加。有研究表明,V-ATPases可调控细胞中AMPK和mTORC1的激活,同时参与氨基酸代谢调控,对肿瘤细胞存活、生长具有极为重要的作用[4]。近年质子泵抑制剂(PPI)被用于肿瘤治疗的研究中,其抗肿瘤作用可能与抑制V-ATPases相关[5]。此外,有研究指出PPI可影响肿瘤细胞有氧糖酵解[6],影响肿瘤细胞增殖、凋亡、自噬水平以及侵袭转移能力[7-11]。随着靶向糖酵解相关分子在肿瘤治疗研究中地不断深入,有研究指出单纯靶向糖酵解相关分子并不能达到理想的抗肿瘤效果,或与代谢回补通路的产生有关[12-13]。本研究通过以PPI处理胃癌细胞,并检测细胞增殖、凋亡以及相关蛋白表达情况,旨在探究PPI是否通过抑制胃癌细胞糖酵解和谷氨酰胺代谢影响胃癌细胞恶性生物学行为及其作用机制,为胃癌治疗研究提供新思路。
材料与方法
一、细胞株和主要试剂
不同分化程度的人胃癌细胞株SGC7901、BGC823、HGC27和MGC803均由南京鼓楼医院消化科冻存。艾司奥美拉唑(阿斯利康制药有限公司),注射用泮托拉唑钠(德国Nycomed GmbH)。CRISPR CAS9双载体慢病毒购于上海吉玛制药技术公司,其中LV-EGFP-gRNA的序列(5’--3’)为GGA GAT CCT GTA CTT CGC AC+AGC AGA CAC GTT TAC TCC TC-119。AceQ qPCR SYBR Green Master Mix(南京诺唯赞生物科技股份有限公司)PI3K抗体(Abcam),PKM2抗体、p-Akt抗体(CST),HIF-1α抗体(Abcam),β-actin抗体(Bioworld Technology),ATP6V1A抗体(Abcam),SLC1A5抗体(Proteintech Group),p-mTOR抗体(CST),GLS抗体(Proteintech Group),GLUT-1抗体(CST),LDHA抗体(Bioworld Technology);PKM2 siRNA(南京锐真生物技术有限公司),V-ATPases shRNA(上海吉凯基因医学科技股份有限公司),BALB/c雄性裸鼠(南京医科大学);CCK-8试剂盒(同仁化学研究所),凋亡检测试剂盒(碧云天生物技术)。
二、实验方法
1.细胞培养:细胞常规培养于含10% FBS+1%青链霉素的RPMI-1640培养基中,置于37 ℃、5% CO2培养箱中培养。
2.加药:部分细胞消化、传代,另一部分吹打混匀后接种于6孔板,培养24 h后待细胞贴壁,加入现配的不同浓度的PPI溶液。同时以盐酸和氢氧化钠调节培养基pH值,酸性环境pH值为6.5,中性环境pH值为7.5。
3.siRNA转染:按照说明书,配制转染体系,即400 μL OPTI MEM+5 μL siRNA+5 μL转染试剂。消化细胞,用不含双抗的完全培养基重悬,计数后稀释至18.75万/mL(保证每孔30万细胞),每孔取1.6 mL细胞悬液+410 μL转染体系。视细胞状态,12~24 h后换液。
4.荧光定量PCR(qPCR)法:提取细胞总RNA,反转录成cDNA。PCR引物见表1,由苏州金唯智生物科技有限公司合成。反应体积20 μL,内含10 μL SYBR、0.4 μL上游引物、0.4 μL下游引物、7.2 μL DD水、2 μL cDNA模板。反应条件:95 ℃ 5 s,60 ℃32~34 s,共40个循环。采用2-ΔΔCt法计算各目的基因mRNA表达水平。

表1 各目的基因的PCR引物序列
5.蛋白质印迹法:收集各组对数生长期细胞,加入蛋白裂解液提取细胞总蛋白,按照BCA试剂说明书进行蛋白定量。行电泳后将分离的蛋白转移至PVDF膜。转膜后牛奶封闭2 h,加入稀释后的一抗溶液(按各抗体说明书推荐浓度稀释)过夜,洗涤后加入二抗,曝光,显影,摄片。
6.免疫荧光:各组细胞接种后孵育36~48 h,置于多聚甲醛中固定10 min,0.2% Triton X-100通透10 min,PBS洗涤,血清封闭30 min,PBS洗涤,加入一抗4 ℃过夜,室温避光孵二抗2 h,DAPI染核,拍摄荧光照片。
7.双载体慢病毒转染和单克隆挑取:根据预染结果,MGC803细胞铺于6孔板,每孔6万细胞。ATP6V1A敲除慢病毒稀释为45 μL原液+405 μL完全培养基,CAS9慢病毒稀释为180 μL原液+720 μL完全培养基,空载体组病毒稀释为5 μL原液+445 μL完全培养基,按照1 600 μL完全培养基+200 μL ATP6V1A敲除/空载体病毒+200 μL CAS9病毒+2 μL poly转染试剂进行转染。设置不处理组作为对照。嘌呤霉素筛选至荧光强度达70%~80%时,使用流式细胞仪进行荧光分选,分选后的细胞培养稳定后稀释至1个/100 μL,接种于96孔板,14~28 d后观察荧光强度和生长情况,转入6孔板继续培养。根据qPCR和蛋白质印迹结果判断是否成功敲除基因,选取敲除成功的细胞冻存。
8.CCK-8实验:将各组细胞接种于96孔板,每孔3 000~5 000个细胞,每组至少5个复孔,培养24、48 h后,加入10% CCK-8试剂,上酶标仪检测波长为450 nm的吸光度值,计算细胞增殖情况。
9.细胞凋亡情况:按照细胞凋亡试剂盒说明书处理细胞,加入荧光液,遮光反应5 min,流式细胞仪检测细胞凋亡水平。
10.葡萄糖摄取率、LDH活性和乳酸测定:使用LDH细胞毒性检测试剂盒检测LDH活性,采用比色法检测葡萄糖、乳酸水平,具体步骤按说明书步骤操作。
11.动物实验:将中分化的人胃癌细胞株SGC7901接种于BALB/c雄性裸鼠背部皮下,1~2周成瘤成功。将小鼠分为泮托拉唑钠溶液灌胃组、0.9% NaCl溶液灌胃组、PKM2干扰组(使用慢病毒干扰PKM2表达的胃癌细胞成瘤)、阴性对照组(使用空白慢病毒转染的胃癌细胞成瘤)、空白对照组(正常成瘤,不作处理)。5周后处死小鼠,剥离肿瘤,行后续研究。
三、统计学分析
结 果
一、PPI可抑制胃癌细胞增殖、诱导胃癌细胞凋亡
以不同浓度的艾司奥美拉唑处理SGC7901细胞24 h时,与对照组相比,10 μg/mL组细胞增殖率略有上升,20 μg/mL组细胞增殖率明显降低(P<0.05),而后随着艾司奥美拉唑浓度的升高和作用时间的延长,细胞增殖抑制作用逐渐增强(图1A)。流式细胞术显示不同浓度的艾司奥美拉唑可诱导胃癌SGC7901细胞凋亡(图1D)。
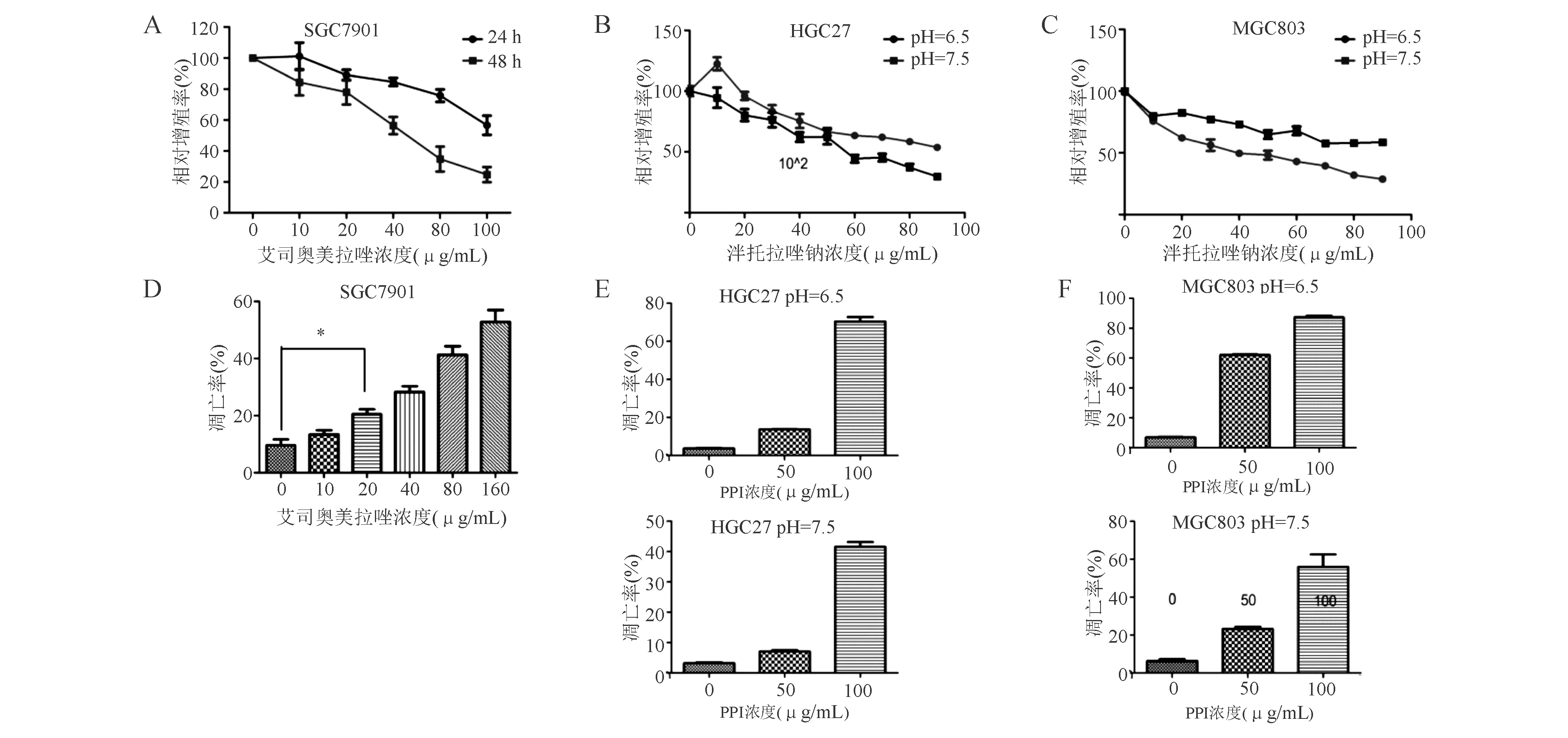
A-C:不同细胞增殖情况(CCK-8法);D-F:不同细胞凋亡情况(流式细胞术)图1 PPI可抑制胃癌细胞增殖、诱导胃癌细胞凋亡
同时,在酸性环境中,较低浓度(20 μg/mL)组短时间内HGC27细胞增殖水平略有上升,可能是药物刺激性地一过性上升,而当药物作用加强(浓度升高或作用时间增加),细胞增殖水平开始逐渐下降;在中性环境中,随着药物浓度增加,HGC27细胞增殖水平下降(P<0.05;图1B)。此外,酸性环境中泮托拉唑钠可显著抑制MGC803细胞增殖(P<0.05);而在中性环境中,泮托拉唑钠总体可下调MGC803细胞增殖水平,但差异并无统计学意义(图1C)。在酸性和中性环境中,高浓度泮托拉唑钠(100 μg/mL)可明显促进胃癌HGC27细胞凋亡(P<0.05;图1E),而泮托拉唑钠在较低浓度时即可诱导MGC803细胞凋亡(P<0.05;图1F)。总体而言,PPI可抑制胃癌细胞增殖能力,并诱导胃癌细胞早期凋亡,酸性环境或可增强PPI这一作用。
二、PPI可影响胃癌细胞中PI3K、Akt、mTOR、HIF-1α和PKM2表达
qPCR法显示,在酸性环境中,20 μg/mL艾司奥美拉唑即可抑制SGC7901细胞内PI3K、Akt、mTOR、HIF-1α和PKM2 mRNA表达(P<0.05),且呈浓度依赖性(图2A);而艾司奥美拉唑浓度为40 μg/mL时,上述指标的蛋白表达受到明显抑制,呈浓度依赖性(图2B)。免疫荧光法结果显示艾司奥美拉唑(40 μg/mL)可使胃癌SGC7901细胞内PI3K、Akt、mTOR、HIF-1α和PKM2表达减少(图2C)。
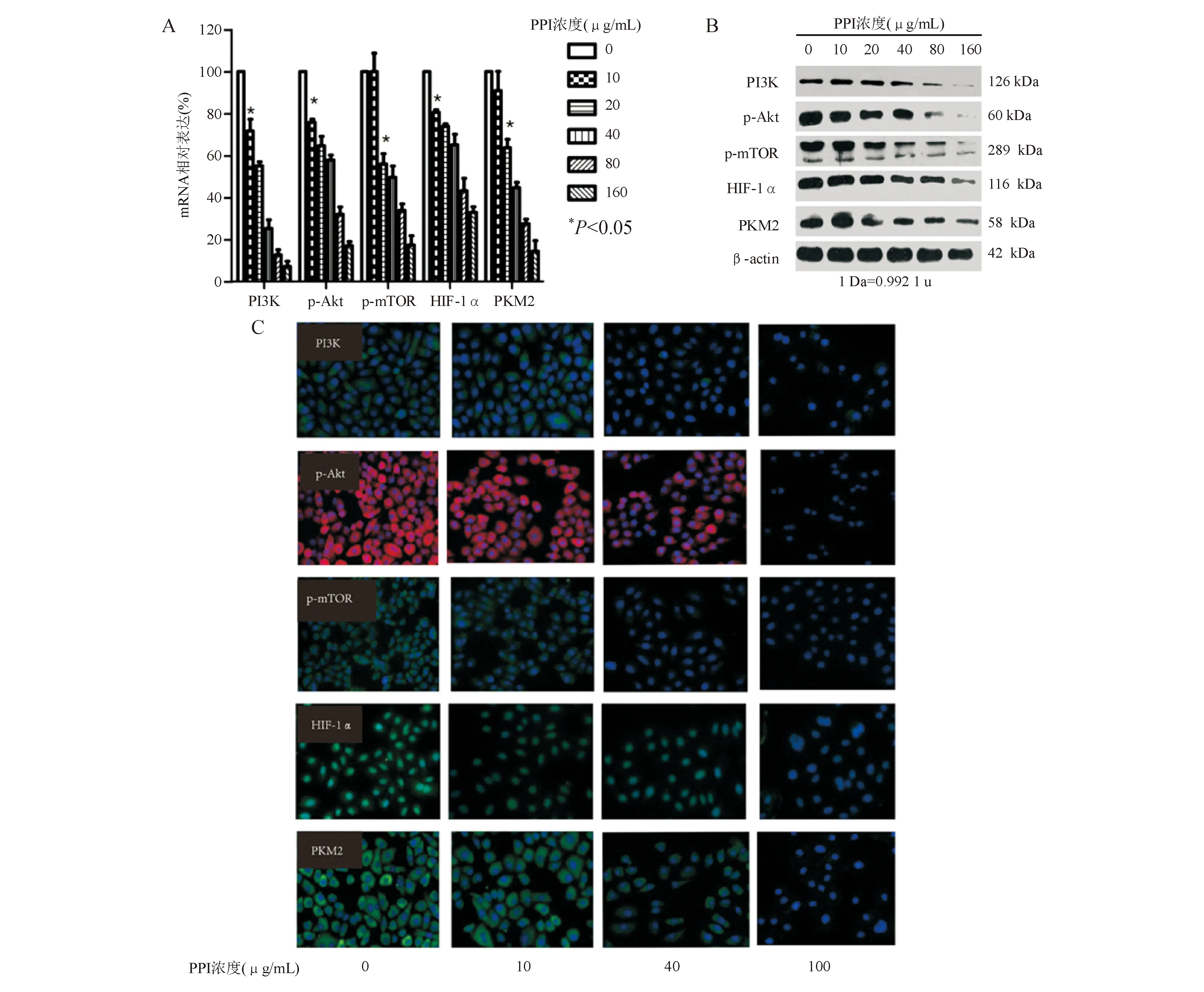
A:mRNA表达(qPCR法);B:蛋白表达(蛋白质印迹法);C:蛋白表达(免疫荧光法,×200)图2 PPI可影响胃癌SGC7901细胞中PI3K、Akt、mTOR、HIF-1α和PKM2的表达
三、PI3K特异性抑制剂LY294002对胃癌细胞增殖和凋亡的影响
以不同浓度的LY294002处理胃癌HGC27、MGC803细胞24 h后,细胞增殖受到明显抑制,并诱导细胞凋亡,且均呈浓度依赖性(P<0.05;图3)。
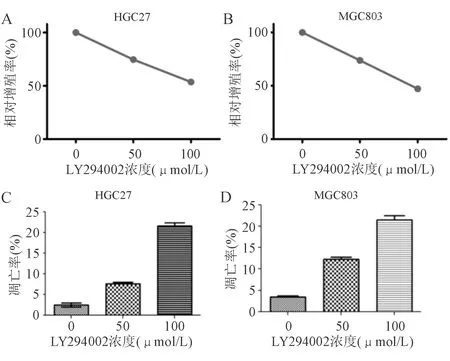
A-B:细胞增殖(CCK-8法);C-D:细胞凋亡(流式细胞术)图3 PI3K特异性抑制剂LY294002对胃癌细胞增殖和凋亡的影响
四、PI3K特异性抑制剂LY294002对PI3K/Akt/mTOR信号通路及其下游HIF-1α和PKM2蛋白表达的影响
与未处理组和DMSO对照组相比,10 μmol/L LY294002可明显抑制BGC823细胞内Akt、mTOR蛋白表达(P<0.05);20 μmol/L组HIF-1α表达受到明显抑制(P<0.05);50 μmol/L组可显著抑制PKM2表达(P<0.05);抑制作用均呈浓度依赖性(P<0.05;图4)。表明LY294002在低浓度时就能抑制PI3K/Akt/mTOR/HIF-1α信号通路活化,但较高浓度时才能对PKM2产生抑制作用。

图4 不同浓度LY294002对BGC823细胞中PI3K/Akt/mTOR信号通路及其下游HIF-1α和PKM2蛋白表达的影响(蛋白质印迹法)
五、敲减PKM2表达抑制胃癌细胞糖酵解,影响胃癌细胞增殖和凋亡
以siRNA转染胃癌HGC27、MGC803细胞后,PKM2蛋白表达明显降低(图5A)。与对照组相比,PKM2 siRNA转染组可明显抑制胃癌细胞增殖能力(图5B),且细胞早期凋亡水平明显升高(图5C)。
蛋白质印迹法显示,PKM2 siRNA组GLUT-1、LDHA蛋白表达较未转染组和空载体组明显降低,细胞葡萄糖摄取率、乳酸产量、LDH活性明显减少,差异均有统计学意义(P<0.05;图5D-5G)。
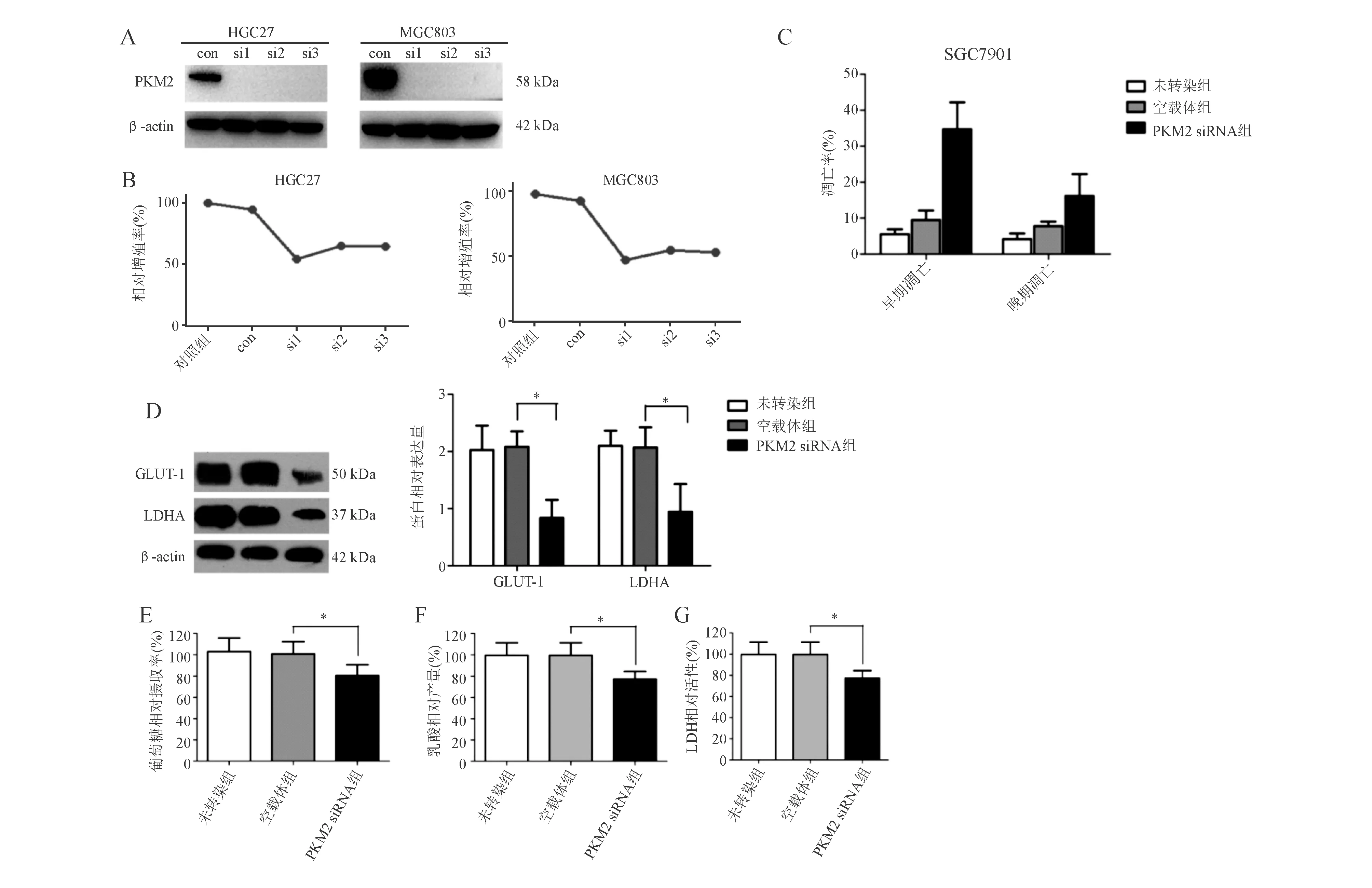
A:PKM2蛋白表达(蛋白质印迹法);B:细胞增殖情况(CCK-8法);C:细胞凋亡(流式细胞术);D:GLUT-1、LDHA蛋白表达(蛋白质印迹法);E:葡萄糖相对摄取率;F:乳酸相对产量;G:LDH相对活性图5 敲减PKM2表达抑制胃癌细胞糖酵解,影响胃癌细胞增殖和凋亡水平
六、PPI通过V-ATPases表达影响胃癌细胞谷氨酰胺代谢
在酸性环境中,泮托拉唑钠可明显下调胃癌HGC27、MGC803细胞中V-ATPases、SLC1A5表达,且这种抑制作用随着药物浓度的增加而增强(图6A)。然而,在中性环境中,泮托拉唑钠不能发挥此抑制作用(图6B)。在酸性环境中,较低浓度的PPI(25 μg/mL)可抑制MGC803细胞中GLS表达,且呈浓度依赖性(图6C)。
以ATP6V1A敲除的CRISPR CAS9双载体慢病毒转染MGC803细胞后,GLS和SLC1A5表达均下调(图6D),细胞增殖受到轻度抑制(图6E),细胞凋亡无明显变化(图6F)。
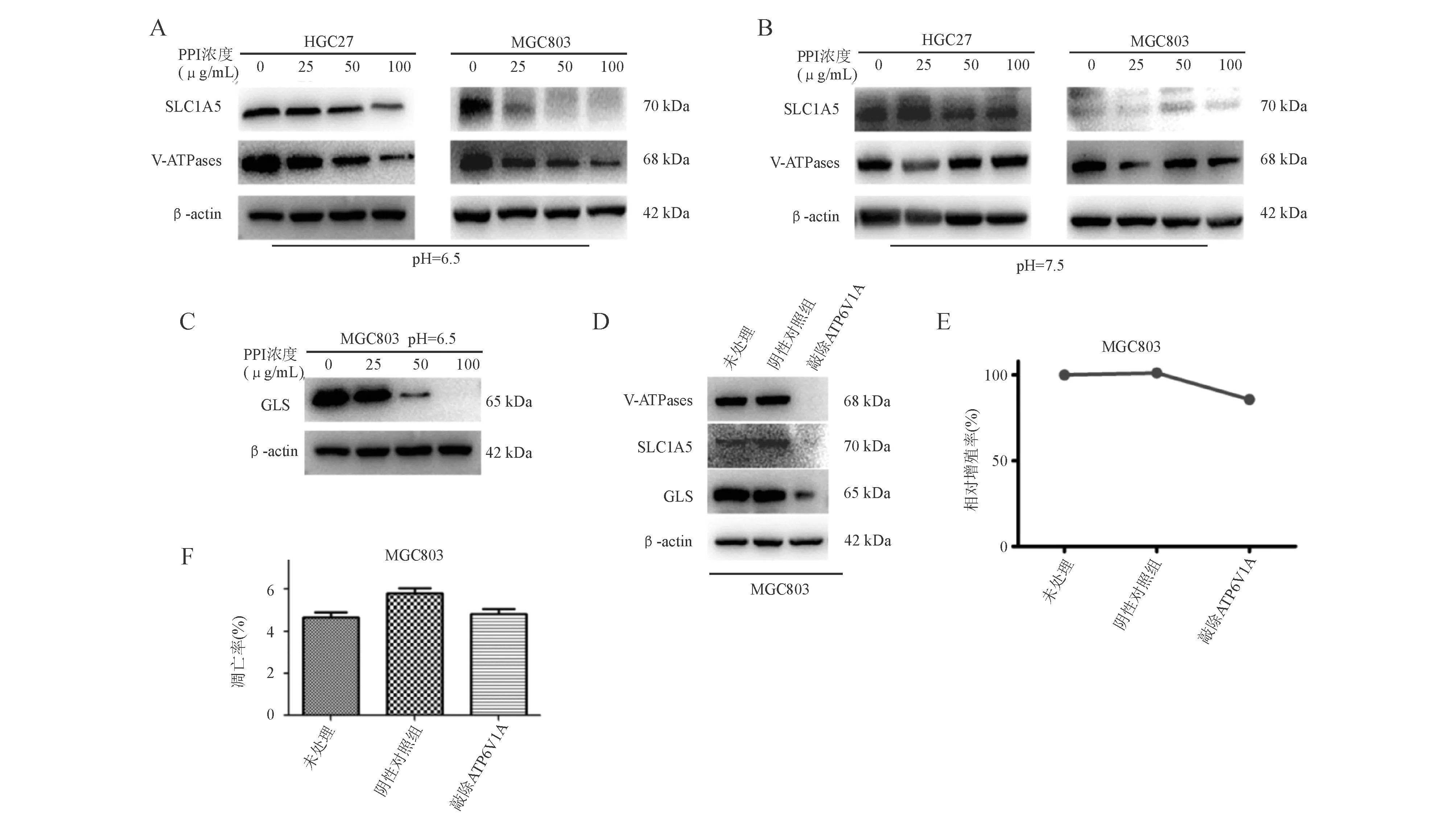
A:酸性环境中V-ATPases、SLC1A5表达(蛋白质印迹法);B:中性环境中V-ATPases、SLC1A5表达(蛋白质印迹法);C:酸性环境中GLS表达(蛋白质印迹法);D:敲除ATP6V1A对SLC1A5、GLS蛋白表达的影响(蛋白质印迹法);E:敲除ATP6V1A对MGC803细胞增殖的影响(CCK-8法);F:敲除ATP6V1A对MGC803细胞凋亡的影响(流式细胞术)图6 PPI通过V-ATPases表达影响胃癌细胞谷氨酰胺代谢
七、PI3K信号通路与V-ATPases之间的相互作用
以shRNA干扰SGC7901细胞中V-ATPases表达后,可抑制PI3K/Akt/mTOR/HIF-1α信号通路和PKM2蛋白表达(图7A)。而以siRNA干扰PKM2表达后,胃癌HGC27、MGC803细胞中ATP6V1A和SLC1A5蛋白表达无明显差异(图7B)。以LY294002抑制PI3K表达后,胃癌细胞中ATP6V1A和SLC1A5蛋白表达无明显差异(图7C)。
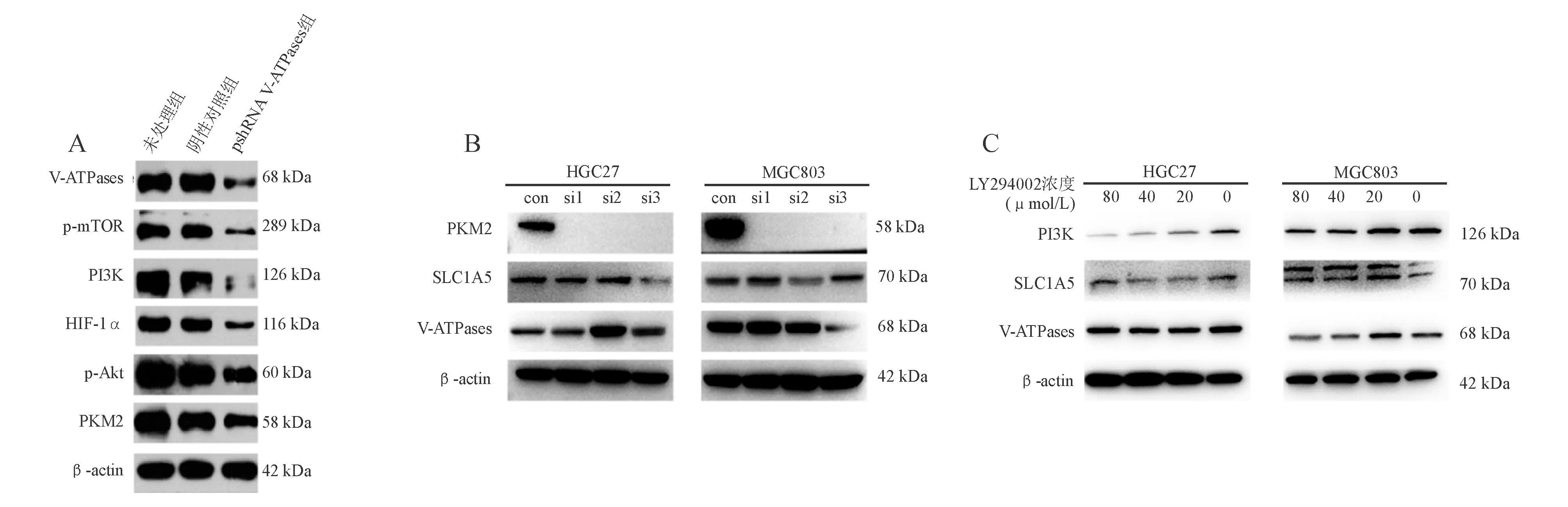
A:shRNA干扰SGC7901细胞V-ATPases表达后对相关蛋白表达的影响;B:siRNA PKM2对相关蛋白表达的影响;C:不同浓度LY294002对相关蛋白表达的影响图7 PI3K信号通路与V-ATPases之间的相互作用(蛋白质印迹法)
八、PPI治疗减缓荷瘤小鼠瘤体生长,改善癌性恶病质情况
与空白对照组和0.9% NaCl溶液灌胃组相比,泮托拉唑钠溶液灌胃组裸鼠瘤体最小(图8A),肿瘤质量明显降低(P<0.05;图8B),体质量明显升高(P<0.05;图8D)。与空白对照组和阴性对照组相比,PKM2干扰组裸鼠瘤体明显减小,肿瘤质量明显降低(P<0.05;图8C),体质量明显升高(P<0.05;图8E)。
此外,与空白对照组和0.9% NaCl溶液灌胃组相比,泮托拉唑钠溶液灌胃组小鼠日均摄水量和日均摄食量呈下降趋势,但差异均无统计学意义(P>0.05;图8F-8G)。
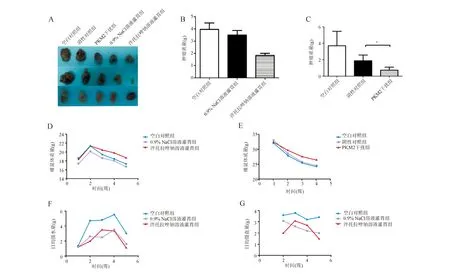
A:瘤体体积;B-C:肿瘤质量;D-E:裸小鼠体质量;F:日均摄水量;G:日均摄食量图8 PPI治疗可减缓荷瘤小鼠瘤体生长,改善恶病质情况
九、PPI治疗影响瘤体PI3K/Akt/mTOR/HIF-1α信号通路表达
与空白对照组和0.9% NaCl溶液灌胃组相比,泮托拉唑钠溶液灌胃组裸鼠肿瘤组织中PI3K、mTOR表达明显降低(P<0.05),而Akt、HIF-1α、PKM2无明显差异(图9)。
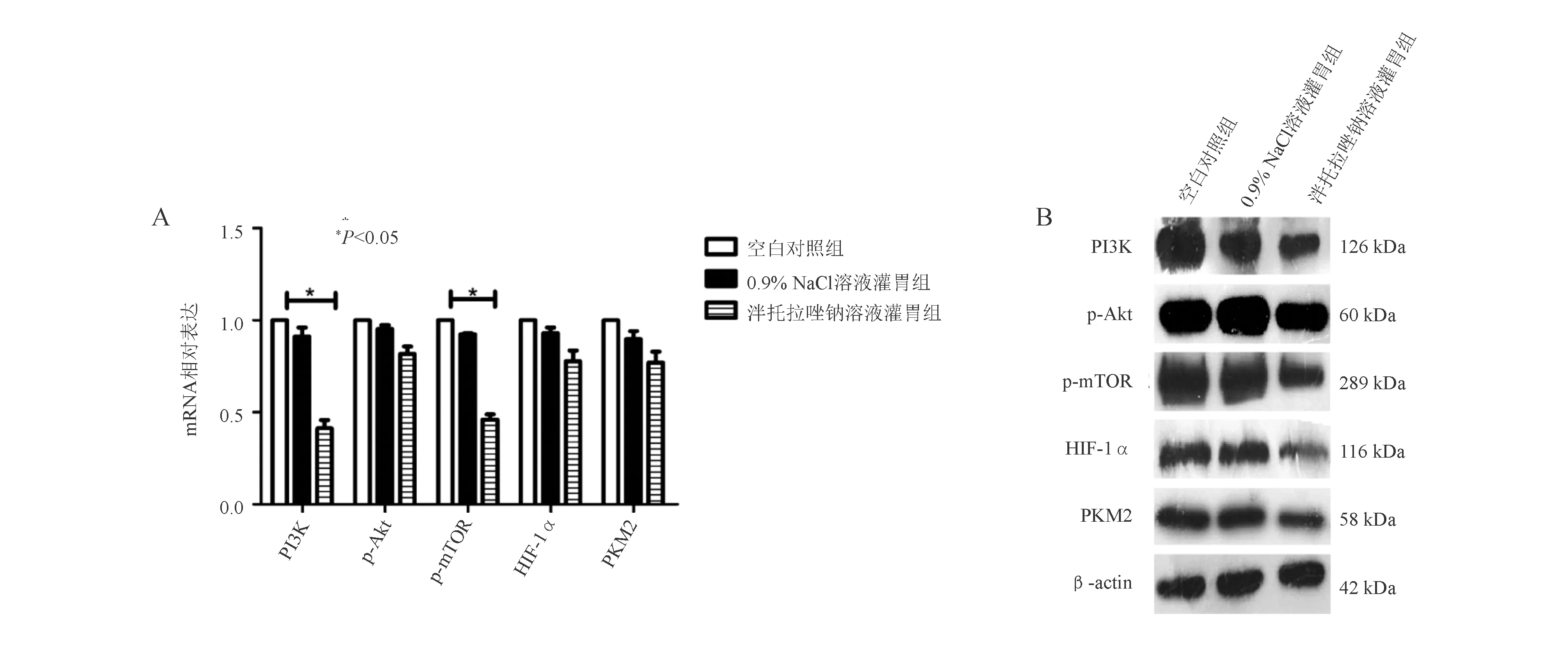
A:mRNA表达(qRCR法);B:蛋白表达(蛋白质印迹法)图9 PPI治疗影响瘤体PI3K/Akt/mTOR/HIF-1α信号通路表达
讨 论
PPI作为新兴的肿瘤治疗药物,其对肿瘤细胞的作用机制尚未阐明,可能为PPI通过抑制胃癌细胞PI3K/Akt/mTOR/HIF-1α/PKM2信号通路来影响糖酵解,同时在酸性环境中可能通过抑制V-ATPases表达来影响谷氨酰胺代谢,从而发挥抗肿瘤的作用。
本实验中,通过加药实验以及分别沉默信号通路上游、下游分子的方法,验证了在酸性环境中,PPI可通过抑制PI3K/Akt/mTOR/HIF-1α/PKM2信号通路的表达从而抑制胃癌细胞糖酵解水平,进而影响胃癌细胞增殖和凋亡水平。在体内实验中,采用皮下成瘤的方法成功建立了SGC7901荷瘤模型和PKM2敲除的SGC7901荷瘤模型,结果显示PPI灌胃可抑制小鼠皮下瘤体生长且使小鼠体质量减轻放缓,干扰PKM2表达细胞成瘤组的小鼠肿瘤生长亦放缓,恶病质较轻;PPI灌胃治疗后,小鼠肿瘤组织中PI3K/Akt/mTOR/HIF-1α信号通路中的上游、下游分子表达亦有所下调。进一步说明PPI可通过抑制PI3K/Akt/mTOR/HIF-1α信号通路起抑制肿瘤生长、缓解恶病质的作用。然而,与对照组相比,PPI和PKM2干扰组的小鼠摄食、摄水行为并无明显改善,且本动物实验未验证肿瘤的病理变化,故尚不能完全证实PPI是通过PI3K/Akt/mTOR/HIF-1α信号通路起抗肿瘤的作用。
有研究指出,PPI对肿瘤细胞的作用很大程度上依赖对V-ATPases的抑制作用,V-ATPases与多个细胞代谢通路有关[14],其不仅参与MAPK等通路的调控,同时可调控氨基酸转运分子,从而对谷氨酰胺代谢产生影响。本研究中,在胃癌细胞中,PPI可下调V-ATPases表达,并下调谷氨酰胺关键的转运分子SLC1A5和谷氨酰胺代谢酶GLS表达。表明PPI不仅可影响糖酵解水平,而且同时影响胃癌细胞谷氨酰胺代谢。本研究对V-ATPases的重要亚基ATP6V1A基因[15]进行敲除,结果显示胃癌细胞中SLC1A5、GLS表达明显降低,表明抑制V-ATPases表达可下调SLC1A5和GLS表达,PPI可能通过调控V-ATPases表达来影响谷氨酰胺代谢。PKM2是PI3K/Akt/mTOR/HIF-1α信号通路的下游分子,是肿瘤细胞糖酵解的关键分子。本研究还发现,干扰PI3K、PKM2表达对ATP6V1A和相关分子并无明显影响,而敲除V-ATPases后,胃癌细胞中PI3K/Akt/mTOR/HIF-1α/PKM2信号通路受到明显抑制。
综上所述,PPI对V-ATPases的抑制作用可明显影响胃癌细胞,V-ATPases不仅调控谷氨酰胺代谢,还在一定程度上影响胃癌糖酵解水平。但敲除V-ATPases的胃癌细胞凋亡并无明显变化,增殖水平仅轻度下调,这可能是由于敲除基因会导致细胞基因组发生有利于细胞存活的改变,从而帮助细胞存活,也可能是由于基因敲除后的细胞产生了某些代谢回补通路帮助细胞躲避V-ATPases敲除后的凋亡和生长抑制作用。值得注意的是,shRNA抑制V-ATPases表达后,胃癌细胞Akt表达明显下调,说明干扰V-ATPases对细胞增殖有抑制作用。
有研究证实,单纯靶向糖酵解并不能取得良好的抗肿瘤效果[12],这或许是由于肿瘤细胞存在抵抗机制和回补通路。已有研究[13]证实在肿瘤细胞中针对糖酵解和谷氨酰胺代谢的联合靶向治疗可取得良好的治疗效果,共靶向mTORC1和LDHA可起有良好的抑制肿瘤生长的作用。在本研究中,靶向V-ATPases可能也存在回补通路的影响,因而联合治疗或许可取得较好的治疗效果,而PPI可影响糖酵解和谷氨酰胺代谢,具有良好的抗肿瘤效果,故联合靶向治疗是肿瘤治疗的大势所趋。
总之,本研究证实PPI可通过抑制PI3K/Akt/mTOR/HIF-1α/PKM2通路和V-ATPases/SLC1A5、GLS表达来抑制胃癌细胞糖酵解和谷氨酰胺代谢,达到抗肿瘤的作用,V-ATPases或许可作为胃癌治疗的良好靶点。然而,对于靶向V-ATPases的疗效和肿瘤细胞对靶向V-ATPases的抵抗机制以及肿瘤细胞中各代谢通路之间的作用机制,仍需行更多的研究进一步探讨。
