阿胶口服液中粗多糖含量测定方法的研究
2020-08-05刘春霖吴晓云谢强胜高天阳董蓬
刘春霖,吴晓云,谢强胜,高天阳,董蓬
(山东省食品药品检验研究院,山东省食品药品安全检测工程技术研究中心,山东 济南 250101)
阿胶为马科动物驴(EquusasinmL.)的干燥皮或鲜皮经煎煮、浓缩制成的固体胶。它是我国传统的名贵补血中药,具有补血滋阴,润燥,止血,增强体质,增强免疫力等功效[1-3]。本次研究的阿胶口服液是以阿胶为主要原料,添加熟地黄、党参、枸杞子、黄芪等中药材,经提取、浓缩、配制、灌装等主要工艺制成的产品,具有增强免疫力的保健功能。上述添加的中药材均含有多糖类成分,文献研究报道具有免疫调节、抗氧化、抗疲劳的作用[4-8]。近年来,很多学者对不同中药材的粗多糖含量进行了研究[9-10],但是针对阿胶口服液中粗多糖的研究还比较少。本研究采用沉淀蛋白质等前处理方法,使样品中相对分子质量大于10 000的高分子物质与阿胶分离,然后在体积分数80%乙醇溶液中沉淀,与水溶液中单糖和低聚糖分离,用苯酚-硫酸反应,其呈色强度与溶液中糖的浓度成正比,在485 nm波长下比色测定粗多糖(以葡聚糖计)含量。
1 仪器与试药
1.1 仪器 Mettler Toledo Ms十万分之一电子天平(德国梅特勒公司);恒温水浴锅(上海树立仪器仪表有限公司);TDZ5-WS离心机(长沙湘仪离心机仪器有限公司);XK96-B涡旋混合器(姜堰市新康医疗器械有限公司);TU-1901紫外分光光度计(北京普析通用公司)。
1.2 试剂试药 乙酸锌、亚铁氰化钾、苯酚、无水乙醇、浓硫酸,分析纯;水为去离子水;乙酸锌溶液:称取乙酸锌[Zn(CH3COO)2·2H2O]21.9 g,加冰乙酸3 mL,加水溶解并稀释至100 mL;亚铁氰化钾溶液:称取亚铁氰化钾{K4[Fe(CN)6]·3H2O}10.6 g,加水溶解并稀释至100 mL;80%(V/V)乙醇溶液:20 mL水中加入无水乙醇80 mL,混匀;苯酚溶液(50 g·L-1):称取精制苯酚5.0 g,加水溶解并稀释至100 mL,混匀,备用。
葡聚糖标准品:相对分子量500 000,批号:BCBN7863V,购自Sigma公司。
葡聚糖标准储备液:准确称取干燥至恒重的葡聚糖对照品0.5 g,加水溶解,并定容至50 mL,混匀,置冰箱中保存。此溶液1 mL含葡聚糖10 mg。
葡聚糖标准使用液:吸取葡聚糖标准储备液1.00 mL,置100 mL容量瓶中,加水至刻度,混匀,置冰箱中保存。此溶液1 mL含葡聚糖100 μg。
阿胶:某阿胶制品公司提供,和样品来源为同一家公司。
样品:某阿胶制品公司提供,3批编号分别为1、2、3。
2 方法与结果
2.1 标准曲线系列溶液制备 精密吸取葡聚糖标准使用液0.00、0.10、0.20、0.40、0.60、0.80、1.00、1.20、1.40、1.60 mL(相当于葡聚糖0、10、20、40、60、80、100、120、140、160 μg),分别置于25 mL比色管中,准确加水补充至2.0 mL,加入50 g·L-1苯酚溶液1.0 mL,在旋转混合器上混匀,小心加入浓硫酸10.0 mL,于旋转混合器上小心混匀,置沸水浴中煮沸2 min,冷却后用分光光度计在485 nm波长处,以试剂空白为试验参比,1 cm比色皿测定吸光度值。以葡聚糖浓度(μg)为横坐标,吸光度值为纵坐标,绘制标准曲线。
2.2 样品溶液的制备
2.2.1 试样沉淀蛋白质处理 取混合均匀的试样15 mL,置250 mL容量瓶中,加水50 mL,缓慢加入乙酸锌溶液5 mL和亚铁氰化钾溶液5 mL,加水至刻度,混匀,静置30 min,用干燥滤纸过滤,取续滤液备用。
2.2.2 沉淀粗多糖 准确吸取上一步滤液5 mL,置于50 mL离心管中,加入无水乙醇20 mL,混匀,置4 ℃冰箱中冷藏过夜,以4 000 rpm离心30 min,弃去上清液,残渣用体积分数80%乙醇溶液数毫升洗涤,以4 000 rpm离心15 min,离心后弃上清液,反复操作2次,残渣用水溶解并定容至25 mL,混匀,此溶液为样品测定液。
2.2.3 样品测定 分别吸取2.0 mL样品测定液置25 mL比色管中,加入50 g·L-1苯酚溶液1.0 mL,混匀,加入浓硫酸10.0 mL,混匀,密塞,沸水浴加热2 min,立即冷却至室温得待测溶液。在485 nm波长处测定吸光度值。从标准曲线上查出葡聚糖的质量,计算,即得样品粗多糖含量。
2.3 标准曲线回归方程线性范围 取标准曲线系列溶液进仪器测定,结果表明葡聚糖的标准溶液在10.8~172.8 μg范围内具有良好的线性关系,相关系数为0.999 9,结果见表1。

表1 线性试验结果
2.4 取样量考察 分别量取同一批号的样品5、10、15、25 mL各2份,按上述样品溶液的制备方法制得待测溶液,测得葡聚糖含量分别为244.6、253.1、285.7、280.9 mg·(100 mL)-1,结果表明取样量为15 mL时蛋白质沉淀完全,粗多糖沉淀量适当,样品溶液吸光度值在标准曲线中段,所以确定15 mL为取样量。
2.5 重复性考察 精密量取同一批号混合均匀的样品6份,按上述方法制得待测溶液,比色测定后计算葡聚糖含量,结果6份样品葡聚糖含量的RSD为1.4%,表明该方法重复性良好。
2.6 精密度考察 取制得的待测溶液,按上述方法连续测定6次吸光度,利用标准曲线计算葡聚糖含量,结果6次葡聚糖含量的RSD为0.11%,表明该方法精密度良好。
2.7 稳定性考察 取制得的待测溶液,按上述方法分别于比色后0、1、2、4 h测定吸光度,结果4次葡聚糖含量的RSD为0.96%,表明比色后供试品溶液在室温条件下4 h内稳定。
2.8 回收率考察 精密量取同一批号混合均匀的样品9份,分为3组浓度,每组浓度3份样品,每组分别精密称取葡聚糖对照品约18、22.5、27 mg,置250 mL容量瓶中,分别精密加入混匀的试样7.5 mL,依法制备加标样品。按上述方法进行测定,结果平均回收率在97.1%~100.1%,表明该方法回收率好,结果见表2。
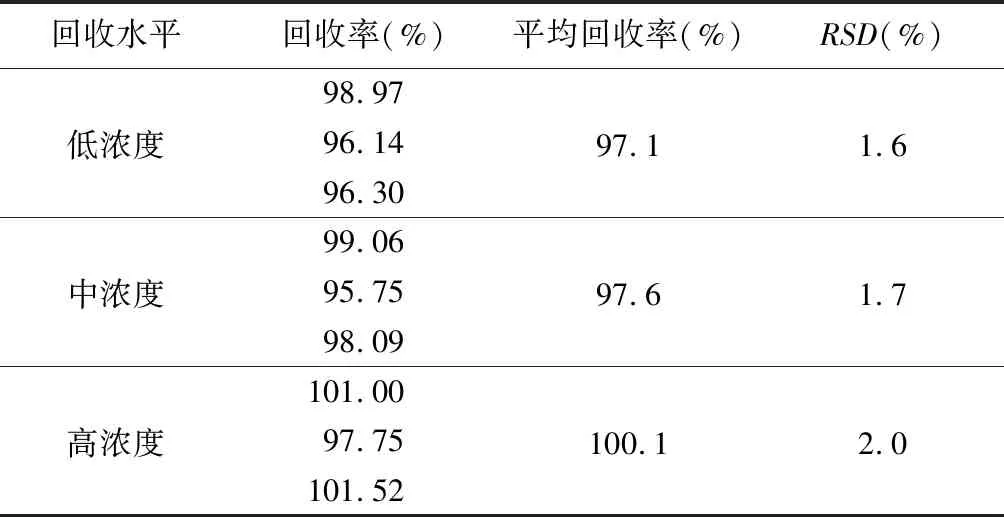
表2 回收率试验结果(n=3)
2.9 方法检出限 参照GB/T 5009.1-2003《食品卫生检验方法理化部分总则》中附录A.2.2规定,检出限为3倍空白值的标准偏差(测定次数n≥20)相对应的质量,吸光法按国际理论与应用化学家联合(IUPAC)规定。检出限按下式进行计算:检出限=Ks/b;b-标准曲线回归方程中的斜率;s-20次空白值的标准偏差;K-一般为3,结果见表3。

表3 检出限试验结果
2.10 样品测定
2.10.1 沉淀蛋白质方法 精密量取3批混合均匀的样品15 mL,按上述方法进行测定,计算葡聚糖含量,结果见表4。
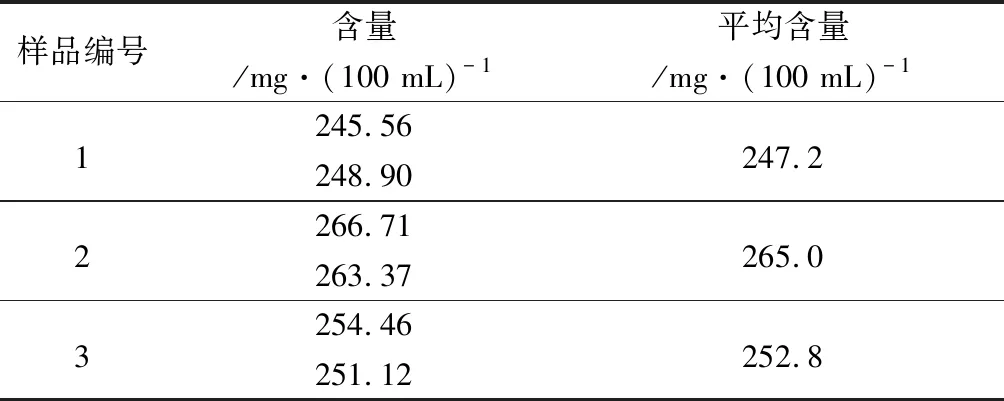
表4 沉淀蛋白质方法样品测定结果
2.10.2 未沉淀蛋白质方法 按样品企业标准规定的检测方法,精密量取3批混合均匀的样品5 mL,置于100 mL容量瓶中,加水80 mL左右,于沸水浴上加热2 h,冷却至室温后补加水至100 mL刻度,混匀,过滤,弃去初滤液,收集续滤液供沉淀粗多糖。沉淀粗多糖及样品测定等步骤均同“2.2”项下方法,结果见表5。
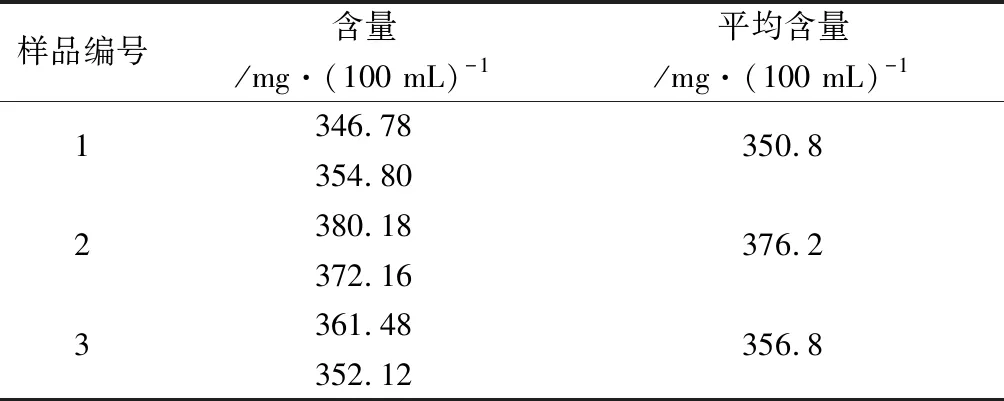
表5 未沉淀蛋白质方法样品测定结果
由表4~5可知,未沉淀蛋白质方法比沉淀蛋白质方法测得的葡聚糖含量高约106 mg·(100 mL)-1,结果差异较大。为找到结果差异的原因,我们做了以下方面的研究。
2.11 含阿胶阴性空白对照溶液测定及比较 根据企业提供33 kg阿胶制成20 000支口服液(20 mL/支)的配方量,计算得口服液中阿胶浓度为82.5 mg·mL-1。为得到和样品相同阿胶含量的阴性空白对照,本研究取阿胶,粉碎,过筛,精密称定8.25 g,置100 mL量瓶中,加水80 mL,水浴煮沸溶解,冷却,加水,定容至刻度,4 000 r·min-1,离心20 min,取上清液备用。
2.11.1 含阿胶沉淀蛋白质阴性空白溶液的制备 精密量取上述上清液15 mL,按“2.2”项下方法制得样品测定液。
2.11.2 含阿胶未沉淀蛋白质阴性空白溶液的制备 精密量取上述上清液5 mL,按“2.10.2”项下方法制得样品测定液。
将上述两种样品测定液按“2.2.3”项下方法进行测定,计算葡聚糖含量,结果见表6。

表6 含阿胶阴性空白对照溶液测定结果
由表6可知,阿胶中的蛋白质对粗多糖测定干扰显著,未沉淀蛋白质的样品溶液比沉淀蛋白质的样品溶液测定结果高约91 mg·(100 mL)-1,这与表4~5两种方法测定结果差值约106 mg·(100 mL)-1相吻合,验证了本研究采用的沉淀蛋白质前处理方法,能够有效去除阿胶口服液中蛋白质对粗多糖测定的严重干扰。
3 讨论
3.1 本研究中阿胶口服液企业标准规定的粗多糖检测方法有提取步骤,该操作是针对固体样品的,且长时间沸水浴可能引起糖结构变化,甚至使碳键断裂而导致所测多糖含量偏低。阿胶口服液是均匀澄清的液体,经验证本法采用沉淀蛋白质的前处理可有效避免上述问题,且能够有效去除蛋白质带来的测定干扰。
3.2 比色法测定多糖并非特异性反应,出现测定结果平行偏差较大,所以试验中沉淀、洗涤、弃上清液、样液的转移等操作都要严谨,实际操作时可增加平行样的测定[11]。
