新生大鼠缺氧缺血性脑病中NLRP3的变化①
2020-08-05王显鹤张晓波
李 蕊,王显鹤,张晓波,聂 影
(1.佳木斯大学附属第一医院,黑龙江 佳木斯 154003;佳木斯大学病理解剖教研室,黑龙江 佳木斯 154007)
全世界每年约1.4亿儿童出生,我国新生儿缺氧缺血性脑病(Hypoxic-ischemic Encephalopathy,HIE)发病率为:足月活产儿的3‰~6‰,其脑损伤可造成死亡或癫痫、脑瘫、认知/行为的障碍或智力低下等严重的神经系统后遗症[1]。其发病原因复杂,其中炎症是其瀑布式级联反应的关键因素,是能够激活固有免疫的,这种不适当的长期神经炎症会导致继发性新生儿脑损伤[2]。近年来研究进一步发现,炎症小体与中枢神经系统疾病的早期发生及其发展密切的相关[3]。炎症小体被认为是调节固有免疫的中心信号枢纽,NOD样受体(NLRs)存在于胞浆内,同时可以感知细胞内信号,其家族成员包括典型的NLRP1、NLRP3及NLRC4等,非典型即微生物DNA可触发的PYRIN 和 AIM2。上述成员与衔接蛋白ASC(即凋亡相关的斑点样蛋白)形成复合物后,可募集并激活caspase-1。不同的NLR组合具有特异性,特定的组合能够在机体受到外界信号刺激或感染时识别病原体相关分子模式,或内源性危险信号损伤相关分子模式。NLPR3炎症小体激活caspase-1,可促使炎性因子白介素-1β和白介素-18等的分泌,继发炎症反应,可造成神经系统损伤。NLRP3激活可以介导各种中枢神经系统疾病,例如阿尔兹海默症[4]、脑膜炎[5]、脑外伤[6]及脑卒中[7]。但目前对新生大鼠HI脑损伤方面研究较少。因此,本研究基于NLRP3炎症小体信号通路,观察其与新生大鼠脑缺氧缺血后神经炎症及脑组织损伤的关系,探索缺氧缺血性脑组织损伤的发生发展机制,为其免疫调节治疗提供新的理论基础和实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物: SPF级7d龄Sprague-Dawley(SD)实验新生大鼠60只,无性别差异,体重在(13±2)g范围内,购置于佳木斯大学实验动物中心。许可证号SCXK(吉)-2018-0007。实验动物于温度(23±3℃)、相对湿度保持(60±5)%、12h明暗光交替,自由地进行饮水、摄食。
1.1.2 主要试剂和仪器:兔抗NLRP3抗体(Abcam公司);SABC、DAB显色试剂盒(武汉博士德生物工程公司)。
1.2 方法
1.2.1 动物分组:本实验将60只SD大鼠,随机分为;缺氧缺血性脑损伤组(HIE组)、假手术组(Sham组)及空白对照组(Control组),每组20只;每组再分为2个小组,于实验开始6h和7d时间段检测,每小组10只。
1.2.2 HIE模型建立:HIE组采用改良Rice-Vannuncci法建立:无性别差异的7d龄SD大鼠在加热垫37℃上,使用乙醚进行吸入麻醉,颈部正中偏右纵行5mm切口后,玻璃针对皮下组织、迷走神经等逐层分离开,暴露右侧颈总动脉(RCCA),应用5-0号丝线将RCCA近心端、远心端永久结扎间断。在开始缺氧前将其放回母鼠身边30min,然后放置于37℃恒温缺氧箱中给予92%:8%N2:O2(3L/min)缺氧2.5h[8]。Sham组接受相同手术程序,不给予RCCA结扎缺血,不做缺氧处理。Control组不做任何处置。研究过程中手术过程低于10min,为避免体温过低,环境处于26~28℃。
1.2.3 小鼠脑组织的获取:新生SD大鼠分别于6h和7d时间段取材。开胸后充分暴露心脏,从心尖部插入灌注针头至左心室,剪开右心耳,快速灌注0.9%NaCl的同时观察肝、肺组织,颜色变白、右心耳流出处液体为透明无血色后,灌注4%多聚甲醛,待其四肢抽动及全身组织变硬后取材,打开乳鼠颅腔,仔细摘取其脑组织,固定于4%多聚甲醛中。
1.2.4 HE染色:进行HE染色,于光学显微镜下观察各组神经元的形态改变并拍摄组织图片。
1.2.5 尼氏染色:尼氏染液染色,光学显微镜下观察存活神经元数量和脑细胞胞浆出现的尼氏小体并拍摄组织图片。
1.2.6 免疫组化:石蜡切片脱蜡,SABC法进行IHC。在高倍显微镜镜下检查,每指标选4张切片,随机采集视野5个检测,应用Image pro plus 6.0分析软件进行平均光密度值(IOD)检测。
1.3 统计学方法

2 结果
2.1 脑组织HE染色
Sham组及Control组其新生SD大鼠的大脑皮质区域的神经元结构完整、层次清晰、形态及数量正常。胞膜完整,核居中且圆,核仁深,异染色质少,未见随时间变化出现特殊病理改变。HIE组随时间段演变脑组织发生病理学变化,即HI后6h,可见大脑皮层区域的神经元数量减少,周围腔隙有所扩大,毛细血管管腔可见扩张,周围有红细胞聚集。HI后7d,光镜下明显可见神经元细胞体肿胀,局部病灶出现坏死神经元胞核固缩及碎屑,胶质细胞增生明显(图1)。

A B C
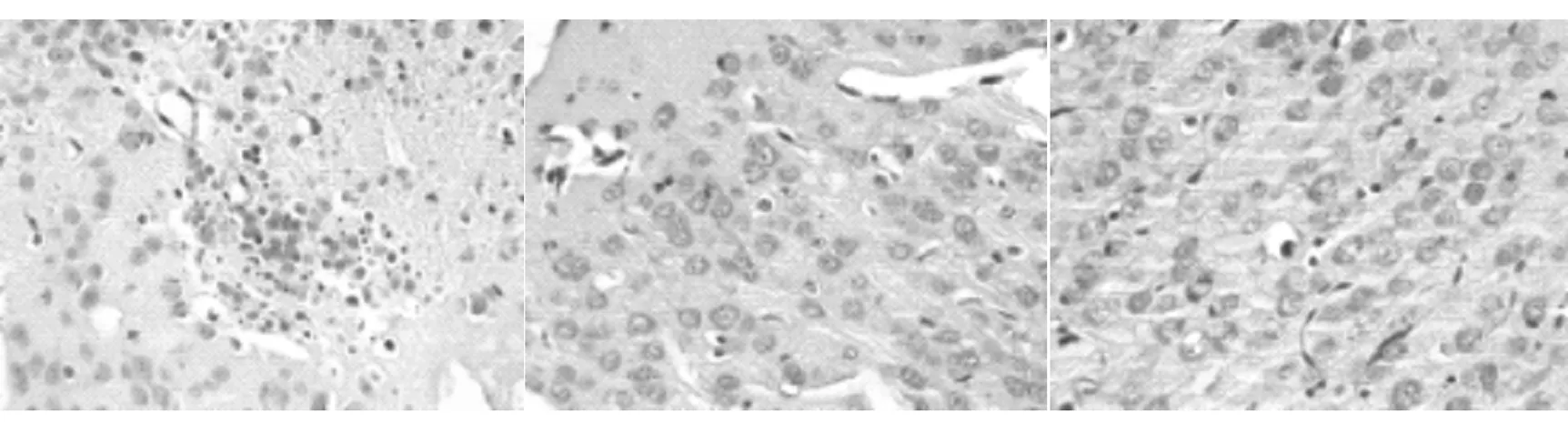
D E F
A为HIE组6h;B为Sham组6h;C为Control组6h;D为HIE组7d;E为Sham组7d;F为Control组7d
图1 新生SD大鼠HE染色(×400)
2.2 脑组织Nissle染色
Sham组及Control组神经元细胞胞体呈圆形,核仁清晰,胞浆深染,存在密集且深染的尼氏小体。HIE组可见明显神经元受损,部分胞核偏位或溶解,空泡样表现,尼氏小体染色稀疏且色浅,部分存在中央型尼氏小体消失,嗜碱性颗粒数量减少,呈现细尘状颗粒大小或仅边缘少量残留(图2)。

A B C

D E F
A为HIE组6h;B为Sham组6h;C为Control组6h;D为HIE组7d;E为Sham组7d;F为Control组7d
图2 新生SD大鼠Nissle染色(×400)
2.3 脑组织中NLRP3蛋白表达
与Sham组及Control组比较,HIE组新生SD大鼠大脑皮质中NLRP3表达明显上调(P<0.01),随时间变化表达逐渐增加(P<0.05)。见表1。

表1 3组SD新生大鼠脑组织不同时间点NLRP3的表达
3 讨论
高发病率、高致残率及高致死率是HIE的主要特点,严重威胁新生儿健康。现有手段亚低温治疗因其治疗时间窗口窄、最初冷却最佳时间、治疗深度及持续时间仍存在不确定性[9]。因此迫切探寻有效治疗方法。炎症是新生儿缺氧缺血性脑病瀑布式级联反应的重要因素。缺血缺氧导致脑内急性能量衰竭,使脑内免疫细胞小胶质细胞及微胶质细胞激活,小胶质细胞成为吞噬物的同时释放炎症介质,星形胶质细胞造成谷氨酸堆积、离子失衡及分泌各种炎症趋化因子,最终造成神经系统损伤[10]。脑缺氧缺血过程中存在的能量持续衰竭,引起脑组织出现代谢改变,即钙离子内流、超载;钠-钾泵、钙泵不良。此为激活NLRP3炎症小体的重要途径。
本实验应用改良Rice法建立新生大鼠缺氧缺血模型,通过HE及尼氏染色观察模型组神经元减少,核浓缩及碎裂,神经胶质细胞增生及中央型尼氏小体消失证明模型制造成功。应用免疫组化染色方法检测NLRP3蛋白表达,结果显示与假手术及正常对照组比较脑组织缺氧缺血后NLRP3炎症小体于神经元胞膜及胞浆NLRP3蛋白表达水平升高,本实验结果表明缺氧缺血可引起炎症小体NLRP3活化,继而导致一系列炎症反应。本实验从缺氧缺血急性期6h及进展期7d进行对照,结果显示缺氧缺血组大脑皮质中NLRP3进展期较急性期表达增加,考虑与脑组织缺血再灌注有关。这些结果提示调控NLRP3炎症小体的活化可能是未来干预新生儿缺氧缺血性脑病发生及发展的重要靶点。
与同类研究比较 目前关于炎症小体NLRP3信号通路对新生大鼠缺氧缺血性脑病影响的研究尚缺乏,但在其他中枢神经系统疾病,例如神经退行性变及脑外伤等有关于NLRP3炎症小体对其影响的研究报道。
研究存在的问题及展望 本研究通过动物实验观察缺氧缺血后脑组织病理变化, NLRP3蛋白定位、半定量及定性分析,检测到NLRP3炎症小体信号通路在新生大鼠缺氧缺血性脑损伤过程中存在影响。但缺少更多证据证明炎症小体在该疾病的调控作用,需要未来研究者在分子水平进一步拓展研究。本项目的研究为新生儿缺氧缺血性脑病的诊断和治疗提供了新的研究方向。
