PM2.5对L02肝细胞部分癌基因和凋亡相关基因表达的影响
2020-08-05秦双建李柏茹王冰玉李闰冰徐新云
秦双建 ,李柏茹 ,蔡 颖,郑 凯,王冰玉,李闰冰 ,肖 芳,曾 明,*,徐新云*
(1.中南大学湘雅公共卫生学院,湖南 长沙410078;2.深圳市疾病预防控制中心,广东深圳 518055;3.南华大学公共卫生学院,湖南 衡阳 421001)
当前环境污染问题备受关注,相关研究证实,许多疾病的发生与空气污染有着密切联系[1]。大量流行病学、毒理学资料表明,大气细颗粒物(particulate matter,PM2.5)作为空气污染的主要有害成分,能引发呼吸系统炎症甚至导致心血管系统疾病、免疫系统疾病,进而诱发各类癌症,对人类的健康造成巨大威胁[2-4]。PM2.5的成分中大多包含多环芳烃、重金属离子等多种具有致突变性和致癌性物质[5-7]。人群吸入PM2.5后,它不仅能在肺泡沉积或进入血液循环,甚至可经过肺换气到达其他器官,进而导致肺外器官的损害:最终损害人体健康[8]。已有研究表明,PM2.5对肺和支气管细胞具有明显的致癌致突变作用[9-12]。PM2.5对于肝脏这一主要的解毒代谢器官有直接而深远的影响。多项研究表明,暴露于PM2.5可诱导肝脏的脂质堆积、氧化应激、胰岛素抵抗和炎症反应等[13-14]。目前大量的研究表明PM2.5对肝脏各方面具有危害,因此研究PM2.5对肝细胞是否存在致癌致突变作用,具有一定的理论意义。本文采用不同剂量PM2.5对人正常L02肝细胞进行染毒,检测癌基因(c-myc、c-fos、p53)和凋亡相关基因(Caspase-3、Caspase-8、Bcl-2)在mRNA和蛋白水平的表达变化,为深入探讨PM2.5致癌致突变机制提供科学依据。
1 材料与方法
1.1 主要试剂与仪器
L02细胞购于中国上海细胞库;RPMI 1640培养基、胎牛血清与0.25%Trpsin-EDTA购于美国Gibco公司;DMSO和K2CrO4购于美国Sigma公司;GAPDH、c-myc、c-fos、p53、Caspase-3、Caspase-8及Bcl-2基因PCR引物由上海生工合成;SYBR PrimeScript RT-PCR kit、 PrimeScrip RT reagent kit购 于 日 本TaKaRa公司;p53抗体(2527S)、c-myc抗体(9402S)购于美国Cell Signaling公司;c-fos抗体(SC-166940)、Caspase-3 抗体(SC-7272)、Caspase-8 抗体(SC-81656)、Bcl-2抗体(SC-7382)、β-actin抗体(SC-47778)购于美国Santa Cruz公司;二抗(羊抗鼠IgG-HRP、羊抗兔IgG-HRP)购于美国Thermo Scientific公司;BCA垂直电泳系统(Mini-protean Tetra)购自美国Bio-Rad公司;7500实时荧光定量PCR仪购于美国Applied Biosystems公司;冷CCD成像系统购于美国GE公司;中流量大气采样器(TH-150CⅢ型)购自武汉市天虹仪器有限责任公司。
1.2 PM2.5采集和样品制备
PM2.5样品采集地点于山西太原,将直径为80 mm的石英滤膜装于中型流量采样器,按100 L/min的流量,每天24 h,连续多天采样并收集滤膜。将收集的滤膜剪成2 cm×2 cm大小于烧杯中,加入超纯水致浸没,用锡纸密封烧杯口,超声振荡30~40 min,留取PM2.5悬液,冷却至室温后装入特定容器中,锡箔纸密封,放入-80℃冰箱冷冻24 h,取出,放在真空冷冻干燥机至完全干燥;最后放入超净台中照紫外灯1~2 h,加入灭菌水制备成PM2.5样品混悬液,-20℃保存待用,使用前振荡混匀。
1.3 细胞培养与染毒
L02细胞培养于37℃、CO2体积分数为5%的恒温培养箱中,经细胞消化,以4.5×105/mL的细胞浓度接种到6孔板,每孔加2 mL无FBS的RPMI 1640培养基,待细胞汇合度为70%~80%时进行PM2.5悬液染毒处理。根据课题组前期进行的CCK-8细胞毒性实验,本实验设阴性对照组即不做处理的L02细胞、PM2.5悬液染毒的终浓度分别为10、50 μg/mL,以10 μmol/L的K2CrO4(以下用Cr6+表示)水溶液为阳性对照组,PM2.5混悬液染毒组和阳性对照组细胞均染毒24 h。
1.4 目的基因mRNA表达水平的实时荧光定量聚合酶链式反应检测
PM2.5染毒L02细胞后,提取L02细胞总RNA并反转录合成cDNA,按照试剂盒说明书操作。反转录条件:37℃、15 min,85℃、5 s,4℃、10 min,-20℃冰箱保存cDNA样品。取各组细胞的cDNA 0.4 μL为模板进行实时荧光定量聚合酶链式反应(quantitative real-time PCR,qPCR),检测目的基因c-myc、c-fos、p53、Caspase-3、Caspase-8、Bcl-2的表达。qPCR反应条件:95℃预变性30 s,共1个循环;95℃变性5 s,56℃退火延伸30 s,共40个循环;以GAPDH的CT值为内参,采用2-ΔΔCT计算各基因的相对表达量。目的基因PCR引物见表1。

表1 目的基因PCR引物序列
1.5 Western blot检测目的蛋白表达水平
PM2.5染毒L02细胞结束后,吸取残余培养基,用冷的PBS洗3遍,加入细胞裂解液,置于摇床上,冰上裂解30 min,并用细胞刮刷快速将裂解好的细胞刮落,收集细胞至2 mL EP管中,12 000 r/min,4℃离心25 min。加入5×SDS-PAGE,100℃变性10 min,参照 BCA法进行蛋白定量,样品置于-20℃保存待用。配置10%的分离胶和5%的浓缩胶,每个样品按等体积上样,两边的孔加入预染蛋白质marker作为相对分子质量对照,恒压按80 V、35 min,120 V、40 min条件至电泳结束。随后200 mA恒流转膜90 min,再用5%的脱脂奶粉室温下在摇床上封闭1.5 h。根据目的蛋白的大小,切取相应的条带,配制一抗稀释液,冰上孵育过夜;1×TBST缓冲液洗4次:每次10 min。按1∶5 000比例稀释HPR标记的羊抗鼠、羊抗兔二抗,室温下孵育1 h;1×TBST缓冲液洗3次,每次10 min。加入ECL化学发光试剂后用冷CCD成像系统对其进行曝光拍照,所得图像用Image J软件进行条带灰度值分析。
1.6 统计分析
实验数据以均值±标准差表示,所有实验重复3次;应用SPSS 22.0进行统计学分析,各组间(PM2.5混悬液染毒组、阳性对照组与阴性对照组)mRNA、蛋白表达水平指标间差异的分析采用单因素方差分析:LSD法进行两两比较,以α=0.05为检测水准。
2 结果
2.1 PM2.5染毒后癌基因和凋亡相关基因mRNA表达水平变化
qPCR实验的结果见图1。与阴性对照组比较:10 μg/mL和50 μg/mL PM2.5混悬液染毒组以及阳性对照Cr6+组,c-myc mRNA表达水平分别升高69.5%、118.0%、51.1%;c-fos mRNA表达水平分别升高50.3%、64.4%、23.3%;p53 mRNA表达水平分别下降4.0%、22.0%、18.0%;Caspase-3 mRNA表达分别升高31.0%、30.5%、42.0%;Caspase-8 mRNA表达分别升高25.3%、40.3%、64.5%;Bcl-2 mRNA表达分别降低40.5%、46.9%、41.4%,差异均有统计学意义(P<0.05或P<0.01)。
2.2 PM2.5染毒L02细胞目的蛋白表达水平变化
Western blot的检测结果见图2和图3。结果表明,与阴性对照组比较,c-myc蛋白在10、50 μg/mL PM2.5混悬液和Cr6+染毒后表达水平分别升高32.3%、49.3%、70.6%;c-fos蛋白表达水平分别升高11.3%、50.2%、45.2%;p53蛋白表达水平分别下降17.5%、40.0%、42.9%;Caspase-3蛋白表达水平分别升高23.1%、33.9%、43.1%;Caspase-8蛋白表达水平分别升高31.4%、52.1%、80.0%;Bcl-2蛋白表达量分别下降14.3%、23.3%,36.9%,差异均有统计学意义(P<0.05或P<0.01)。
3 讨论

图1 PM2.5染毒对L02细胞c-myc、c-fos、p53、Caspase-3、Caspase-8和Bcl-2 mRNA表达水平的影响

图2 PM2.5染毒对L02细胞c-myc、c-fos和p53蛋白表达水平的影响
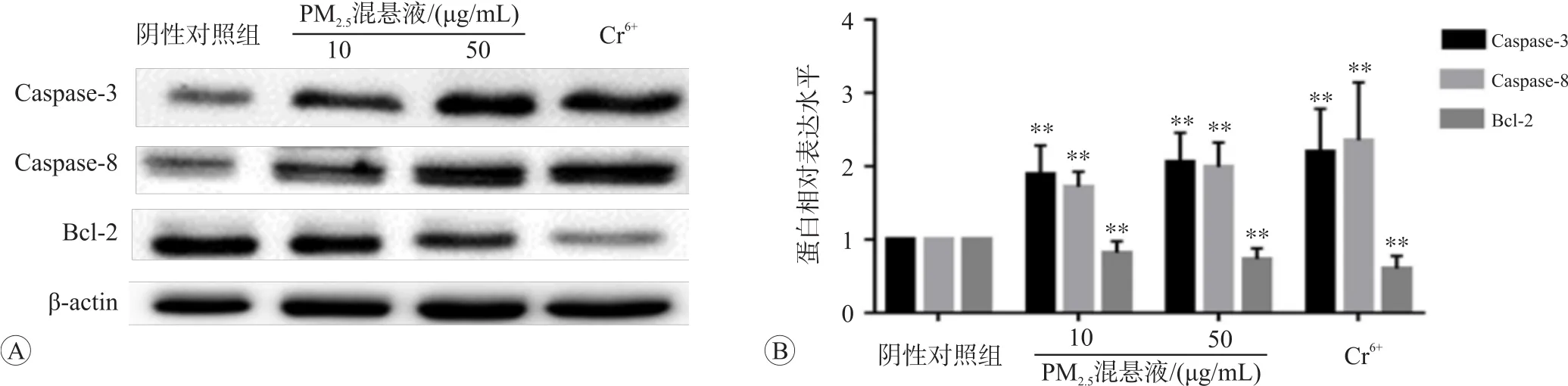
图3 PM2.5染毒对L02细胞Caspase-3、Caspase-8和Bcl-2蛋白表达水平的影响
本文结果显示,L02细胞经阳性对照物Cr6+染毒后,c-myc、c-fos、Caspase-3、Caspase-8 mRNA及蛋白表达均明显升高(P<0.05或P<0.01),p53、Bcl-2 mRNA及蛋白表达水平均明显下降(P<0.05或P<0.01)。经PM2.5染毒处理后,PM2.510 μg/mL和50 μg/mL混悬液组引起 c-myc、c-fos、Caspase-3、Caspase-8 在mRNA和蛋白表达水平显著高于对照组(P<0.05或P<0.01);p53、Bcl-2 mRNA和蛋白在PM2.510 μg/mL和50 μg/mL混悬液组中表达水平均明显下降(P<0.05或P<0.01)。这些结果提示大气PM2.5对L02细胞中促癌基因和凋亡相关基因表达具有明显促进作用,推测PM2.5致癌、致凋亡可能与通过促进癌基因和凋亡相关基因表达有关。
我国经济快速发展,严重的环境污染和癌症频发、高发等问题接踵而至[15],而PM2.5常被用于评估空气污染的严重程度[16]。PM2.5的来源及组分很复杂,如果长期吸入PM2.5污染的空气,可造成人体多系统功能性和器质性的损伤。原癌基因是一种广泛存在于真核细胞、可经反转录病毒转导成为致癌活性的癌基因[17]。c-myc可通过调节致癌等相关基因的表达,参与恶性转化和肿瘤进展。每年约70 000例美国癌症死亡病例中发现了c-myc基因改变,其中包括肝细胞癌[18]。正常细胞中c-fos基因表达水平较低,而在炎症细胞中受炎症介质的刺激,引起c-fos基因快速表达[19]。正常情况下,p53蛋白是抑癌因子,调控生命活动的各个方面。Caspase-8与Caspase-3在Caspase级联反应中处于核心地位,是细胞凋亡发生的关键步骤及传导的共同通路。Caspase-8与Caspase-3在已知的TRAIL/TRAIL-R介导的细胞凋亡途径中也同样起重要作用[20]。Bcl-2家族蛋白在细胞凋亡调节中发挥着关键作用,且Bcl-2高表达时可明显抑制细胞凋亡。
目前大气污染与癌症发病存在密切联系,虽然现有大部分研究主要针对PM2.5与呼吸系统疾病,探讨PM2.5致癌分子机制,但由于PM2.5对人体多器官多系统都存在健康危害,因此本文采用PM2.5染毒L02细胞,开展PM2.5对L02肝细胞相关癌基因和凋亡相关基因表达影响的研究,结果表明PM2.5染毒引起L02肝细胞中促癌基因和促凋亡相关基因表达升高,抑癌基因和抑凋亡相关基因表达下降,提示PM2.5对L02肝细胞促凋亡相关基因和促癌基因具有一定的促进与激活作用。本研究结果对于今后进一步深入探讨PM2.5的健康危害,具有一定的理论意义和应用价值。
