右美托咪定术中干预对老年小鼠围术期神经认知障碍的影响及其可能机制*
2020-08-04于文华孟馥芬姜莉莉刘亚华
于文华, 孟馥芬, 姜莉莉, 闫 睿, 刘亚华
(新疆医科大学附属肿瘤医院麻醉科,新疆乌鲁木齐830011)
围术期神经认知障碍(perioperative neurocognitive disorders,PND)是指围术期患者的认知功能变化,在老年(>60岁)患者的发生率远大于非老年的成年患者,且随着年龄的增大而增高[1-2]。PND 导致的注意力、精神状态和意识水平的变化多出现在术后早期到术后数月[3],并可能持续影响患者生活质量和疾病预后,甚至导致老年痴呆的发生[4]。降低老年患者术后认知功能障碍的发生率,在延长其生命的同时改善其生存质量是手术预后面临的挑战。PND 的病因尚未明确,诱因较多,临床表现复杂,治疗手段有限,并往往被医护人员忽视,得不到及时的确诊和有效的干预[5]。
右美托咪定(dexmedetomidine,DEX)与其它通过下丘脑腹外侧视前区(ventrolateral preoptic region,VLPO)神经元环路下游γ-氨基丁酸受体发挥作用的镇静药物不同,是通过VLPO调节觉醒以发挥镇静作用的麻醉辅助药物[6]。DEX 可在神经系统遭受创伤时抑制机体的炎症反应,减少氧化应激反应并调节细胞凋亡[7]。也有研究报道,DEX 可降低老年患者术后认知功能障碍[8],但其具体机制并不清楚。因此,本研究建立PND 小鼠模型,探讨术中DEX 干预对老年小鼠术后认知功能的改善作用及其机制,以期为今后DEX应用于老年患者手术的麻醉过程提供参考资料。
材 料 和 方 法
1 仪器与器材
DEX 注射液购于江苏恒瑞医药股份有限公司;RIPA 裂解液、BCA 蛋白定量试剂盒、焦油紫染液、抗β-肌动蛋白(β-actin)抗体、生物素标记的II 抗、辣根过氧化物酶标记的链霉卵白素、辣根过氧化物酶标记的II抗和一步法TUNEL染色试剂盒(绿色荧光)购于上海碧云天生物技术有限公司;抗胶质细胞原纤维酸性蛋白(glial fibrillary acidic portein,GFAP)抗体购自Sigma;抗白细胞介素6(interleukin-6,IL-6)抗体购自Novus;抗肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和 cleaved caspase-3 抗体购自 Abcam。
2 实验动物、手术模型及分组处理
60 只 14 月龄 SPF 级雄性 C57BL/6J 小鼠(体重28~32 g)购自新疆医科大学动物实验中心[SCXK(新)2018-0001]并饲养在SPF 级动物房[SYXK(新)2018-0003]中,小鼠可自由进食进水。所有实验开展前,小鼠均在饲养环境下适应1 周。小鼠被随机分为假手术(sham)组、手术(surgery)组和DEX 干预组(DEX 组),每组20 只小鼠。左肝外叶切除术组小鼠通过术前吸入0.3%异氟烷麻醉,在术中利用0.1%异氟烷0.3 L/min 维持麻醉,并进行左肝外叶切除术;DEX 干预组小鼠在手术组的基础上,在术中增加DEX(15 μg/kg,腹腔注射)[9];假手术组麻醉方式同手术组,仅开腹,但不进行左肝外叶切除术。术后1~3 d 注射青霉素预防切口感染,术后2 周小鼠进行后续行为学实验。术后小鼠无死亡现象。
3 方法
3.1 Morris 水迷宫实验 通过水迷宫装置(直径120 cm,高50 cm;ACT-200A 型,Coulbourn)对小鼠进行Morris 水迷宫测试。注入水(恒温25℃,水深25 cm),调整平台低于水面1 cm,小鼠被放置在一个随机的象限中。实验开始前1 d训练小鼠站台,随后在实验开始的1~5 d记录小鼠找到平台的时间(逃避潜伏期),并在第6 天沉降平台至水池底部,记录小鼠在平台所在象限的停留时间及第1 次进入平台所在象限所用时间。实验期间保持安静无人的实验环境。采用装置自带视频跟踪软件输出小鼠的运动轨迹。
3.2 Y迷宫实验 通过Y迷宫实验装置(水平三臂,长 30 cm,宽 6 cm,高 15 cm,各臂夹角为 120°;RD1102-YM-M 型,上海移数信息科技有限公司)统计小鼠自发交替率研究其空间认知能力。将小鼠放置任意一个臂末端,通过自带摄像装置记录10 min内小鼠进入各个臂的顺序。一个自发的交替被定义为连续选择进入3 个不同的区域。每只小鼠实验结束后,用清水彻底清洗迷宫,去除残留的气味,然后进行下个小鼠实验。
3.3 电生理记录 在行为学实验结束后,每组任取10只小鼠,断颈,快速取出完整脑组织并迅速置于O2和CO2混合的切片液中并切取35 μm 脑片,随后迅速转移至氧饱和的人工脑脊液(NaCl 124 mmol/L,KH2PO41.25 mmol/L,KCl 2.69 mmol/L,MgSO42 mmol/L,CaCl22 mmol/L,NaHCO326 mmol/L,葡萄糖10 mmol/L)中。用微分干涉相差显微镜(DMi8-M型,Leica)观察海马并找到CA1 区。以Axoclamp-2B膜片钳给予刺激,记录场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP)以反映长时程增强(long-term potentiation,LTP),取1/3 fEPSP 最大反应刺激作为基线刺激强度,基线至少记录10 min,记录时连续用O2和CO2饱和的人工脑脊液灌流。
3.4 小鼠脑组织分离 在行为学实验结束后,将每组剩余的10 只小鼠通过腹腔注射戊巴比妥钠(50 mg/kg)麻醉,快速取出完整脑组织,在冰上快速分离出双侧海马组织。海马组织分成3 部分,一部分直接冻存在-80℃冰箱用于后续Western blot 检测,另一部分用于制作石蜡组织并切成6 μm 厚度石蜡切片;最后一部分用制作冰冻组织并切成8 μm 厚度冰冻切片。
3.5 尼氏染色 石蜡脑片经常规脱蜡至水后,用1%焦油紫30 min。自来水冲洗1 min,70%乙醇分化30 s,常规脱水、透明、封片后,在显微镜(DSX510型,Olympus)下观察,并随机选取5 个视野拍照,用ImageJ软件对尼氏体计数。
3.6 免疫组化染色 石蜡脑片经常规脱蜡至水后,用 3% 的 H2O2处理 5 min,PBS 浸泡 5 min,用 0.01 mmol/L枸橼酸盐缓冲液抗原修复。用10%山羊血清在37℃下封闭脑片1 h 后,滴加I 抗(抗GFAP 抗体,1∶500)并在37℃下孵育2 h,PBS冲洗脑片2次,每次5 min,滴加生物素标记的II抗(1∶200)并在37℃孵育20 min,PBS冲洗脑片2次,每次5 min,滴加辣根过氧化物酶标记的链霉卵白素(1∶200)并在37℃孵育20 min,PBS 冲洗脑片 2 次,最后以 DAB 溶液显色 5 min,自来水冲洗 2 min。在显微镜(DSX510 型,Olympus)下观察,并随机选取5 个视野拍照,通过ImageJ软件统计阳性信号。
3.7 免疫荧光实验 在室温下,用0.5% Triton X-100 溶液处理冰冻脑片2 min,用10%山羊血清在37℃下封闭1 h 后,滴加I抗(抗NeuN 抗体,1∶1 500)孵育2 h。PBS 冲洗脑片2 次,每次5 min,滴加FITC标记的II 抗(1∶500),暗室室温孵育1 h。在荧光显微镜(Q-PHASE 型,TESCAN)下观察,随机选取5 个视野,通过ImageJ软件统计阳性信号。
3.8 TUNEL 染色 在室温下,用4%多聚甲醛溶液固定冰冻脑片10 min,PBS 冲洗脑片2 次,每次5 min,用 0.5% Triton X-100 溶液处理 2 min,PBS 冲洗脑片2次,每次5 min,滴加50 μL TUNEL检测液并在暗室室温孵育1 h。并用DAPI 复染5 min,在荧光显微镜(Q-PHASE 型,TESCAN)下观察,随机选取5 个视野,用ImageJ软件对TUNEL阳性细胞计数。
3.9 Western blot 用RIPA 裂解液裂解海马组织并提取全蛋白,蛋白用BCA 法定量,取40 μg 蛋白样品进行电泳并电转移至PVDF膜。以5%脱脂牛奶室温下封闭1 h,随后加I抗(抗GFAP 抗体,1∶2 000;抗βactin 抗体,1∶4 500;抗 IL-6、TNF-α 和cleaved caspase-3 抗体,1∶1 000)4℃孵育过夜。TBST 洗膜2 次,每次10 min,室温孵育 HRP 标记的 II 抗 1 h,TBST 洗膜 2次,每次5 min,暗室ECL 法显影于胶片。胶片进行扫描后,以β-actin为参照,用ImageJ软件量化目的蛋白表达。
4 统计学处理
数据表示为均数±标准误(mean±SEM),使用SPSS 20.0 软件对数据进行分析。多组数据之间比较采用单因素方差分析及Bonferroni 校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 右美托咪定对老年小鼠术后认知行为的影响
各组小鼠在Morris 水迷宫实验中的运动轨迹见图1A。与假手术组比较,手术组小鼠在Morris 水迷宫实验第2~5 天的逃避潜伏期显著延长(P<0.01),在Morris 水迷宫实验第6 天滞留于平台所在象限的时间显著缩短(P<0.01),且首次进入平台所在象限的潜伏期显著延长(P<0.01);与手术组比较,DEX干预组小鼠在Morris 水迷宫实验第2~5 天的避潜伏期显著缩短(P<0.01),在Morris水迷宫实验第6天滞留于平台所在象限的时间显著延长(P<0.01),且首次进入平台所在象限的潜伏期显著缩短(P<0.01),见图1B~D。在Y 迷宫实验中,与假手术组比较,手术组小鼠自发性交替率显著降低(P<0.01);DEX 干预组小鼠自发性交替率较手术组小鼠显著升高(P<0.01),见图1E。
2 右美托咪定对老年小鼠术后海马神经元的保护作用
尼氏染色结果显示,手术组小鼠海马CA1 区单位面积内尼氏染色阳性细胞数相比于假手术组显著减少(P<0.01),而术中DEX 干预可显著逆转这些改变(P<0.01),见图2A。NeuN 免疫荧光结果显示,DEX 干预组海马NeuN 阳性细胞数相比于手术组显著增加(P<0.01),见图2B。
3 右美托咪定对老年小鼠术后海马LTP的影响
通过膜片钳记录小鼠海马CA1 区LTP,实验结果显示,在突触前给予高频电刺激后,相比于假手术组,手术组小鼠单个刺激引起的突触后诱发电位幅度降低,DEX 干预组电位幅度基本与假手术组相近;通过统计,DEX 干预组fEPSP 斜率显著高于手术组(P<0.01),见图3。

Figure 1.Effects of dexmedetomidine(DEX)on postoperative cognitive behavior in aged mice.A:water maze trajectory maps;B:escape latency in water maze experiment;C:residence time in the quadrant of platform in water maze experiment;D:exploration latency in water maze experiment;E:Y maze spontaneous alternation rate.Mean±SEM. n=20.##P<0.01 vs sham group;**P<0.01 vs surgery group.图1 右美托咪定对老年小鼠术后认知行为的影响

Figure 2.Protective effect of dexmedetomidine(DEX)on hippocampal neurons in aged mice after operation.A:Nissl staining results of hippocampal CA1 region;B:immunofluorescence results of NeuN protein in hippocampal CA1 region.Scale bar=50 μm.Mean±SEM. n=10.##P<0.01 vs sham group;**P<0.01 vs surgery group.图2 右美托咪定对老年小鼠术后海马神经元的保护作用
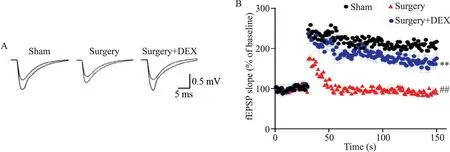
Figure 3.Effect of dexmedetomidine(DEX)on long-term potentiation(LTP)in hippocampus of aged mice after operation.A:diagrams of LTP changes in hippocampal CA1 region;B:scatter plot of field excitatory postsynaptic potential(fEPSP)slope at different time points.Mean±SEM. n=10.##P<0.01 vs sham group;**P<0.01 vs surgery group.图3 右美托咪定对老年小鼠术后海马LTP的影响
4 右美托咪定对老年小鼠术后海马星形胶质细胞活化的影响
与假手术组比较,手术组小鼠海马星形胶质细胞增多,GFAP 表达水平显著升高(P<0.001);与手术组比较,DEX 干预组小鼠海马星形胶质细胞减少,GFAP 表达水平显著降低(P<0.01),见图4A、B。TUNEL 染色结果显示,手术组小鼠海马TUNEL 阳性染色神经元显著增多(P<0.01),而DEX 干预可显著降低老年小鼠术后海马神经元凋亡率(P<0.01),见图4C。
5 右美托咪定对老年小鼠术后海马组织炎症因子和凋亡因子的影响
Western blot实验结果显示,与假手术组相比,手术组小鼠海马组织TNF-α、IL-6 及cleaved caspase-3的蛋白水平显著升高(P<0.01),而DEX 干预能显著降低上述蛋白水平(P<0.01),见图5。
讨 论
PND 是老年患者术后常见的并发症之一[1-3,8]。PND 的发生是多种因素造成的,主要与胆碱能系统、神经递质、氧化应激及炎症细胞因子有关[10]。对PND 避免和防范是临床老年患者手术过程中亟待解决的问题。本研究在C57BL/6J老年小鼠左肝外叶切除术中给予DEX 干预,并利用Y 迷宫和水迷宫评价动物记忆情况。其中Y 迷宫测试可区分工作记忆和参考记忆情况;而水迷宫中的穿越原平台位置次数反映工作记忆中对获取有效信息的能力和记忆的保持能力。本研究的行为学结果显示,手术组小鼠工作记忆发生障碍;与手术组比较,DEX 干预组工作记忆错误次数明显减少,总错误次数明显减少,穿台次数明显增加,表明术中DEX 干预可显著改善老年小鼠术后认知功能。LTP 是评价学习记忆及突触可塑性的常用生理指标。本研究通过膜片钳技术记录了术中DEX 干预对老年小鼠海马CA1 区LTP 的影响,结果显示术中DEX干预可显著逆转术后引起的突触后电位幅度减小。
DEX 可以改善老年患者全麻术后认知功能[8,11],但其具体机制仍不明晰。已有研究通过对行下胫骨骨折内固定术的老年小鼠的血脑屏障和海马进行检测发现,小鼠术后表现为血脑屏障破坏和海马受损[12]。海马受损将导致认知功能障碍[13-14]。海马位于大脑丘脑和内侧颞叶之间,属于边缘系统的一部分,在记忆和认知等方面有重要作用,尤其与短时记忆以及对环境的感知有着非常明确的关系[15]。已有研究表明,在老年小鼠创伤术后海马神经元会发生丢失和凋亡,海马神经元创伤是认知功能障碍发生的关键步骤[16]。本研究结果显示,术中DEX 干预可明显逆转手术导致的老年小鼠海马神经元丢失和凋亡。手术创伤应激可导致小胶质细胞和星形胶质细胞的活化以及海马组织促炎因子TNF-α 和IL-1β 生成增多[17-18]。小胶质细胞和星形胶质细胞的活化和神经炎症是诱导PND 发生的必要条件[17-18]。因此,我们进一步思考术中DEX干预对术后老年小鼠认知功能的改善是否与星形胶质细胞活化有关。本研究通过免疫荧光、免疫组化和Western blot 实验证实了术中DEX干预可抑制手术后老年小鼠星形胶质细胞活化及炎症因子TNF-α和IL-6的生成。

Figure 4.Effects of dexmedetomidine(DEX)on the activation of hippocampal astrocytes in aged mice after operation.A:immunohistochemical staining for GFAP in hippocampus of aged mice;B:Western blot results of GFAP protein in hippocampus of aged mice;C:TUNEL immunofluorescence staining results and apoptotic rate analysis.Scale bar=50 μm.Mean±SEM. n=10.##P<0.01 vs sham group;**P<0.01 vs surgery group.图4 右美托咪定对老年小鼠术后海马星形胶质细胞活化的影响

Figure 5.Effects of dexmedetomidine(DEX)on the levels of inflammatory and apoptotic factors in hippocampal tissues of aged mice after operation.Mean±SEM. n=10,##P<0.01 vs sham group;**P<0.01 vs surgery group.图5 右美托咪定对老年小鼠术后海马组织炎症因子和凋亡因子的影响
综上所述,本研究证明了术中DEX 干预可抑制海马星形胶质细胞活化、神经炎症及神经元凋亡,从而保护海马神经元,达到改善老年小鼠术后认知功能的作用。
