下调miR-153-3p可促进Nrf2表达从而减轻H2O2诱导的H9C2细胞损伤*
2020-08-04黄兆琦黄炯华
黄兆琦, 许 卫, 黄炯华, 卢 雄△
(1广州医科大学附属第三医院心内科,广东广州510150;2广州市花都区人民医院心内科,广东广州510800)
心血管疾病是全球范围内人类死亡的首要原因[1]。急性心肌梗死(acute myocardial infarction,AMI)是一种严重的心脏缺血性疾病,治疗过程中可发生心肌缺血再灌注损伤[2],后者是指心肌缺血缺氧后再恢复血液灌流,引起心肌损伤进一步加剧的过程[3]。目前研究表明,再灌注后大量活性氧簇(reactive oxygen species,ROS)的生成是氧化损伤以及心肌细胞凋亡的主要原因之一[4]。
微小RNA(microRNA,miRNA)是一种单链非编码RNA,其可通过与目标基因3'端非翻译区(3'-untranslated region,3'-UTR)结合,在转录后水平调控基因表达[5]。当前研究表明,miRNA 在缺血再灌注损伤中具有重要作用[6]。在缺血再灌注损伤中,心肌组织中 miR-499 和 miR-328 表达明显升高[7-8]。有研究报道,miR-153-3p 高表达可改善肝细胞氧化应激损伤[9],而其在心肌细胞氧化损伤中的作用却少见报道。
本研究将通过H2O2诱导H9C2 细胞发生氧化应激损伤,通过MTT 实验和RT-qPCR 检测氧化应激状态下H9C2 细胞的活力和miR-153-3p 表达的变化。随后观察敲减miR-153-3p表达对H2O2诱导的H9C2细胞损伤的影响,并通过双萤光素酶报告基因实验检测miR-153-3p的作用靶点。
材 料 和 方 法
1 试剂
K1622 逆转录试剂盒购自Fermentas;SYBR®Premix Ex Taq™ II 购自 TaKaRa;RNeasy 试剂盒和Taq PCR Master Mix 购自 Qiagen;RIPA 裂解液购自Solarbio;BCA 试剂盒购自 Thermo;MTT 溶液购自Amresco;miR-153-3p mimic、miR-153-3p inhibitor、miR-153-3p 阴性对照(negative control,NC)、NFE2L2质粒和NFE2L2-3′-UTR突变质粒由上海吉玛公司合成;Lipofectamine 2000 购自Invitrogen;丙二醛(malondialdehyde,MDA)比色试剂盒(TBA 法)、总超氧化物歧化酶(superoxide dismutase,SOD)比色试剂盒(NBT 法)和Annexin V-FITC/PI 细胞凋亡检测试剂盒购自上海碧云天公司;核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)转录因子检测试剂盒购自武汉艾美捷公司;萤火虫萤光素酶报告质粒pMIR-Report购自Ambion;其余试剂均购自Sigma-Aldrich。
2 方法
2.1 细胞培养 H9C2 细胞购自ATCC,在37℃、5%CO2细胞培养箱中培养,培养环境为添加10%胎牛血清的DMEM 培养基,并添加1×105U/L 青霉素和100 mg/L链霉素。
2.2 细胞转染与H2O2处理 细胞转染实验:取对数期H9C2 细胞接种于6 孔板,待细胞贴壁后,按照转染说明书步骤采用Lipofectamine 2000试剂进行miR-153-3p mimic、miR-153-3p inhibitor 或 miR-153-3p NC转染(48 h),构建miR-153-3p NC、miR-153-3p mimic和miR-153-3p inhibitor转染细胞;取已转染miR-153-3p NC 或 miR-153-3p inhibitor 的 H9C2 细胞,再次通过Lipofectamine 2000 试剂转染阴性对照siRNA(negative control siRNA,si-NC)或NrfsiRNA(si-Nrf2)48 h,用于构建 miR-153-3p NC+si-NC、miR-153-3p inhibitor+si-NC 和miR-153-3p inhibitor+si-Nrf2转染细胞。
H2O2处理:采用多种浓度(0、50、100、200 和400 μmol/L)的 H2O2分别处理 H9C2 细胞 48 h 后,收集细胞用于后续实验;或根据实验要求取已转染的上述细胞采用200 μmol/L H2O2处理48 h 后,收集细胞用于后续实验。
2.3 MTT 法检测细胞活力 取H9C2细胞或已转染的H9C2细胞接种在96孔板中,并按照2.2方法进行H2O2处理细胞 48 h 后,向每孔中加入 50 μL MTT 溶液,在37℃条件下继续孵育4 h。再向每孔加入150 μL 二甲基亚砜,待结晶充分溶解后,使用多功能酶标仪测定各孔490 nm处的吸光度(A)值。
2.4 RT-qPCR 实验 取2.2 中处理的细胞,使用RNeasy 试剂盒提取细胞中总RNA。将提取的RNA通过K1622 试剂盒逆转录成cDNA。然后在Taq PCR Master Mix 体系中将 cDNA 作 qPCR 模板并添加引物和SYBR®Premix Ex Taq™ II 进行RT-qPCR。本实验所用miR-153-3p 的正向引物序列为5′-ACACTCCAGCTGGGTTGCATAGTCACAAA-3′,反向引物序列为 5′-CAGTGCGTGTCGTGGAGT-3′;U6 的正向引物序列为5′-CCCTTCGGGGACATCCGATA-3′,反向引物序列为 5′-TTTGTGCGTGTCATCCTTGC-3′。miR-153-3p相对于U6的表达量采用2-ΔΔCt法进行量化分析。
2.5 抗氧化反应元件(antioxidant response element,ARE)活性的测定 ARE 活性通过Nrf2 转录因子检测试剂盒测定。采用多种浓度(0、50、100、200 和400 μmol/L)的 H2O2分别处理 H9C2 细胞 48 h 后,收集细胞。按照说明书步骤,采用核蛋白萃取液裂解细胞,并采用 100 000×g离心 10 min 收集上清液;取样品 100 μL 加入 96 孔板,然后加入 Nrf2 转录因子结合分析液孵育25 min,加入反应终止液孵育10 min。利用多功能酶标仪检测各孔450 nm处的A值。
2.6 MDA 含量的测定 取2.2 中处理的细胞,使用100 μL RIPA 裂解液裂解细胞,并采用 100 000×g离心10 min 收集上清液。按照说明书步骤,取样品和标准品各 100 μL 加入 EP 管,再分别加入 200 μL MDA 检测工作液,混匀,沸水浴15 min,并冷却至室温。1 000×g离心10 min 收集上清液,每样品取100 μL 加入96 孔板,利用多功能酶标仪检测各孔530 nm处的A值。
2.7 SOD 活性的测定 取2.2 中处理的细胞,使用0.1 mL RIPA 裂解液裂解细胞,并采用 100 000×g离心10 min 收集上清液。按照说明书步骤,各取样品20 μL 加入 96 孔板,再加入 180 μL NBT 工作液并在37℃条件下继续孵育30 min,利用多功能酶标仪检测各孔560 nm处的A值。
2.8 细胞凋亡的测定 取2.2 中处理的细胞,PBS重悬细胞2 次,按照说明书步骤,避光加入200 μL Annexin V-FITC工作液混匀,并孵育5 min,再加入PI工作液混匀染色15 min。通过流式细胞仪检测凋亡细胞比例。
2.9 双萤光素酶报告基因分析 根据说明书步骤,将 NFE2L2-3′UTR 野 生 型(WT)质 粒 和 NFE2L2-3′UTR 突变型(Mut)质粒克隆至pMIR-Report。取已转染 miR-153-3p NC 或 miR-153-3p mimic 的 H9C2 细胞采用Lipofectamine 2000 分别将NFE2L2 WT/Mut质粒转染至细胞,转染48 h 后,加入反应底物采用Dual-Glo®萤光素酶测定系统(Promega)测定萤光素酶相对活性。
2.10 Western blot 检测蛋白水平 取2.2 中处理的细胞,采用RIPA 裂解细胞后取全蛋白,通过BCA 试剂盒进行定量,各取50 μg 蛋白样品进行10% SDSPAGE 分离。将分离的蛋白转移到活化的PVDF 膜上。用脱脂奶粉封闭PVDF 膜后,加入I 抗(鼠抗Nrf2,1∶1 000;β-actin,1∶5 000)4℃孵育过夜,第2天用PBST洗PVDF膜后,HRP偶联的II抗(1∶1 000)室温孵育 1.5 h。PBST 洗 PVDF 膜后,通过 ECL 法显影,胶片扫描后利用ImageJ软件扫描灰度值。
3 统计学处理
采用SPSS 21.0 软件进行统计分析。计量资料均表示为均数±标准差(mean±SD)。两组间均数比较采用t检验;多组间均数比较采用单因素方差分析及Bonferroni法。以P<0.05为差异有统计学意义。
结 果
1 H2O2处理对H9C2 细胞活性和miR-153-3p 表达的影响
MTT实验结果显示,H2O2浓度依赖性抑制H9C2细胞的活力(P<0.05);RT-qPCR 结果显示,H2O2浓度依赖性促进H9C2 细胞中miR-153-3p 的表达(P<0.05),见图1。
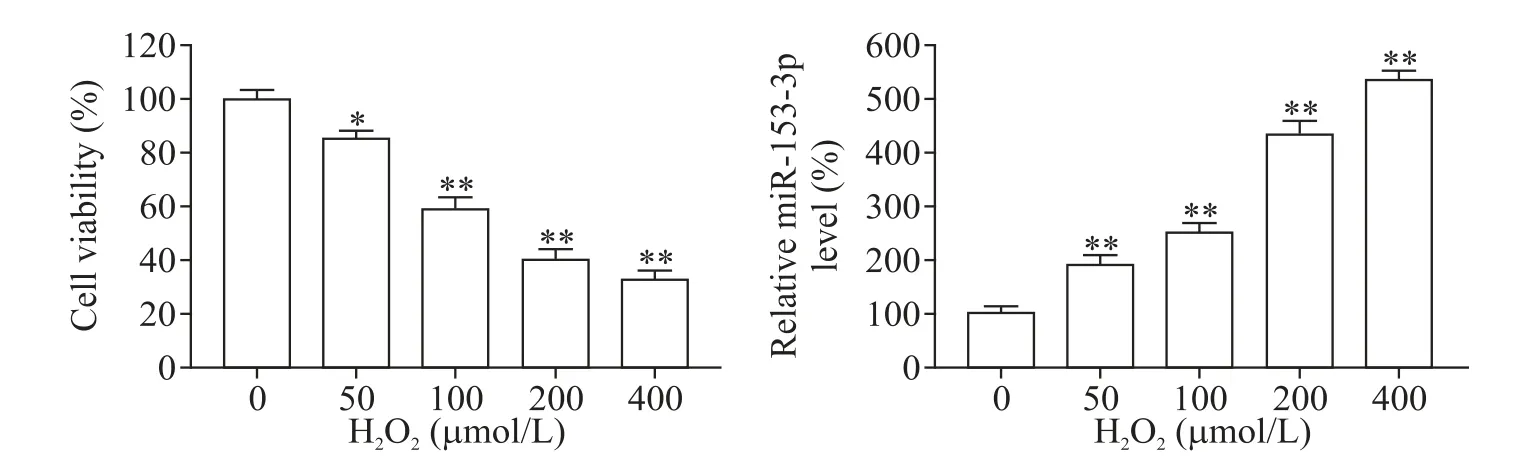
Figure 1.Effects of different concentrations of H2O2 on cell viability and miR-153-3p expression in H9C2 cells.Mean±SD. n=4. *P<0.05,**P<0.01 vs 0 μmol/L group.图1 不同浓度H2O2对H9C2细胞活力和miR-153-3p表达的影响
2 抑制miR-153-3p 表达对H2O2诱导的H9C2 细胞损伤的影响
MTT 实验结果显示,与转染miR-153-3p NC 比较,转染miR-153-3p inhibitor 可显著增强H2O2处理后H9C2 细胞的活力(P<0.01),见图2A。流式细胞术检测结果显示,与转染miR-153-3p NC 比较,转染miR-153-3p-inhibitor 可显著降低H2O2处理后H9C2细胞的凋亡率(P<0.01),见图2B。随后检测H9C2细胞中MDA 含量和SOD 活性的变化,发现与转染miR-153-3p NC 比较,转染 miR-153-3p inhibitor 可显著降低 H2O2处理后 H9C2 细胞内的 MDA 含量(P<0.01),升高SOD 的水平(P<0.01),见图2C。因此,抑制miR-153-3p 可显著降低H2O2引起的H9C2 的细胞的氧化损伤。
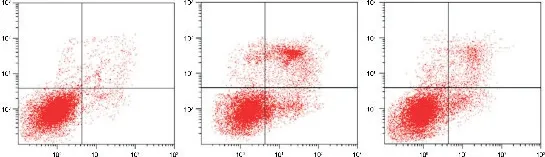
Figure 2.Inhibition of miR-153-3p expression attenuated H2O2(200 μmol/L)-induced oxidative injury of H9C2 cells.A:cell viability was measured by MTT assay;B:apoptosis was analyzed by flow cytometry with Annexin V-FITC/PI staining;C:MDA content and SOD activity were measured by TBA assay and NBT assay,respectively.Mean±SD. n=4. **P<0.01 vs miR-153-3p-NC group;##P<0.01 vs H2O2+miR-153-3p-NC group.图2 抑制miR-153-3p表达减轻H2O2诱导的H9C2细胞氧化损伤
3 miR-153-3p靶基因的研究
Western blot 结果显示,H2O2浓度依赖性促进H9C2细胞中Nrf2表达(P<0.01),见图3A;且ARE 活性随H2O2浓度升高而递增(P<0.01),见图3B。TargetScan 在线软件分析结果显示,Nrf2 的 3′-UTR 具有miR-153-3p 潜在的结合序列,且双萤光素酶报告基因法验证Nrf2为miR-153-3p 的靶基因之一,见图3C。Western blot 实验结果显示,与转染miR-153-3p-NC 比较,转染 miR-153-3p mimic 抑制 H9C2 细胞中Nrf2蛋白的表达,而转染miR-153-3p inhibitor则促进H9C2 细胞中 Nrf2 蛋白的表达(P<0.01),见图3D。以上结果表明miR-153-3p负调控靶基因Nrf2。
4 敲减Nrf2 表达可消除下调miR-153-3p 表达对H2O2诱导的H9C2细胞损伤的抑制作用
H2O2处理后,与转染miR-153-3p-inhibitor+si-NC的细胞比较,转染miR-153-3p-inhibitor+si-Nrf2 的细胞的活力与SOD 活性均降低,细胞凋亡率与MDA 含量均增加(P<0.01),见图4。这提示下调miR-153-3p是通过激活Nrf2 来抑制H2O2引起的H9C2 细胞氧化损伤的。
讨 论
ROS 即·O2-、H2O2和·OH-,与抗氧化系统共同维持着细胞氧化还原平衡[10]。氧化应激是机体ROS之间的动态平衡失调而引起的一系列适应性反应。氧化应激与多种心血管疾病有关,如心力衰竭、急性心肌梗死等[11]。心脏缺血再灌注损伤中大量ROS的生成是心肌细胞凋亡的主要原因[12],因此控制心肌细胞氧化损伤是心血管疾病治疗的途径之一。
有研究报道,miR-153-3p 高表达可抑制肝细胞的氧化损伤[9],然而其对心肌细胞的作用并不清楚。本研究通过H2O2处理建立心肌H9C2 细胞氧化损伤模型,发现H9C2细胞的活力随H2O2浓度升高而逐渐降低,而miR-153-3p 表达随H2O2浓度升高而增加。为了进一步研究miR-153-3p在心肌细胞氧化损伤中的作用,我们在H9C2 细胞中抑制miR-153-3p 的表达,结果显示抑制miR-153-3p表达可提高H9C2细胞在氧化应激状态下的细胞活力并降低细胞凋亡。生物体内脂质发生过氧化反应的最终产物为MDA,MDA含量可反映组织过氧化损伤程度[13]。SOD可清除机体代谢过程中产生的过量超氧阴离子自由基,在机体对抗氧化损伤中具有重要作用[14]。随后我们研究了miR-153-3p 对H9C2 细胞中MDA 含量和SOD活性的影响,结果显示抑制miR-153-3p 可显著降低H2O2处理后H9C2 细胞的MDA 含量并升高SOD水平。
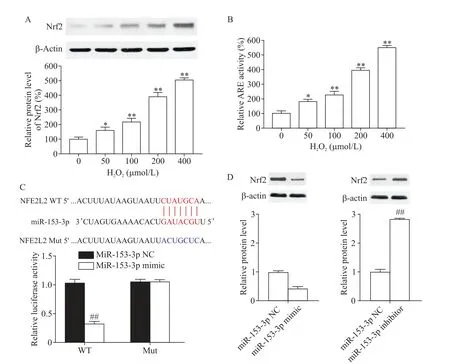
Figure 3.Target validation of miR-153-3p and Nrf2 gene.A,B:Nrf2 expression and ARE activity in the H9C2 cells after treated with H2O2;C:identification of Nrf2 as a potential target of miR-153-3p and relative luciferase activity of WT and Mut;D:the expression of Nrf2 in the H9C2 cells transfected with miR-153-3p NC,mimic or inhibitor.Mean±SD. n=3. *P<0.05,**P<0.01 vs 0 μmol/L group;##P<0.01 vs miR-153-3p NC group.图3 miR-153-3p和Nrf2基因的靶向验证
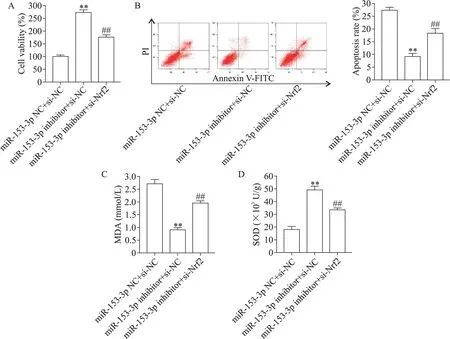
Figure 4.Nrf2 was involved in the inhibitory effect of miR-153-3p down-regulation on H2O2-induced injury of H9C2 cells.A:the cell viability;B:the apoptosis rate;C:MDA content;D:SOD activity.Mean±SD. n=3. **P<0.01 vs miR-153-3p-NC+si-NC group;##P<0.01 vs miR-153-3p-inhibitor+si-NC group.图4 敲减Nrf2可消除下调miR-153-3p表达对H2O2诱导的H9C2细胞损伤的抑制作用
Nrf2/ARE 是近些年发现的机体抵抗氧化和化学等应激的信号通路。正常情况下,细胞质中Nrf2 与Keap1 结合并处于非活性状态;当氧化应激发生时,Nrf2与Keap1解离而活化。活化的Nrf2进入细胞核,与ARE结合,启动II相解毒酶、抗氧化蛋白和蛋白酶体/分子伴侣等基因转录以抵抗氧化应激损伤[15-17]。本研究发现Nrf2 表达和ARE 活性随H2O2浓度升高而增强。本研究进一步探究Nrf2与miR-153-3p之间的关系,结果发现Nrf2是miR-153-3p的靶基因,miR-153-3p 过表达可引起Nrf2 的表达抑制,抑制miR-153-3p后Nrf2表达升高。干扰Nrf2并同时抑制miR-153-3p,可显著降低H9C2 细胞在H2O2环境下细胞活性并增强细胞凋亡,还可升高H9C2 细胞中MDA 含量和降低SOD水平。
综上所述,本研究证明抑制miR-153-3p 可上调Nrf2/ARE 通路并抑制H2O2引起的H9C2 细胞损伤。这为心脏缺血再灌注损伤提供了新的参考资料。
