内质网应激在创伤致大鼠心肌细胞凋亡中的作用*
2020-08-04于雪娇何金玲杨博文焦向英曹济民贺忠梅
于雪娇 , 何金玲 , 杨博文 , 焦向英 ,2, 曹济民 ,2, 贺忠梅 ,2, 燕 子 ,2△
(山西医科大学 1基础医学院生理学系,2细胞生理学教育部重点实验室,山西太原030001)
随着我国城市现代化建设的高速发展,交通业、建筑业等发生意外事故造成的创伤患者逐年增多。临床研究表明,创伤不仅可直接损伤心脏,还可导致继发性心脏损伤(trauma-induced secondary cardiac injury,TISCI)[1]。此类患者在创伤后 24 h 内无任何心功能指标的异常,但在创伤后数天或数周出现心功能障碍,病情隐匿,极易漏诊,死亡风险极高[2]。
已有研究证实,心肌细胞凋亡是TISCI的主要原因[3],但其具体机制尚不清楚。本课题组前期研究显示,在引起创伤大鼠心肌细胞凋亡的主要途径中,介导内质网应激(endoplasmic reticulum stress,ERS)凋亡途径的关键分子caspase-12最早被激活。应激、缺血、缺氧等多种病理因素刺激可导致内质网稳态失衡,从而引起 ERS[4]。短暂而轻微的 ERS 发生时,内质网上的跨膜传感器转录激活因子6(activating transcription factor 6,ATF6)、蛋白激酶R样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)和需肌醇酶 1α(inositol-requiring enzyme 1α,IRE1α)介导的3 条信号通路相继被激活,诱导适应性反应以维持内质网稳态,进而保护细胞。但若ERS时间延长或加剧时,ERS凋亡途径被激活,导致细胞凋亡[5],进而参与多种疾病的发生发展。本研究应用Noble-Collip 创伤仪构建机械创伤大鼠模型,通过检测ERS 及其凋亡途径的激活情况,探讨创伤致大鼠心肌细胞凋亡的潜在机制。
材 料 和 方 法
1 材料
1.1 试剂 Krebs-Henseleit(K-H)液、蛋白酶抑制剂 PMSF、RIPA 裂解液、磷酸酶抑制剂、BCA 蛋白浓度测定试剂盒和SDS-PAGE 凝胶制备试剂盒(博士德生物工程有限公司);抗GAPDH 抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG 和HRP 标记的山羊抗小鼠IgG(北京中杉金桥生物技术有限公司);抗葡萄糖调节蛋白78(glucoseregulated protein 78,GRP78)、IRE1α、p-IRE1α、C/EBP 同源蛋白(C/EBP homologous protein,CHOP)、caspase-12 和 caspase-3 抗体(Abcam);抗 PERK、p-PERK 和 cleaved caspase-3 抗体(Cell Signaling Technology);抗ATF6 抗体(Santa Cruz);4-苯基丁酸(4-phenylbutyric acid,4-PBA)购自 Sigma;caspase-3 活性检测试剂盒(南京碧波生物科技有限公司)。
1.2 动物 清洁级健康雄性SD 大鼠,6~8 周龄,体质量180~220 g,由山西医科大学实验动物中心提供[合格证号为SCXK(晋)2015-0001]。
2 方法
2.1 实验大鼠的分组及模型的构建 将大鼠随机分为伪创伤(sham)组(n=6)、创伤(trauma)组(创伤后 0 h、3 h、6 h、12 h 和24 h 各时点n=6)和创伤+ERS抑制剂4-PBA 组(n=6)。按照参考文献[6-7]的方法对大鼠进行腹腔注射麻醉,麻醉成功后置于直径30 cm的Noble-Collip 创伤仪中,创伤仪以40 r/min 的速率运行5 min,共200 r。伪创伤组大鼠被胶带固定于创伤仪内,在转动过程中不会跌落造成损伤;创伤组和创伤+4-PBA 组大鼠每转动1 圈跌落1 次,进而造成创伤;创伤+4-PBA 组大鼠在创伤后即刻腹腔注射4-PBA(100 mg/kg)。
2.2 大鼠离体心功能检测 大鼠麻醉后,迅速开胸取心脏,放入预冷的K-H 液中,迅速修剪后将主动脉固定到Langendorff 灌流装置上,以K-H 液行主动脉逆行灌流,保证恒压100 cmH2O,恒温37℃,并充以95%氧气和5%二氧化碳混合气体。待心脏稳定跳动后,将带球囊的心导管经过房室瓣置于左心室内,球囊内充有灌流液,使左心室舒张末压维持在10 mmHg。球囊导管另一端与压力换能器相连,待各项心功能指标稳定后对左室内压进行采集。采用BL-410生物信号记录分析系统记录大鼠±dp/dtmax数据。
2.3 大鼠心肌组织样品的制备 伪创伤组大鼠经创伤仪运转5 min 后处死;创伤组大鼠按照创伤后不同时点依次处死;创伤+4-PBA 组大鼠在ERS 标志物表达最高的时点即创伤后6 h处死。处死大鼠后,开胸,取心脏,于4℃磷酸盐缓冲液中洗去残余血液,冰上取心尖组织,剪碎,裂解,提取蛋白用于后续实验。
2.4 Western blot 制胶,上样,电泳,转膜,封闭,孵育I抗(GRP78抗体按1∶2 500稀释,PERK、p-PERK、IRE1α、p-IRE1α 和 caspase-12 抗体按 1∶1 000 稀释,ATF6、CHOP 和caspase-3 抗体按1∶500 稀释),4℃过夜;用洗涤缓冲液洗膜3 次,每次10 min,孵育II 抗2 h(HRP标记的山羊抗兔IgG和HRP标记的山羊抗小鼠 IgG 按1∶2 000 稀释);洗膜,用UVP 凝胶成像系统曝光。以目的蛋白灰度值与内参照GAPDH 灰度值的比值反映蛋白表达水平。
2.5 caspase-3 活性检测 取各组心肌组织,裂解,测定蛋白浓度,根据分组在96 孔酶标板上设置空白对照孔和样品孔;按照说明书依次加入样品裂解液、反应缓冲液和底物。催化底物Ac-DEVD-pNA(acetyl-Asp-Glu-Val-Aspp-nitroanilide)被 caspase-3 剪切后,会产生黄色的pNA,用酶标仪测定的吸光度(A)可反映caspase-3的活性。
3 统计学处理
用GraphPad Prism 7.0 软件统计并作图。实验数据以均数±标准差(mean±SD)表示。组间均数比较用单因素方差分析及LSD-t检验。以P<0.05 为差异有统计学意义。
结 果
1 创伤导致大鼠离体心功能降低,心肌组织凋亡执行蛋白caspase-3活性增强
与伪创伤组相比,创伤组大鼠24 h 内各时点(0、3、6、12 和 24 h)心电图、平均动脉压及在体心功能(包括±dp/dtmax)均未出现显著异常,心脏、肝脏、肾脏和肠管均未出现显著出血,仅观察到肝脏和肠管轻度充血,且创伤大鼠通常在创伤后1~3 h 苏醒,24 h内生存率100%。但离体心功能指标±dp/dtmax均在创伤后24 h显著降低(P<0.05或P<0.01),见表1。

表1 创伤24 h内大鼠离体心功能指标±dp/dtmax的变化Table 1.Changes of ex vivo cardiac function indexes±dp/dtmax in rats within 24 h of trauma(mmHg/s.Mean±SD. n=6)
与伪创伤组相比,创伤组大鼠心肌组织中凋亡执行蛋白caspase-3 活性形式(cleaved caspase-3)在创伤后6 h 显著增加(P<0.05),12 h 达到最高峰(P<0.01),见图1A;caspase-3 活性检测试剂盒的结果同样显示,caspase-3 活性在创伤后6 h 显著升高(P<0.01),12 h达到最高水平(P<0.01),见图1B。

Figure 1.The expression and activity of apoptotic execution protein caspase-3 in rat myocardial tissues at different time points after trauma.A:the protein levels of caspase-3 and cleaved caspase-3 detected by Western blot;B:activity of caspase-3 determined by commercially available kit.Mean±SD. n=6.*P<0.05,**P<0.01 vs sham group.图1 创伤后不同时点凋亡执行蛋白caspase-3在大鼠心肌组织中的表达和活性
2 创伤诱导大鼠心肌组织ERS 标志分子GRP78、ATF6、p-PERK和p-IRE1α水平升高
与伪创伤组相比,创伤组大鼠心肌组织GRP78蛋白表达在创伤后3 h开始显著增加(P<0.05),在创伤后6 h 达到最高水平(P<0.01),见图2A;ATF6 蛋白表达在创伤后6 h 开始增加(P<0.05),12 h 达到最高水平(P<0.01),见图2B;PERK和IRE1α表达在创伤后无显著变化(P>0.05),但磷酸化水平在创伤后3 h 显著升高(P<0.05),6 h 达到最高(P<0.01),见图2C、D。
3 创伤导致大鼠心肌组织ERS 相关凋亡蛋白CHOP表达升高及caspase-12活化
与伪创伤组相比,创伤组大鼠心肌组织CHOP表达在创伤后6 h 显著增加(P<0.05),12 h 达到最高水平(P<0.01),见图3A;caspase-12 活性形式(cleaved caspase-12)在创伤后 3 h 水平升高(P<0.05),6 h达到高峰(P<0.01),见图3B。
4 抑制ERS 可降低创伤大鼠心肌组织CHOP 表达并抑制caspase-12活化
与创伤组相比,给予ERS 抑制剂4-PBA 后,创伤大鼠心肌组织CHOP 和cleaved caspase-12 蛋白水平显著降低(P<0.05),见图4。

Figure 2.The expression and phosphorylation levels of ERS marker molecules GRP78,ATF6,PERK and IRE1α in rat myocardial tissues at different time points after trauma.A:GRP78 protein expression level;B:ATF6 protein expression level;C:PERK protein expression and phosphorylation levels;D:IRE1α protein expression and phosphorylation levels.Mean±SD.n=6.*P<0.05,**P<0.01 vs sham group.图2 创伤后不同时点ERS标志分子GRP78、ATF6、PERK和IRE1α在大鼠心肌组织中的表达和磷酸化水平
5 抑制ERS可减少创伤大鼠心肌组织caspase-3活化
与创伤组相比,给予4-PBA 干预后创伤大鼠心肌组织中cleaved caspase-3 蛋白水平显著降低(P<0.05),见图5A;采用caspase-3 活性检测试剂盒对心肌组织caspase-3 活性进行测定,结果同样显示,4-PBA 干预后创伤大鼠心肌组织caspase-3活性显著下调(P<0.05),见图5B。
讨 论
TISCI 是一种隐匿性疾病,常因贻误治疗时机导致患者死亡[8],而其具体发病机制尚不清楚。已有的研究表明,在创伤动物模型中,创伤可导致心肌细胞凋亡,进而引起心功能降低及随后的继发性心脏损伤[6,9]。引起细胞凋亡通常有 3 条途径:死亡受体途径、线粒体途径和ERS 途径[10]。在前期研究中,本课题组对介导3 条凋亡途径的标志性蛋白caspase-8、caspase-9和caspase-12分别进行了活性检测,显示介导 ERS 凋亡途径的 caspase-12 最早被激活[7]。为了探讨创伤是否通过激活ERS 进而导致大鼠心肌细胞凋亡,本研究首先根据参考文献[6]和课题组既往研究成功复制造成继发性心脏损伤的创伤大鼠模型[7,11-12],并对创伤大鼠心肌组织凋亡的发生进行验证,结果显示凋亡执行蛋白caspase-3被活化,证实创伤可诱导心肌细胞凋亡。
为了观察创伤后ERS 的发生情况,我们对ERS标志分子进行检测。GRP78 是内质网分子伴侣蛋白,通常以其表达增高作为 ERS 发生的标志[13];而ATF6、IRE1α 和 PERK 是内质网膜蛋白,是 ERS 的传感器,过度 ERS 时,GRP78 与 ATF6、IRE1α 和 PERK解离,进而激活这3 个传感器[14]。本研究结果表明,创伤导致 GRP78 的解离及 ATF6、IRE1α 和 PERK 的激活,引起ERS 的发生。为了进一步探讨创伤是否激活ERS凋亡途径,我们对ERS凋亡相关蛋白CHOP及caspase-12 进行检测。CHOP 由内质网膜蛋白PERK 和 ATF6 共同激发[15-16];caspase-12 的活化是由内质网膜蛋白IRE1α 磷酸化触发的[14]。本研究结果显示,CHOP 及caspase-12在创伤后表达水平显著上调,推测创伤引起的大鼠心肌细胞凋亡可能与ERS凋亡途径的激活有关。
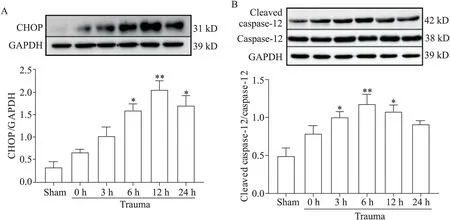
Figure 3.The expression and activation levels of ERS-related apoptosis proteins CHOP and caspase-12 in rat myocardial tissues at different time points after trauma.A:CHOP protein expression level;B:caspase-12 and cleaved caspase-12 protein levels.Mean±SD. n=6.*P<0.05,**P<0.01 vs sham group.图3 创伤后不同时点ERS相关凋亡蛋白CHOP和caspase-12在大鼠心肌组织中的表达和活性水平

Figure 4.The effects of ERS inhibitor 4-PBA treatment on the expression and activation of ERS-related apoptosis proteins CHOP and caspase-12 in traumatic rats.A:CHOP protein expression level;B:caspase-12 and cleaved caspase-12 protein levels.Mean±SD. n=6.*P<0.05 vs sham group;#P<0.05 vs trauma group.图4 ERS抑制剂4-PBA处理对ERS相关凋亡蛋白CHOP表达和caspase-12活化的影响

Figure 5.The effects of ERS inhibitor 4-PBA treatment on the activation of caspase-3 in traumatic rats.A:caspase-3 and cleaved caspase-3 protein levels detected by Western blot;B:activity of caspase-3 determined by commercially available kit.Mean±SD. n=6.*P<0.05 vs sham group;#P<0.05 vs trauma group.图5 ERS抑制剂4-PBA处理对创伤大鼠心肌组织caspase-3活化的影响
为了进一步明确ERS 凋亡途径的激活对创伤致大鼠心肌细胞凋亡的作用,我们给予创伤大鼠ERS抑制剂 4-PBA 处理[17],结果显示,抑制 ERS 可降低ERS 相关凋亡蛋白 CHOP 和 caspase-12 的表达,阻断ERS 凋亡途径;也可下调凋亡执行蛋白caspase-3 的活性。以上结果证实创伤引起的大鼠心肌细胞凋亡是ERS凋亡途径激活所致。
综上所述,本研究显示创伤早期可诱发大鼠心肌组织ERS的产生,进而激活ERS凋亡通路,最终导致细胞凋亡。这为TISCI 的发病机制提供了新的实验依据。
