IGF-1R-Stat3信号通路通过激活中期因子表达促进肝癌细胞活力、迁移和侵袭*
2020-08-04陈埏芳冯淑芬李观宏汤绍辉
陈埏芳, 冯淑芬, 施 颖, 钟 绿, 李观宏, 汤绍辉
(暨南大学附属第一医院消化科,广东广州510630)
肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌中最常见的病理类型,是世界上第五大常见恶性肿瘤,也是肿瘤死亡的第三大原因[1]。虽然近年来HCC 的诊疗水平有所提高,但我国HCC 患者的5年生存率仅约12%[2]。复发和转移是导致HCC患者死亡的两大主因。因此,研究HCC 发生和转移的分子机制,对HCC的个体化精准治疗极其重要。
胰岛素样生长因子1 受体(insulin-like growth factor-1 receptor,IGF-1R)是一种广泛表达于多种类型细胞表面的酪氨酸激酶跨膜蛋白,主要介导IGF-1和IGF-2 的生物学作用,参与机体物质代谢调节、细胞增殖分化及胚胎发育等生物学过程[3-4]。近年研究表明,IGF-1R 在多种恶性肿瘤(包括HCC)中表达水平显著增高,IGF-1R过表达促进肝癌细胞生长、侵袭与转移,抑制IGF-1R 表达可能成为HCC 治疗的新靶点[5-7]。但是,目前有关IGF-1R调控HCC生长与侵袭转移的机制尚未完全明确。
IGF-1R 致癌的分子机制涉及Janus 激酶(Janus kinase,JAK)/信号转导及转录激活蛋白(signal transducers and activators of transcription,Stat)信号通路的异常活化[8-11]。Stat3 蛋白属于 Stat 家族成员,研究显示Stat3 的激活可以促进HCC 发生和肿瘤血管形成,与HCC 的进展和预后密切相关[12]。但是目前对IGF-1R-Stat3 通路的研究尚不够深入,活化状态的Stat3调节下游靶基因的中间环节并不明确[8-11]。
我们前期研究显示,IGF-1R 通过正向调控中期因子(midkine)表达促进HCC 生长与侵袭,而抑制midkine 表达则可以逆转IGF-1R 对HCC 生长及侵袭的促进作用[7]。但是,IGF-1R 调控 midkine 表达的机制目前国内外尚缺乏系统深入研究。因此,我们对肝癌细胞中IGF-1R-Stat3信号通路与midkine表达调控的关系进行了初步探讨,以期为HCC 分子靶向治疗提供参考资料。
材 料 和 方 法
1 材料
1.1 临床标本收集 32例HCC 组织标本(男25例,女 7 例,平均年龄 52.6 岁)、32 例配对癌旁肝组织(matched adjacent nontumorous tissues,MANT)标本(术中切除距离肝癌病灶≥2 cm)和13 例正常成人肝组织(normal adult liver tissues,NALT)标本(男10例,女3例,11例为外伤性肝破裂患者,2例为肝血管瘤患者)于 2006 年 1 月至 2017 年12 月收集于暨南大学附属第一医院。所有患者的诊断均通过病理证实。组织标本离体后立即放入液氮中速冻后转入超低温冰箱存放。本研究由暨南大学附属第一医院医学伦理委员会批准。
1.2 细胞株 肝癌细胞株(Huh7 和Hep3B)和正常肝细胞株(HL-7702)购于ATCC。稳定敲减IGF-1R表达的Huh7 细胞株及midkine 表达载体已由本课题组前期构建并保存[7]。
1.3 主要试剂 小量质粒抽提试剂盒购于北京全式金生物公司;Lipofectamine™2000 转染试剂购于Invitrogen;抗Stat3、磷酸化Stat3(phosphorylated Stat3,p-Stat3)和GAPDH 兔单克隆抗体及抗兔IgG(H+L)生物素化抗体购于Cell Signaling Technology;抗midkine 兔单克隆[EP1143Y]抗体购于Abcam;MTT 检测试剂盒购于Abcam;Transwell 细胞培养板购于BD。
2 方法
2.1 RT-qPCR 实验 采用TRIzol 试剂盒制备各细胞株及肝组织标本总RNA,验证总RNA 抽提完整后,逆转录合成cDNA 并进行实时荧光定量PCR 分析。采用相对定量法(2-ΔΔCt)表示目的基因表达量。以18S rRNA 作为内参照。引物由苏州金唯智公司合成。IGF-1R 的上游引物序列为5'-GGTGTC-CAATAACTACATTG-3',下游引物序列为5'-CAGCGGTTTGTGGTCCAGC-3';Stat3 的上游引物序列为5'-CATCTTGAGCACTAAGCCT-3',下游引物序列为5'-GAGATAGACCAGTGGAGACA-3';midkine的上游引物序列为5'-CTGGGGTGCGTGTGATGGGG-3',下游引物序列为5'-CTTTGGTCTTGGGGGTGCAG-3';18S rRNA 的上游引物序列为5'-CCTGGATACCGCAGCTAGGA-3',下游引物序列为5'-GCGGCGCAATACGAATGCCCC-3'。
2.2 Western blot 检测 Stat3、p-Stat3 和 midkine 的蛋白水平 用RIPA 裂解液提取细胞总蛋白,4℃离心,收集上清,采用BCA法测定蛋白浓度,将待测样品上样后进行电泳。电泳至PVDF膜后封闭,加入Ⅰ抗和Ⅱ抗。ECL 显色试剂盒进行显色,用凝胶成像仪进行拍照,以GAPDH为内参照,分析蛋白表达水平。
2.3 筛选针对Stat3的siRNA(siStat3) 通过查询GenBank 中人 Stat3 mRNA 序列(NM_139276.2),根据 siRNA 设计原则,设计 3 对 siRNA(Stat3_001、Stat3_002 和Stat3_003)及1 对无任何靶基因的阴性对照siRNA(negative control siRNA,NC siRNA),并委托苏州金唯智公司合成,序列见表1。培养Huh7细胞至汇合度为30%~50%,采用Lipofectamine ™2000转染试剂转染siRNA。实验分为4组,即阴性对照组(NC siRNA)和3 个实验组(Stat3_001、Stat3_002和Stat3_003),每组设置3 个siRNA 浓度梯度(25、50和 100 nmol/L)。转染 24 h 后,按 TRIzol 试剂盒说明抽提Huh7 细胞总RNA,逆转录合成cDNA 并进行定量 PCR 扩增,测定 Stat3 的 mRNA 表达量,引物序列同前。每个样本同时扩增3个复管,并连续进行3次实验。采用2-ΔΔCt表示目的基因表达量。

表1 Stat3 siRNA候选序列Table 1.Candidate sequences of Stat3 siRNA
2.4 IGF-1R 和Stat3 过表达载体的构建 提取Hun7细胞总RNA进行反转录。以反转录产物cDNA为模板,PCR 扩增。PCR 条件为:94℃ 5 min;98℃30 s,58℃ 30 s,68℃ 20 s,30 个循环;68℃下延伸5 min;16℃保存。引物由苏州金唯智公司合成。IGF-1R 的上游引物序列为5'-ccggaattcgccaccATGAAGTCTGGCTCCGGAGGAG-3',下游引物序列为5'-ctagtctagaTCAGCAGGTCGAAGACTGGGG-3';Stat3的上游引物序列为5'-GATCCGCTTCAGACCCGTCAACAAACTCGAGTTTGTTGACGGGTCTGAAGTTTTTTG-3',下游引物序列为5'-AATTCAAAAAACTTCAGACCCGTCAACAAACTCGAGTTTGTTGACGGGTCTGAAGCG-3'。在上、下游分别引入EcoRI 与XbaI 的酶切位点及保护性碱基。用EcoRI 和XbaI 双酶切质粒载体pcDNA3.1和PCR扩增得到的目的基因,分别收集目的片段后使用T4 连接酶进行连接,构建重组质粒,并进行酶切鉴定和送至苏州金唯智基因公司进行测序鉴定。
2.5 MTT 法检测细胞活力 实验分为5 组:空白对照(blank control,Bla)组(未转染的Huh7细胞)、IGF-1R 组(瞬时转染IGF-1R 过表达质粒的Huh7 细胞)、siStat3+midkine 组(瞬时共转染 siStat3 及 midkine 过表达质粒的Huh7细胞)、shIGF-1R 组(稳定敲减IGF-1R表达的Huh7 细胞)和shIGF-1R+Stat3 组(稳定敲减IGF-1R表达的Huh7 细胞瞬时转染Stat3 过表达质粒)。取上述5 组细胞,调整密度为1×108/L,接种至96 孔板,每孔加入 100 μL DMEM 培养液,于 37℃、5%CO2培养箱中培养细胞,待贴壁后收集各时点(0、24、48和72 h)细胞,加入MTT,孵育4 h后,用酶标仪在波长570 nm处读取吸光度。
2.6 Transwell 实验检测细胞迁移及侵袭能力 在细胞迁移实验中,取上述5 组细胞,计数1×105个细胞,取100 μL 细胞悬液接种于Transwell 小室的上室,下室中加入600 μL 完全培养液,在37℃、5%CO2培养箱孵育12~48 h。取出Transwell 小室,弃培养液,用棉签擦去上室内的细胞,4%多聚甲醛固定20 min,PBS 洗涤 1 次,用结晶紫染色 10 min,再用 PBS洗涤1 次,显微镜下观察5 个高倍视野计数,拍照统计结果。检测细胞侵袭能力时,取Matrigel 加入Transwell 小室中,37℃孵育 2 h 使Matrigel 凝固,余下步骤同迁移实验。
3 统计学处理
用SPSS 23.0 软件进行统计分析,用GraghPad Prism 7 软件作图。每次实验重复3 次,记录平均值。计量资料用均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析及LSD-t检验,两变量相关性评估采用Pearson 积矩相关分析。以P<0.05 为差异有统计学意义。
结 果
1 HCC 细胞株及组织中 IGF-1R、Stat3 和 midkine mRNA表达水平上调
RT-qPCR 结果显示,Huh7 和 Hep3B 细胞中 IGF-1R、Stat3 和 midkine 的 mRNA 表达水平均显著高于HL-7702 细胞(P<0.01),见图1A;HCC 组织中IGF-1R、Stat3 和 midkine 的 mRNA 表达水平均显著高于MANT 及 NALT(P<0.01),MANT 中 IGF-1R mRNA表达水平也显著高于NALT(P<0.05),见图1B。线性相关分析结果进一步显示,HCC 组织中Stat3 和midkine mRNA 表达水平均与IGF-1R mRNA 表达水平呈正相关(r=0.716 和r=0.681,P<0.01),midkine mRNA 表达水平与Stat3 mRNA 表达也呈正相关(r=0.657,P<0.01),见图1C。
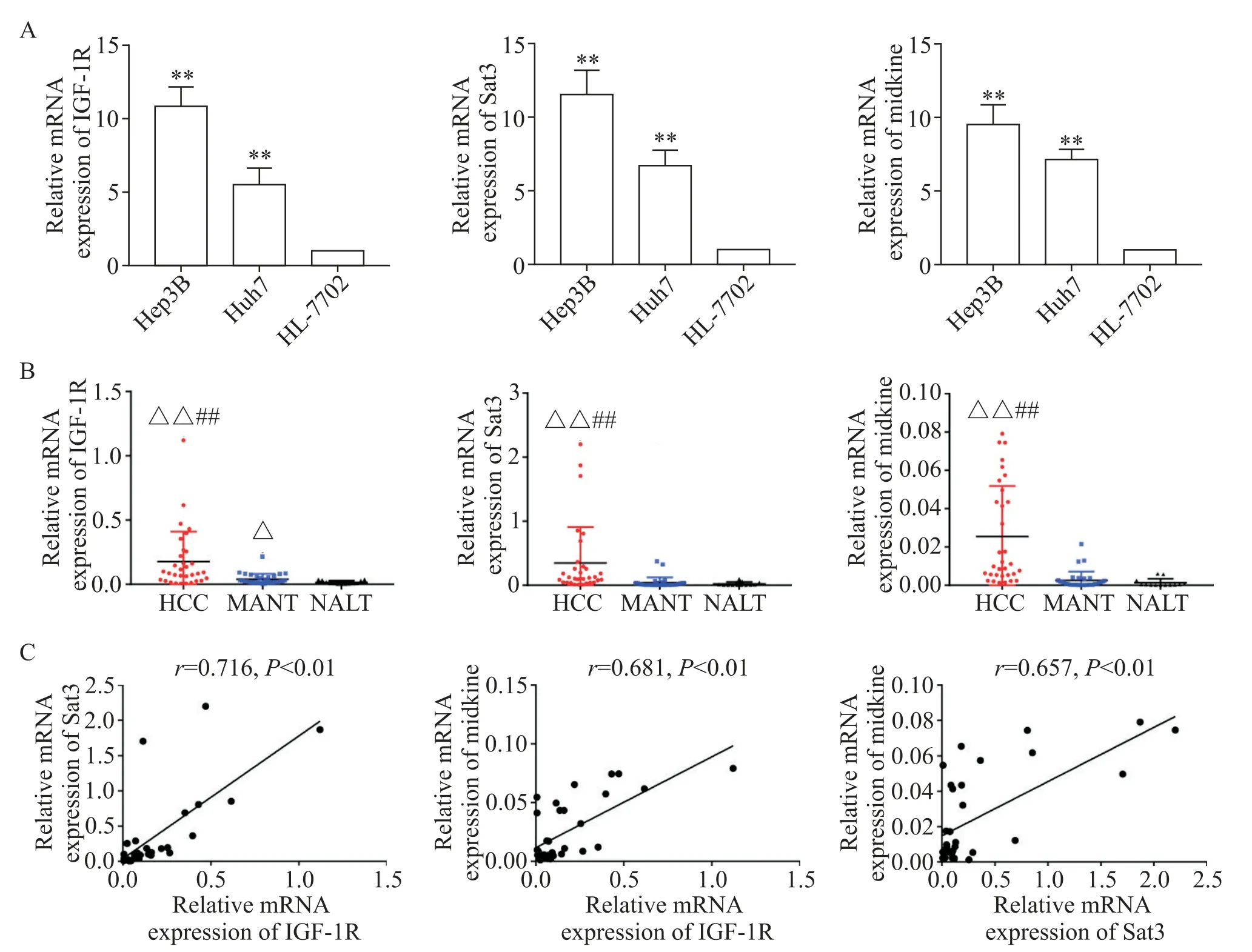
Figure 1.The mRNA expression of IGF-1R,Stat3 and midkine was up-regulated in HCC cell lines and tissues.A:the mRNA expression of IGF-1R,Stat3 and midkine in HCC cell lines(Huh7 and Hep3B)and normal liver cell line(HL-7702)was detected by RT-qPCR(n=3);B:the mRNA expression of IGF-1R,Stat3 and midkine in human HCC tissues(n=32),matched adjacent nontumorous tissues(MANT,n=32)and normal adult liver tissues(NALT,n=13)was detected by RT-qPCR;C:linear correlation analyses among IGF-1R,Stat3 and midkine mRNA expression levels in HCC tissues(n=32).Mean±SD.**P<0.01 vs HL-7702 group;△P<0.05,△△P<0.01 vs NALT group;##P<0.01 vs MANT group.图1 IGF-1R、Stat3和midkine在HCC细胞株和组织中的mRNA表达水平上调
2 siStat3的筛选结果
siStat3 转染 Huh7 细胞后,RT-qPCR 检测转染效果,结果显示,转染 Stat3_001、Stat3_002 及Stat3_003的Huh7 细胞中Stat3 mRNA 表达量均有不同程度的降低,抑制效率约为37%~80%,其中Stat3_003 浓度在100 nmol/L 时抑制效率最高,达80%,见表2。因此采用此siRNA用于后续研究。
3 IGF-1R 通过上调Huh7 细胞Stat3 表达并增加其磷酸化水平而促进midkine表达
RT-qPCR 结果显示,与空白对照组相比,瞬时上调 IGF-1R 表达,Stat3 和 midkine 的 mRNA 表达水平显著上调(P<0.01),见图2A;Western blot 结果显示,瞬时上调 IGF-1R 表达后 Stat3、p-Stat3 及 midkine的蛋白水平也显著上调,见图2B。

表2 针对Stat3的siRNA筛选结果Table 2.Results of siRNA screening for Stat3
稳定敲减IGF-1R表达则可显著降低Stat3 和midkine 的mRNA 表达水平(P<0.01)及Stat3、p-Stat3和midkine的蛋白水平,见图2A、B。
在稳定敲减IGF-1R表达的Huh7细胞中,瞬时上调Stat3 表达逆转了敲减IGF-1R表达所致的midkine mRNA及蛋白表达水平降低(P<0.01),见图2A、B。
在Huh7细胞中瞬时敲减Stat3表达,可下调midkine mRNA 及蛋白表达(P<0.01),瞬时上调Stat3 表达则可上调midkine mRNA 及蛋白表达(P<0.01),见图2C、D。
4 IGF-1R 通过激活 Stat3、上调 midkine 表达而增强Huh7细胞活力,促进其迁移和侵袭
MTT 法及 Transwell 实验结果显示,在 Huh7 细胞中瞬时上调IGF-1R 表达可显著增强其活力、迁移能力和侵袭能力(P<0.01);瞬时敲减Stat3表达并同时瞬时上调midkine 表达则其活力、迁移能力和侵袭能力无明显变化(P>0.05);而稳定敲减IGF-1R表达则显著抑制Huh7 细胞活力、迁移能力和侵袭能力(P<0.01);在稳定敲减IGF-1R表达的 Huh7 细胞中瞬时上调Stat3 表达可逆转敲减IGF-1R表达所致的细胞活力、迁移能力和侵袭能力的抑制(P<0.01),见图3、4。
讨 论
IGF-1R 是IGF 家族中的一个重要成员。大量研究表明,IGF-1R 在多种恶性肿瘤包括HCC 中的表达水平显著上调,其致癌机制涉及多条信号通路活化,其中IGF-1R-Stat3 信号通路激活在HCC 发生中具有重要作用,但Stat3 信号的下游靶分子尚未完全明确[8-11]。
Stat3 是Stat 转录因子家族的一员,参与调控细胞增殖、分化、凋亡、血管生成、免疫反应、肿瘤发生和转移等病理生理过程[8,10,13-14],而且对于细胞恶性转化的建立和维持至关重要[8,13]。此外,midkine 是一种肝素结合生长因子[15],在胚胎发育过程中呈现高水平表达,但在正常成人组织表达水平极低[16-17]。最近研究表明,midkine 参与人类多种肿瘤(包括HCC)的发生发展[18-21]。
在本研究中,我们检测到IGF-1R、Stat3 和midkine 在 HCC 细胞株(Huh7 和 Hep3B)和 32 例人 HCC组织中的mRNA 表达水平显著升高;线性相关分析显示HCC 组织中Stat3 和midkine mRNA 的表达水平均与IGF-1R mRNA 表达水平呈正相关,midkine mRNA 表达水平也与Stat3 mRNA 表达水平呈正相关。这些结果表明,IGF-1R-Stat3 信号通路和midkine 表达在HCC 中被激活,且前者可能正向调控后者表达。与本研究结果相似,多项研究报道IGF-1R[5-7,22]、Stat3[23-24]及 midkine[25-26]在 HCC 中的表达水平显著上调。
为进一步明确IGF-1R-Stat3 信号通路与midkine表达之间的联系,我们在Huh7 肝癌细胞中进行了过表达或敲减IGF-1R和Stat3的体外细胞实验。结果显示,在 Huh 细胞中,IGF-1R 正向调控 Stat3 和 midkine 的 mRNA 表达水平及 Stat3、p-Stat3 和 midkine 的蛋白表达水平;在稳定敲减IGF-1R表达的Huh7细胞中,瞬时上调Stat3 表达逆转了敲减IGF-1R表达所致的midkine mRNA 及蛋白表达水平降低;在Huh7 细胞中瞬时上调或下调Stat3表达,则midkine 的mRNA和蛋白表达水平也出现了同向变化。上述结果表明,在 HCC 细胞中,IGF-1R 通过上调 Stat3 表达并增加其磷酸化水平促进midkine表达;结合前述HCC组织中IGF-1R、Stat3 和midkine 表达的线性相关分析结果,表明IGF-1R-Stat3 信号通路正向调控midkine表达。
为了探讨IGF-1R-Stat3信号通路影响midkine 表达对HCC细胞生物学行为的影响,我们在Huh7细胞中过表达或敲减IGF-1R和Stat3及上调midkine 表达后观察细胞活力、迁移能力和侵袭能力的变化。结果显示,在Huh7 细胞中瞬时上调IGF-1R 表达可显著增强其活力、迁移能力和侵袭能力;瞬时敲减Stat3表达并同时瞬时上调midkine 表达则其活力、迁移能力和侵袭能力无明显变化;而稳定敲减IGF-1R表达则显著抑制Huh-7 细胞活力、迁移能力和侵袭能力;在稳定敲减IGF-1R表达的Huh7 细胞中,瞬时上调Stat3 表达可逆转敲减IGF-1R表达所致的细胞活力、迁移能力和侵袭能力的抑制。

Figure 2.Effect of IGF-1R on the expression of Stat3 and midkine(A,B),and effect of Stat3 on midkine expression(C,D)in Huh7 cells.The mRNA expression of Stat3 and midkine was detected by RT-qPCR(A,C),and the protein levels of Stat3,p-Stat3 and midkine were detected by Western blot(B,D).Bla:blank control;shIGF-1R:stable knockdown of IGF-1R;IGF-1R:transient over-expression of IGF-1R;Stat3:transient over-expression of Stat3;siStat3:transient knock-down of Stat3.Mean±SD. n=3.**P<0.01 vs Bla group;##P<0.01 vs shIGF-1R group.图2 IGF-1R对Huh7细胞Stat3和midkine表达水平及Stat3对Huh7细胞midkine表达水平的影响

Figure 3.Effect of IGF-1R-Stat3 signaling pathway and midkine expression changes on Huh7 cell viability.Bla:blank control;IGF-1R:transient over-expression of IGF-1R;siStat3+midkine:transient knock-down of Stat3 and transient over-expression of midkine;shIGF-1R:stable knockdown of IGF-1R;shIGF-1R+Stat3:stable knockdown of IGF-1R and transient over-expression of Stat3.Mean±SD. n=3.**P<0.01 vs Bla group;##P<0.01 vs shIGF-1R group.图3 IGF-1R-Stat3信号通路及midkine表达改变对Huh7细胞活力的影响

Figure 4.Effect of IGF-1R-Stat3 signaling pathway and midkine expression changes on Huh7 cell migration(A)and invasion(B).Scale bar=50 μm.Bla:blank control;IGF-1R:transient over-expression of IGF-1R;siStat3+midkine:transient knockdown of Stat3 and transient over-expression of midkine;shIGF-1R:stable knockdown of IGF-1R;shIGF-1R+Stat3:stable knockdown of IGF-1R and transient over-expression of Stat3.Mean±SD. n=3.**P<0.01 vs Bla group;#P<0.05 vs shIGF-1R group.图4 IGF-1R-Stat3通路及midkine表达改变对Huh7细胞迁移和侵袭的影响
综上所述,本研究结果提示,IGF-1R-Stat3 信号通路通过激活midkine表达增强HCC细胞活力,促进其迁移和侵袭,而抑制该通路激活则显著降低HCC细胞的活力、迁移能力和侵袭能力。
