炎症性肠病患儿维持治疗期延迟使用英夫利昔单抗3周未改变疾病活动指数
2020-08-04罗优优耿岚岚龚四堂游洁玉房永利李中跃王朝霞许春娣莹0钟雪梅李小芹陈競芳李在玲徐樨巍郭红梅商丽红谢晓丽
周 颖 黄 瑛 罗优优 陈 洁 耿岚岚 龚四堂 游洁玉 房永利 张 晶 李中跃 王朝霞 吴 捷 肖 园 许春娣 方 莹0 钟雪梅 李小芹 陈競芳 李在玲 徐樨巍 郭红梅 金 玉 商丽红 谢晓丽 梅 红 朱 莉
炎症性肠病(IBD)主要包括克罗恩病(CD)、溃疡性结肠炎(UC)和未定型IBD(IBDU),是发生在胃肠道原因不明的慢性非特异性炎症性疾病。IBD的传统治疗药物包括5-氨基水杨酸、糖皮质激素和免疫调节剂,但部分患者治疗无效。英夫利昔单抗(IFX)和阿达木单抗(ADA)是目前仅有的被美国FDA批准用于儿童IBD治疗的生物制剂,在国内获批在临床应用的生物制剂仅有IFX。
IFX按每次5 mg·kg-1,在第0、2、6周静脉注射作为诱导治疗方案;然后按同样剂量每隔8周用药1次作为维持治疗方案。IFX需在医院静脉注射治疗,本文旨在探讨新型冠状病毒(SARS-CoV-2)感染流行期间导致IBD患儿延迟或暂停使用IFX,是否会对IBD患儿产生影响。
1 方法
1.1 研究设计 多中心横断面调查。在特定时间段内,对国内具有收治IBD患儿的医院,采用问卷调查方法采集IBD患儿在诱导和维持治疗阶段延迟和暂停使用IFX后,疾病活动指数变化及其影响因素。
1.2 相关定义 目前国际上尚无暂停和延迟使用IFX的确切定义。本文定义如下:①诱导阶段和维持阶段延迟:1次未按时使用IFX,在应当第2次使用IFX前使用了IFX;②诱导阶段和维持阶段暂停:连续2次未按时使用IFX。
1.3 调查问卷项目 使用IFX的IBD患儿,年龄,性别,疾病类型(CD/UC/IBDU),已用生物制剂次数,诱导阶段或维持阶段延迟生物制剂使用时间,是否加用其他治疗(激素、反应停、肠内营养、硫唑嘌呤或其他),延迟或暂停治疗后疾病分期是否加重,是否导致住院、手术或死亡。使用IFX的IBD患儿2020年1月20日前(疫情前)最后1次和2020年1月20日至2020年3月20日(疫情中)第1次血WBC、Hb、PLT、CRP和PCDAI/PUCAI评分值。需要说明的是,儿童CD疾病活动指数(PCDAI)和儿童UC疾病活动指数(PUCAI)是由各自中心根据临床症状、体征和实验室检查结果进行评分。
1.4 纳入和排除标准 纳入因为SARS-CoV-2疫情担心交叉感染或来院不方便导致延迟或暂停使用IFX的IBD患儿。排除对IFX继发性过敏、继发性失应答、合并严重感染或败血症(如活动性结核、侵袭性真菌感染)而停止使用IFX的患儿。
1.5 分组 IBD患儿疫情中较疫情前 PCDAI和PUCAI评分疾病分期加重为病例组,疾病分期未加重为对照组。
1.6 观察指标 PCDAI:<10为缓解期,~27.5为轻度活动期,~37.5为中度活动期,~100.0为重度活动期[1]。PUCAI:<10为缓解期,~34为轻度活动期,~64为中度活动期,≥65为重度活动期[2]。疾病分期加重是指,根据疾病活动指数,疾病分期由缓解期进展轻、中或重度活动期,轻度活动期进展为中或重度活动期,中度活动期进展为重度活动期。
1.7 统计学分析 采用SPSS 20.0进行统计学分析。正态分布的计量资料用xˉ±s表示,组间比较采用t检验;非正态分布的计量资料用中位数表示,组间比较采用Mann-Whitney检验;计数资料用频率和百分比表示,组间比较采用卡方检验。多因素分析采用二元Logistic回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 向国内19家医院发放了问卷调查,均得到了回复,每家医院均保证了疫情中应该使用IFX的IBD连续病例被纳入,共232例,无对IFX继发性过敏、继发性失应答和合并感染而停止使用IFX病例。165例按时使用IFX,67例(28.9%)因疫情因素未按时使用IFX。符合暂停使用标准2例,2例均未取得疫情中随访数据;符合延迟使用标准65例,其中9例未取得疫情中随访数据。失访率为16.4%(11/67)。56例延迟使用IFX并采集到疫情前中数据的IBD患儿进入本文分析。男27例,女29例,平均年龄(11.3±4.1)岁。病例组11例(诱导阶段3例,维持阶段8例),对照组45例(诱导阶段2例,维持阶段43例)。
19家医院疫情期间按时/未按时使用IFX的IBD患儿,复旦大学附属儿科医院(我院)24例/7例,均为延迟;浙江大学医学院附属儿童医院23例/5例,均为延迟;广州市妇女儿童医疗中心20例/2例,均为延迟;湖南省儿童医院13例/7例,均为延迟;首都医科大学附属北京儿童医院12例/7例,1例暂停,6例延迟;重庆医科大学附属儿童医院10例/5例,均为延迟;深圳市儿童医院10例/4例,均为延迟;中国医科大学附属盛京医院14例/0例;上海交通大学医学院附属瑞金医院10例/3例,均为延迟;西安交通大学附属儿童医院7例/3例,均为延迟;首都儿科研究所5例/4例,均为延迟;河南省儿童医院3例/3例,1例暂停,2例延迟;复旦大学附属儿科医院厦门分院厦门市儿童医院4例/1例,延迟;北京大学第三医院3例/2例,均为延迟;北京京都儿童医院2例/2例,均为延迟;南京医科大学附属儿童医院3例/1例,延迟;成都市妇女儿童中心医院1例/1例,延迟;华中科技大学同济医学院附属武汉儿童医院0例/1例,延迟;贵州省妇幼保健院1例/0例。
2.2 按时和延迟使用IFX疫情前基线比较 19家医院按时/延迟使用IFX的IBD患儿比例为2.9∶1(165/56),我院为3.4∶1(24/7),差异无统计学意义(λ2=0.11,P=0.74)。表1显示,我院按时和延迟使用IFX患儿,年龄、性别、疾病类型(CD/UC/IBDU)、平均IFX使用次数、诱导阶段例数、维持阶段例数、WBC、Hb、PLT、CRP和PCDAI/PUCAI疾病分期差异均无统计学意义。

表1 延迟使用和按时使用IFX的患儿基线特征
2.3 延迟使用IFX患儿疫情前中临床指标比较 表2显示,和疫情前相比,延迟使用IFX的IBD患儿疫情中血WBC、Hb、PLT、CRP和疾病活动指数差异均无统计学意义(P均>0.05)。56例延迟使用患儿中CD 51例、UC 3例、IBDU 2例,平均延迟治疗时间为(17.9±9.9)d。38例维持原来治疗,10例加用了肠内营养,4例加用了免疫调节剂(激素1例、反应停1例、硫唑嘌呤2例),3例加用了2项治疗措施(肠内营养+硫唑嘌呤1例,肠内营养+激素 1例,肠内营养+反应停1例),1例改为ADA注射治疗。

表2 延迟使用IFX的IBD患儿疫情前后血常规、疾病活动指数和疾病严重程度比较
病例组中7例由缓解期转为轻度活动期,3例由轻度活动期转为中度活动期,1例由中度活动期转为重度活动期。平均延迟(21.3±7.7)d。6例需住院,平均住院时间(10.5±5.7)d,无因延迟使用需外科手术治疗或死亡病例。
2.4 导致疾病分期加重的危险因素分析 鉴于诱导阶段延迟使用IFX疾病分期加重患儿(n=3)和疾病分期未加重患儿 (n=2)例数少,故不纳入单因素Logistic回归分析。以疾病分期加重和未加重为因变量,以年龄,性别,维持阶段延迟治疗时间,血WBC、Hb、PLT和CRP为自变量,行单因素Logistic回归分析(表3)。维持阶段延迟治疗时间3周、血WBC和CRP升高进入多因素Logistic回归分析,维持阶段延期治疗3周[OR=1.05(95%CI: 0.96~1.14),P=0.33],血WBC高于正常值[OR=1.22(95%CI: 0.91~1.65),P=0.19]和CRP高于正常值[OR=1.03(95%CI: 0.92~1.15),P=0.58]均不是疾病分期加重的危险因素。
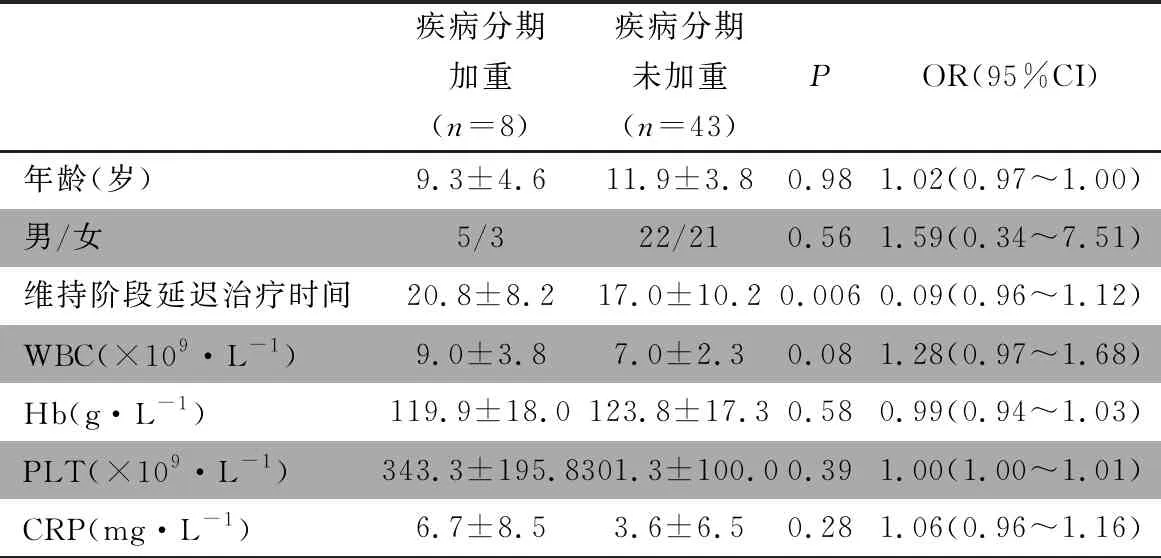
表3 维持阶段疾病分期加重和疾病分期未加重患儿单因素Logistic回归分析
3 讨论
多项研究显示,无论CD还是UC患者,IFX均可以缓解症状,促进黏膜愈合,减少住院和外科手术比例[3-6],是儿童中至重度IBD的主要治疗药物[7-8]。国内外专家共识建议IFX除了可用于中至重度活动期CD的诱导和维持缓解治疗,还可用于激素耐药的活动性CD的诱导缓解治疗和重度UC的“ 拯救”治疗[9-10]。
儿童IFX治疗失败最主要的原因在于IFX浓度低,诱导阶段末IFX的浓度与1年后的预后相关[11]。IFX谷浓度<3 μg·mL-1药物抗体的风险提高4倍[12]。药物抗体形成可加速药物清除(增加2.5倍),缩短药物在循环中的半衰期,进一步降低药物浓度,从而影响治疗效果[13]。
IFX用药依从性很重要,未按时IFX治疗的患儿急诊就诊和住院的比例明显高于按时治疗的患儿[14]。按时使用IFX,抗体产生的发生率为6%~9%;而不规则使用IFX,抗体产生的发生率为28%[15]。依从性每提高10%,对肿瘤坏死因子(TNF)失应答的风险下降24%[16]。本文中单中心按时/延迟使用IFX的患儿比例为3.4∶1,19家医院按时/延迟使用IFX患儿比例为2.9∶1,两者差异无统计学意义(P=0.74)。鉴于没有收集19家医院按时和延迟使用IFX的患儿基线数据,我院基线数据显示按时使用/延迟使用IFX患儿中,年龄、性别、疾病类型(CD/UC/IBDU)、平均IFX使用次数、诱导期病人数、维持期病人数、WBC、Hb、PLT、CRP和PCDAI/PUCAI疾病分期差异均无统计学意义。本文数据显示疫情前规律用药,因为SARS-CoV-2流行,非人为抗力造成依从性下降,不能按时用药,IFX延期用药18 d后,血常规中WBC、Hb、PLT、CRP和疾病活动指数疫情中与疫情前相比差异均无统计学意义,疾病严重程度分布比例疫情前中差异无统计学意义,考虑与IFX半衰期为11~19 d[17],其从体内完全清除需要数月的时间有关。
本研究11例IBD患儿(19.6%)延期治疗21 d后出现疾病分期加重,6例需要住院,平均住院时间(10.5±5.7)d。韩国的研究显示生物制剂延期治疗17 d导致23%的患儿病情反复[18]。因此世界IBD组织(IOIBD)不建议停用生物制剂(IFX、维多珠单抗和乌司奴单抗)来预防SARS-CoV-2感染[19]。本研究显示60%(3/5)处于诱导阶段患儿延迟治疗后出现疾病分期的加重,处于维持阶段的患儿中15.7%(8/51)出现疾病分期的加重。考虑与诱导阶段IFX浓度尚未到达稳定状态有关。
本研究中1例因为疫情不方便使用IFX而转用ADA。ADA为抗TNF-α的人源化单克隆抗体,皮下注射,可以在家治疗;而IFX需要来医院静脉注射治疗。国内外消化病专家建议在疫情期无法使用IFX,也可用ADA替代[18, 20]。当无法按时使用生物制剂时,也可以使用肠内营养替代治疗[18, 20]。研究显示对于CD诱导缓解的儿童,完全肠内营养和糖皮质激素同样有效,黏膜愈合率完全肠内营养组高于糖皮质激素组[21]。完全肠内营养可以作为CD儿童诱导缓解的一线治疗方案[22]。对于复发的患儿也可以再次使用完全肠内营养[23]。
本研究的不足之处:①研究对象中仅有2例患儿暂停使用IFX且均未完成随访,无法评估暂停IFX治疗对患儿病情的影响;②未对患儿行IFX药物浓度和抗体检测,不能证明疾病分期加重是否与延迟使用导致血药浓度下降直接相关;③延迟治疗是否会对这些患儿产生远期影响,需要进一步随访。
综上所述,本研究提示IBD患儿因为疫情因素导致维持治疗阶段延迟使用IFX 3周未改变疾病活动指数。
