高级别B细胞淋巴瘤26例临床分析
2020-08-04杨万秋张旭东陈清江
杨万秋,张旭东,陈清江
1)新乡医学院第一附属医院肿瘤科 河南新乡 453100 2)郑州大学第一附属医院肿瘤科 郑州 450052
2016 WHO淋巴瘤修订分类把不含有MYC、BCL2和(或)BCL6基因易位且形态学介于弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)和伯基特淋巴瘤之间不能分类的淋巴瘤(DLBCL/BL)重新命名为高级别B细胞淋巴瘤,非特指型(high grade B-cell lymphoma, not otherwise specified, HGBL,NOS)[1]。MYC、BCL2和(或)BCL6基因易位的B细胞淋巴瘤被定义为双打击淋巴瘤或三打击淋巴瘤[2]。HGBL包含HGBL,NOS和HGBL伴有双打击/三打击(high grade B-cell lymphoma with double-/triple-hit,HGBL-DT),是一种高度侵袭性的成熟B细胞淋巴瘤,其发病率低,核型复杂,生存期短,复发率高,目前还没有标准的治疗方案[3-4]。本研究对近5 a来本院有完整临床病理资料的26例HGBL患者进行回顾性分析,探讨其临床和病理特征、治疗效果等。
1 对象与方法
1.1研究对象收集郑州大学第一附属医院肿瘤科2014年6月至2019年4月收治的经本院病理确诊或至少经过2家医院病理会诊的HGBL患者26例。纳入标准:①组织病理形态学及免疫组化证实符合DLBCL或DLBCL/BL,病理诊断采用WHO 2016淋巴瘤分型标准。②经荧光原位杂交(fluorescenceinsituhybridization,FISH)检测MYC、BCL2和BCL6基因。③病理诊断明确后至少行1周期化疗方案治疗。排除标准:原发性中枢神经系统淋巴瘤。
临床分期按Ann Arbor分期标准。细胞起源根据Hans免疫分型标准分为生发中心型B细胞(germinal center B-cell,GCB)和非生发中心型B细胞(non-germinal center B-cell,non-GCB)。
1.2观测指标收集患者确诊时的年龄、性别、血清LDH、伴随B症状情况、Ann Arbor分期、ECOG评分、IPI评分,侵犯部位、治疗方案、治疗效果、免疫组化(CD10、BCL6、MUM1、BCL2、MYC、Ki-67)检测结果,FISH(MYC、BCL2、BCL6)检测结果。免疫组化CD10阳性>30%、MUM1阳性>30%、BCL6阳性>30%、MYC阳性>40%、BCL2阳性>50%为+;FISH基因检测发现基因断裂/易位为+。
1.3治疗所有患者初治均采用化疗为主的治疗方案:包括EPOCH、Hyper CVAD、CODOX-M/IVAC、MA方案,部分患者联合利妥昔单抗(rituximab,R)或行自体造血干细胞移植(autologous hematopoietic stem cell transplantation, Auto-HSCT)。
1.4疗效评价每治疗2个周期进行疗效评价,参考2016年LUGANO淋巴瘤疗效标准,分为完全缓解(complete remission,CR),部分缓解(partial remission,PR),疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。
1.5随访通过短信或电话方式随访,随访截止时间为2019年7月31日,随访时间为14(3~58)个月。总生存期(overall survival,OS):指患者从确诊开始至最后1次随访或死亡的时间。无进展生存期(progression free survival,PFS):指患者从治疗开始至第1次发生疾病进展或最后一次随访或死亡的时间。
2 结果
2.1患者临床与病理资料12例HGBL,NOS患者发病年龄55(24~72)岁。14例HGBL-DT患者发病年龄53(23~74)岁。HGBL,NOS组伴有B症状3例,包括发热2例、体重减轻1例;HGBL-DT组伴有B症状6例,包括体重减轻3例、发热2例、盗汗1例。HGBL,NOS组仅侵犯淋巴结者2例,常见的侵犯部位为胃肠道(6/12)、淋巴结(5/12)、骨(3/12)、骨髓(3/12)、肝(2/12)、肾上腺(2/12)、中枢神经系统(1/12)和其他(2/12);HGBL-DT组仅侵犯淋巴结者3例,常见的侵犯部位为淋巴结(10/14)、胃肠道(4/14)、肺(3/14)、骨髓(3/14)、骨(3/14)、扁桃体(2/14)、中枢(2/14)和其他(5/14),具体情况见表1。
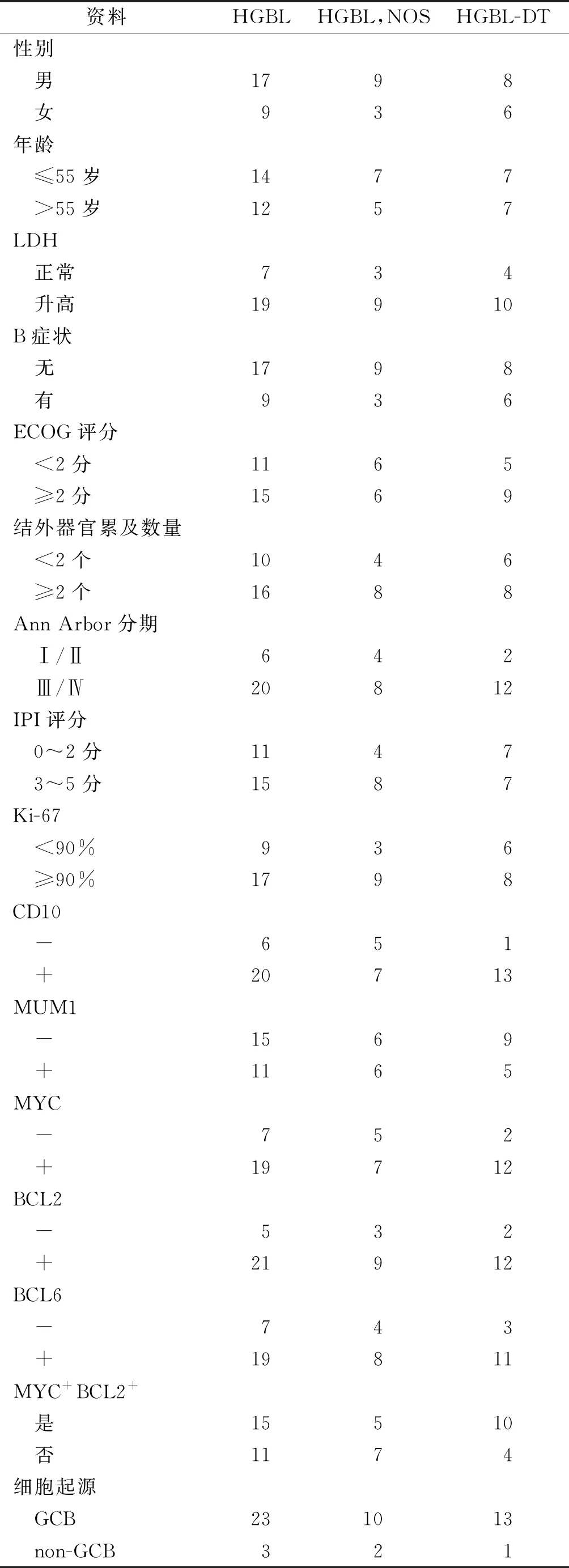
表1 26例HGBL患者的临床与病理资料
2.2免疫组化与FISH检测结果
2.2.1 免疫组化 12例HGBL,NOS患者MYC+BCL2+双表达5例、GCB型10例。14例HGBL-DT患者MYC+BCL2+双表达10例,GCB型13例。
2.2.2 FISH HGBL,NOS组MYC+/BCL2-/BCL6-4例、MYC-/BCL2+3例、MYC-/BCL6+3例;HGBL-DT组MYC+/BCL2+/BCL6-7例、MYC+/BCL2-/BCL6+4例、MYC+/BCL2+/BCL6+3例。
2.3预后
2.3.1 疗效 HGBL,NOS组中7例应用EPOCH/REPOCH方案治疗,CR 2例,PR 2例,SD 2例,PD 1例;3例应用Hyper CVAD方案治疗,CR 2例,SD 1例;2例患者应用CODOX-M/IVAC方案治疗均评价为CR。HGBL-DT组12例应用EPOCH/REPOCH方案治疗,CR 4例,PR 4例,SD 1例,PD 3例,其中1例达到CR后行Auto-HSCT,截至随访结束仍未复发且存活;2例侵犯中枢的患者应用MA方案治疗,PR 1例,SD 1例。
2.3.2 生存情况 HGBL,NOS组PFS为14(2~58)个月,OS为15(3~58)个月。HGBL-DT组PFS为7(2~26)个月,OS为11(4~48)个月。
3 讨论
HGBL包含HGBL,NOS和HGBL-DT。HGBL,NOS形态学符合DLBCL/BL,同时基因不伴有双打击或三打击;HGBL-DT形态学可能类似于B淋巴母细胞淋巴瘤/白血病、BL、DLBCL、DLBCL/BL,同时基因伴有双打击或三打击[1]。
HGBL,NOS来源于DLBCL/BL,好发于GCB型,易侵犯结外器官[5]。本研究结果表明12例HGBL,NOS患者GCB型10例、结外器官受侵占10例,两者结果一致。MYC基因是一种核蛋白类的原癌基因,能够促进与细胞增殖有关基因的开放,从而产生细胞增殖效应,参与肿瘤的形成及发展[6]。有研究[7]发现DLBCL/BL患者MYC基因重排占58%,本研究12例HGBL,NOS患者中MYC+/BCL2-/BCL6-4例、MYC-/BCL2+3例、MYC-/BCL6+3例。HGBL,NOS生存期短,高强度化疗方案CODOXM/IVAC较CHOP或CHOP样方案更能改善患者生存[ 3,5],本研究2例患者行CODOX-M/IVAC方案治疗后均评价为CR。
HGBL-DT具有较高的侵袭性和复发率,OS为2~64个月,好发于GCB型[8]。本研究结果表明14例HGBL-DT患者OS为11(4~48)个月,13例为GCB型。Sesques等[9]发现在HGBL-DT患者中超过80%的FISH结果为MYC+/BCL2+/BCL6-。本研究14例患者FISH结果中7例患者为MYC+/BCL2+/BCL6-,比例偏低。国内有文献[10]报道MYC+/BCL2+/BCL6-的比例仅为30%,与本研究结果接近,可能是由于我国MYC+/BCL2+/BCL6-发病率较西方人偏低。
HGBL-DT目前没有标准的治疗方案,应用RCHOP方案疗效差,易产生化疗耐药且复发率高,建议应用强化诱导方案来改善预后[11]。Petrich等[12]发现DA-REPOCH可以改善患者的OS。本研究14例患者应用MA、EPOCH/REPOCH方案治疗,患者中位PFS、OS分别为7、11个月。目前HSCT治疗HGBL-DT的证据尚不充分[11-12],本研究1例HGBL-DT患者达到CR后行Auto-HSCT,截至随访结束未复发。
综上所述,HGBL生存期短,易侵犯结外器官,目前尚无标准的治疗方案和明确的不良预后因素,积极探索其治疗方案及不良预后指标是很有必要的。
