下调miR-208b-5p对血管紧张素Ⅱ诱导的乳鼠心肌细胞肥大的影响
2020-08-04郑甲林宋丽娟李建美
郑甲林,宋丽娟,郭 涛,李建美
1)云南省阜外心血管病医院心内科 昆明 650000 2)云南省第二人民医院心内科 昆明 650000
血管紧张素Ⅱ(angiotensinⅡ, AngⅡ)是一种与心肌肥厚有关的诱导因子,能够在体外诱导心肌细胞肥大,是常用的构建心肌细胞肥大体外模型的诱导因子[1]。miRNA参与调控心肌肥厚进程,探讨miRNA在心肌肥厚中的作用对于治疗心肌肥厚有重要意义[2]。miR-208b-5p是一个与心脏发育有关的miRNA,在正常心肌细胞分化、血管平滑肌细胞生长等过程中扮演重要角色[3]。最近的研究[4-5]表明,miR-208b-5p在心脏疾病中发挥调控功能,参与心肌缺血再灌注损伤、心肌梗死等过程。miR-208b-5p在肥厚心肌中过表达,其可能是心肌肥厚促进因子[6]。作者以乳鼠心肌细胞作为实验对象,观察下调miR-208b-5p对AngⅡ诱导的乳鼠心肌细胞肥大的影响,为治疗心肌细胞肥大提供可能靶点。
1 材料与方法
1.1主要材料Nmnat2 siRNA、siRNA阴性对照(si-NC)、miR-208b-5p抑制物、抑制物阴性对照由上海锐赛生物技术有限公司合成;Lipofectamine 2000购自美国Invitrogen公司;SD乳鼠(体重5~7 g)由昆明医科大学动物中心提供;AngⅡ购自美国Sigma公司;cDNA合成试剂盒、SYBR Premix Ex TaqⅡ荧光定量试剂盒购自宝生物工程(大连)有限公司;所有引物均由南京金斯瑞生物科技有限公司合成;双荧光素酶报告载体由湖南普拉特泽生物科技有限公司构建;Nmnat2抗体购自美国Abcam公司。
1.2原代乳鼠心肌细胞的分离及培养参照文献[7],将SD乳鼠置体积分数75%的乙醇溶液中浸泡并消毒,然后取心脏组织,放在冰预冷的PBS溶液中洗涤。用眼科剪把乳鼠心脏组织剪碎(<1 mm3),然后添加含有1.25 g/L胰蛋白酶的EDTA溶液,混匀后37 ℃水浴消化5 min,自然沉降,吸弃上清液(去除坏死的心肌细胞)。然后在组织块中添加Ⅰ型胶原酶,吹打混匀后放在37 ℃的恒温水浴中反应8 min,然后吸取上清液添加含体积分数15%胎牛血清的细胞培养液,重复上述操作,直至组织块完全消化。将收集的上清液以1 200×g离心10 min,添加PBS溶液洗涤细胞2次,最后重悬于含体积分数10%胎牛血清的细胞培养液中,37 ℃培养1 h,吸取上清液,接种到6孔板内。在细胞培养的前48 h,在培养液中添加100 μmol/L 5-BrdU以抑制非心肌细胞的增殖。分离培养的细胞经过免疫组化SABC法α-actin检测呈阳性,鉴定为心肌细胞。
1.3细胞分组及处理方法心肌细胞分成对照组、AngⅡ组、Anti-NC+AngⅡ组、Anti-miR-208b-5p+AngⅡ组共4组,其中AngⅡ组、Anti-NC+AngⅡ组、Anti-miR-208b-5p+AngⅡ组细胞在实验0 h时均用含100 nmol/L的AngⅡ细胞培养液处理;Anti-NC+AngⅡ组、Anti-miR-208b-5p+AngⅡ组细胞在用AngⅡ处理之前分别转染抑制物阴性对照和miR-208b-5p抑制物;对照组为正常培养的心肌细胞。细胞培养24 h后进行相关指标的检测。转染试剂采用Lipofectamine 2000,步骤同试剂说明书。每组均设3个复孔,实验重复3次。
1.4心肌细胞中miR-208b-5p、ANP、BNP、Nmnat2mRNA表达的qRT-PCR法检测按照Trizol试剂说明书提取细胞中的总RNA,以紫外分光光度计检测A(260 nm)/A(280 nm)符合实验要求,保存于-80 ℃备用。采用cDNA合成试剂盒合成cDNA,反转录条件:37 ℃孵育15 min,85 ℃孵育5 s,得到的cDNA保存于-20 ℃备用。引物序列如下:miR-208b-5p上游引物5’-CTTTTGGCCCGGGT TATAC-3’,下游引物5’-CTGACATCCTCTAGGCT GG-3’;内参U6上游引物5’-CTCGCTTCGGCAGCA CA-3’,下游引物5’-ACGCTTCACGAATTTGCGT-3’。 ANP、BNP、Nmnat2内参设置为GAPDH。ANP上游引物5’-AAAGCAAACTGAGGGCTCTGCTCG-3’,下游引物5’-TTCGGTACCGGAAGCTGTTGCA-3’;BNP上游引物5’-AACAATCCAGCATGCAGAAGC-3’,下游引物5’-AGGCGCTGTCTTGAGACCTA-3’;Nmnat2上游引物5’-TTACGGGGTCATTAGTTCATAGC-3’,下游引物5’-CCTATTGGCGTTACTAC TATGGGAA-3’;GAPDH上游引物5’-GACATGCCGCCTGGAGAAAC-3’,下游引物5’-AGCCCAGGATGCCCTTTAGT-3’。PCR反应体系:20 μL的SYBR Premix Ex TaqTMⅡ,上、下游引物各3.2 μL,4 μL的cDNA,添加双蒸水至40 μL。反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 20 s,共40个循环。采用2-ΔΔCt法计算目的基因的相对表达量。
1.5心肌细胞表面积测定取心肌细胞,用Image-Pro Plus 6.0图像分析系统检测单个心肌细胞的表面积,每组选择10个细胞图片,计算平均值。
1.6心肌细胞中Nmnat2、ANP、BNP蛋白表达的Western blot检测用含1 mmol/L PMSF的蛋白裂解试剂提取细胞中的总蛋白,根据BCA蛋白浓度检测试剂盒检测蛋白样品的浓度。配制SDS-PAGE凝胶,蛋白样品中添加等体积的2×Loading Buffer混匀后,100 ℃煮沸5 min。按照每个泳道中添加30 μg蛋白样品进行上样,首先用80 V恒压在浓缩胶中电泳,然后将电压调整为100 V继续电泳直至溴酚蓝染料进入凝胶底部。在120 V电压条件下将凝胶上的蛋白转移到NC膜上,NC膜置于封闭液中封闭2 h后,再置于1∶1 000稀释的兔抗鼠Nmnat2、BNP、ANP抗体反应液中反应2 h,最后置于1∶4 000稀释的山羊抗兔辣根过氧化物标记的二抗反应液中孵育2 h。添加ECL显色试剂,使用Quantity One分析条带的灰度值,GAPDH作为内参。目的蛋白相对表达量=目的蛋白条带灰度值/内参条带灰度值。
1.7靶基因预测和鉴定在线靶基因预测软件发现Nmnat2的3’UTR端与miR-208b-5p有碱基互补结合位点,分别构建含有3’UTR端结合位点的野生型荧光素酶报告载体(WT)和不含3’UTR端结合位点的突变型荧光素酶报告载体(MUT),将WT和MUT分别与抑制物阴性对照和miR-208b-5p抑制物共转染至心肌细胞中,48 h后采用双荧光素酶活性检测试剂盒测定细胞内荧光素酶活性。实验重复3次。
1.8Nmnat2siRNA对下调miR-208b-5p的心肌细胞表面积和Nmnat2、ANP、BNP表达的影响在心肌细胞中共转染miR-208b-5p抑制物和Nmnat2 siRNA、miR-208b-5p抑制物和si-NC,以100 nmol/L的AngⅡ细胞培养液培养,分别记为Anti-miR-208b-5p+si-Nmnat2+AngⅡ组和 Anti-miR-208b-5p+si-NC+AngⅡ组。细胞培养24 h后,按照上述方法分别检测细胞表面积和Nmnat2、ANP、BNP 表达水平。实验重复3次。
1.9统计学处理采用SPSS 21.0进行数据分析。Anti-miR-208b-5p+si-NC+AngⅡ组、Anti-miR-208b-5p+si-Nmnat2+AngⅡ组心肌细胞表面积及ANP、BNP、Nmnat2 mRNA和蛋白相对表达量的比较,抑制物阴性对照组和miR-208b-5p抑制物组荧光素酶活性的比较均采用两独立样本的t检验;多组间心肌细胞表面积,miR-208b-5p相对表达量,ANP、BNP、Nmnat2 mRNA和蛋白相对表达量的比较均采用单因素方差,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.14组心肌细胞中miR-208b-5p相对表达量、心肌细胞表面积和ANP、BNP、Nmnat2表达水平的比较结果见图1和表1。与对照组比较,AngⅡ组心肌细胞中miR-208b-5p相对表达量、心肌细胞表面积增加,细胞中ANP、BNP mRNA和蛋白表达水平升高,Nmnat2 mRNA和蛋白表达水平降低;与Anti-NC+AngⅡ组比较,Anti-miR-208b-5p+AngⅡ组心肌细胞中miR-208b-5p相对表达量、心肌细胞表面积减少,细胞中ANP、BNP mRNA和蛋白表达水平降低,Nmnat2 mRNA和蛋白表达水平升高。
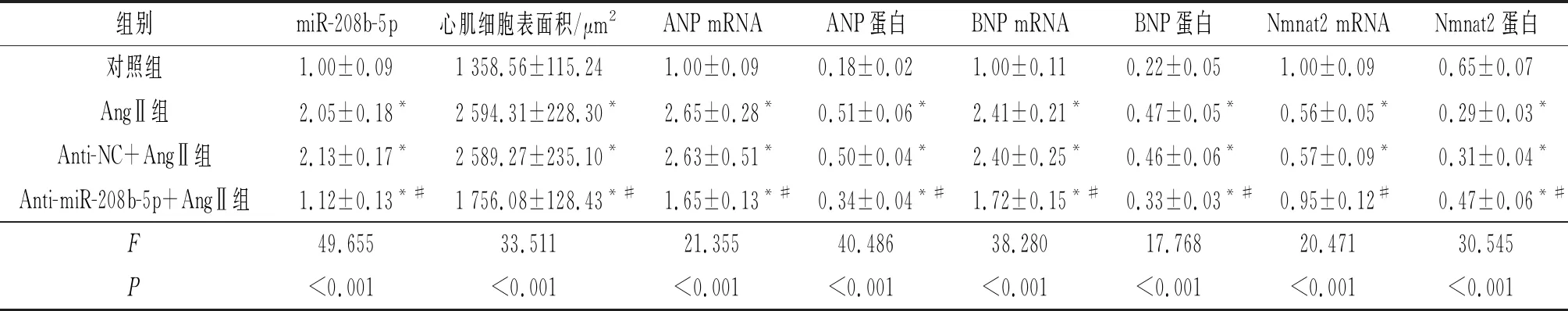
表1 4组心肌细胞中miR-208b-5p相对表达量、心肌细胞表面积、ANP、BNP、Nmnat2 mRNA和蛋白表达的比较(n=3)
2.2miR-208b-5p和Nmnat2靶向关系预测和鉴定结果预测结果见图2,双荧光素酶实验鉴定结果见表2。WT时,与抑制物阴性对照组比较,miR-208b-5p抑制物组心肌细胞中荧光素酶活性升高。
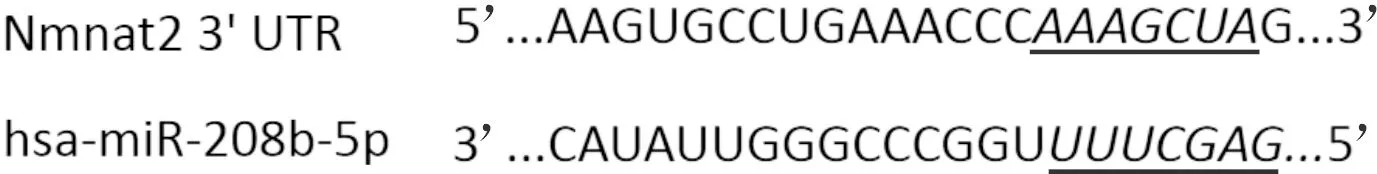
图2 靶基因预测软件预测的miR-208b-5p与Nmnat2的靶点
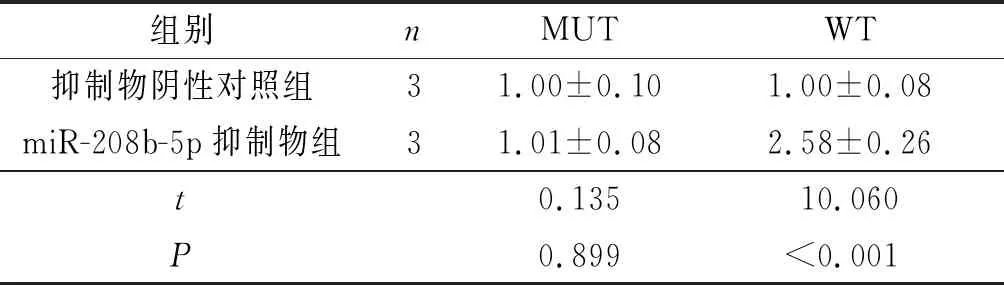
表2 2组荧光素酶活性的比较
2.3Nmnat2siRNA对下调miR-208b-5p的心肌细胞表面积和ANP、BNP表达的影响结果见图3和表3。与Anti-miR-208b-5p+si-NC+AngⅡ组比较,Anti-miR-208b-5p+si-Nmnat2+AngⅡ组细胞表面积变大,心肌细胞中Nmnat2表达水平降低,ANP、BNP表达水平升高。
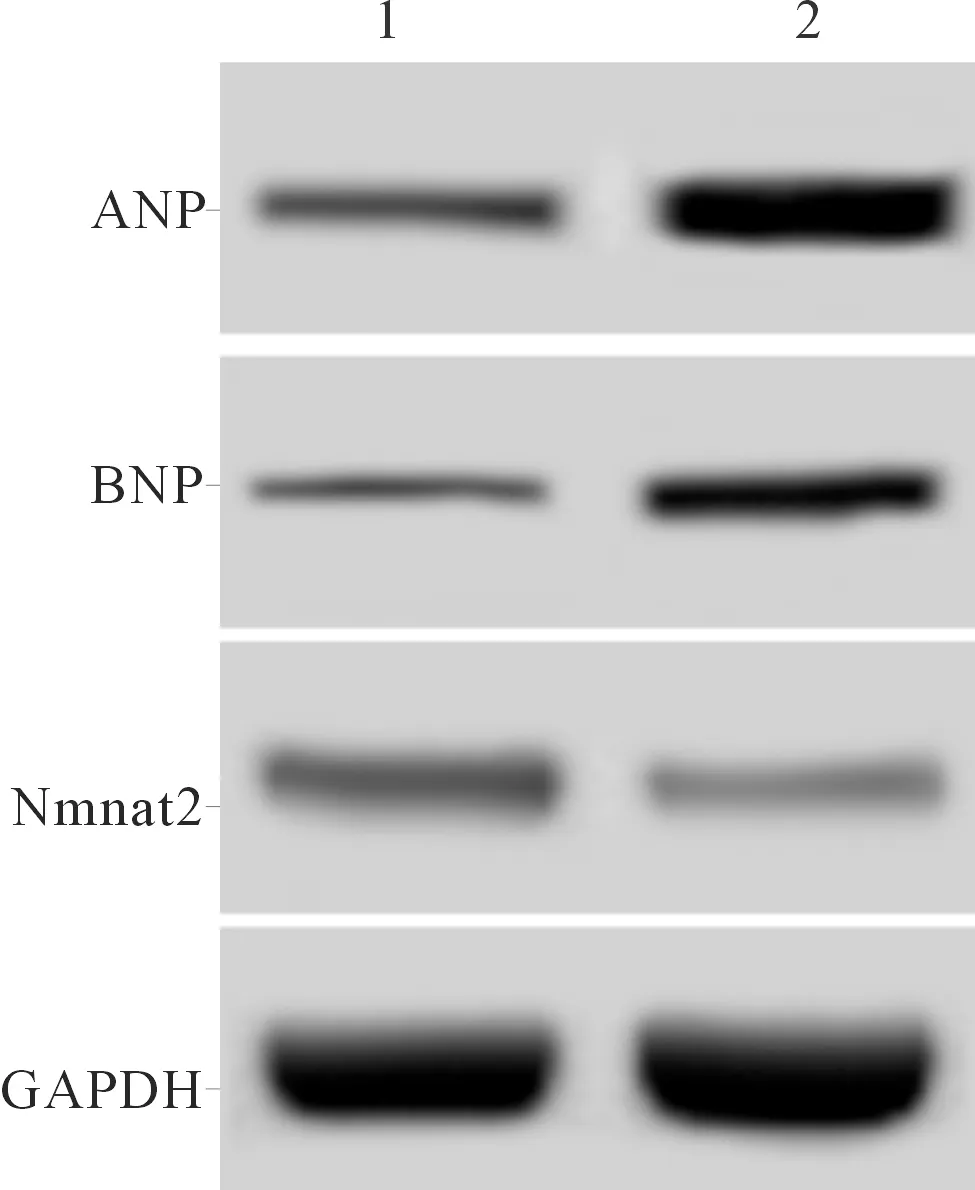
1:Anti-miR-208b-5p+si-NC+AngⅡ组;2:Anti-miR-208b-5p+si-Nmnat2+AngⅡ组
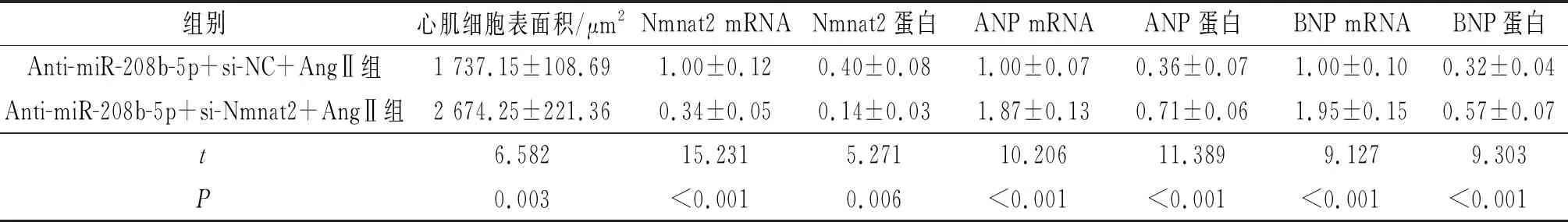
表3 2组心肌细胞表面积及Nmnat2、ANP、BNP mRNA和蛋白相对表达量的比较(n=3)
3 讨论
本实验结果表明,AngⅡ处理后的乳鼠心肌细胞表面积增加,细胞中肥大基因ANP、BNP表达水平升高,提示AngⅡ能够诱导心肌细胞肥大。AngⅡ是心肌肥厚发生过程中的内分泌因子,也是心肌肥厚的促进因子,其可以增加心肌细胞表面积,促进心肌细胞肥大发生[1]。ANP、BNP在心肌肥厚患者中表达水平升高,是心肌细胞肥大发生的标志[8]。该实验结果与上述研究结果一致,说明AngⅡ体外诱导心肌细胞肥大发生,构建了体外心肌细胞肥大模型。
miRNA在心血管系统中扮演重要角色,对于心脏发育和心脏相关疾病有调控作用[9-10]。miR-208b-5p是近些年来发现的与心脏有关的miRNA,参与心肌细胞分化、心肌成纤维细胞生长过程,miR-208b-5p还与心肌纤维化等过程有关[11]。miR-208b-5p在心肌肥厚患者中表达水平显著升高,在体外肥大心肌细胞中也高表达[12]。本次实验发现,AngⅡ处理后的心肌细胞中miR-208b-5p表达水平升高,并且下调miR-208b-5p可以抑制AngⅡ诱导的心肌细胞肥大,说明miR-208b-5p是一个心肌细胞肥大促进因子,下调miR-208b-5p具有抵抗心肌细胞肥大的作用。
我们还发现Nmnat2是miR-208b-5p的靶基因,并且其在AngⅡ处理的心肌细胞中低表达,miR-208b-5p作用机制可能与靶向调控Nmnat2有关。Nmnat2是一个参与大脑和神经系统发育的关键酶,在神经修复、神经退化等过程中具有重要作用[13]。最近的研究[14]表明,Nmnat2与心肌肥厚有关,Nmnat2在心肌肥厚大鼠模型中低表达,并且上调Nmnat2表达可以抑制心肌细胞肥大发生。我们发现,Nmnat2 siRNA能够逆转下调miR-208b-5p对AngⅡ诱导的心肌细胞肥大的抑制作用,证实下调miR-208b-5p抵抗AngⅡ诱导的心肌细胞肥大作用机制与靶向负调控Nmnat2有关。
综上所述,miR-208b-5p在心肌细胞肥大过程中可能发挥促进因子的作用,其在AngⅡ诱导的心肌细胞肥大模型中高表达,下调miR-208b-5p能够抵抗心肌细胞肥大发生,并且其作用机制与靶向调控Nmnat2有关。这为寻找有效的分子靶点治疗心肌细胞肥大提供了新方向,为研究miR-208b-5p在心血管系统疾病中的作用提供了参考。
