沉默TRIM26表达对乳腺癌MCF-7细胞增殖、凋亡、侵袭与迁移能力的影响
2020-08-04张波,高峡
张 波,高 峡
宜昌市第二人民医院(三峡大学第二人民医院)肿瘤外一科 湖北宜昌 443000
乳腺癌是女性常见的恶性肿瘤之一[1]。在我国,乳腺癌是发病率与病死率均居第1位的女性肿瘤疾病[2]。TRIM是一类结构保守的蛋白家族,目前为止已发现80多个成员[3]。TRIM蛋白在先天性免疫反应、细胞增殖、分化、凋亡和自噬中均发挥重要作用[4-5]。此外,有研究[6]发现,TRIM家族蛋白与许多疾病密切相关,例如TRIM24、TRIM59、TRIM63等在胶质瘤、结直肠癌、肝癌、胃癌等多种恶性肿瘤组织中高表达。关于TRIM26在部分肿瘤中发挥的作用已有研究[7],但TRIM26在乳腺癌中的表达及机制尚不清楚。因此,本研究通过沉默乳腺癌细胞中TRIM26 的表达,观察乳腺癌细胞生物学行为的变化,并初步探究其作用机制,以期为乳腺癌的靶向治疗提供实验依据。
1 材料与方法
1.1标本、细胞及主要试剂乳腺组织标本为宜昌市第二人民医院2017年3月至2018年12月手术切除标本,癌及癌旁正常组织各50例。患者均为女性,年龄37~48(43.2±4.2)岁,乳腺癌的诊断依据 2003 年 WHO 乳腺癌病理分类标准,术前均未接受化疗、放疗等辅助治疗,均签署知情同意书,研究获得本院伦理委员会批准。人乳腺癌细胞株MCF-7 购自美国ATCC。胎牛血清、青霉素、链霉素、DMEM培养液以及胰蛋白酶购自美国 HyClone公司,Lipofectamine 2000试剂盒购自美国 Invitrogen 公司,Trizol 试剂盒与SYBR Green qPCR Master Mixes试剂盒购自美国Thermo Scientific公司,结晶紫染色液、TRIM26免疫组化试剂盒、CCK-8试剂盒、Transwell小室与Annexin V-FITC试剂盒购自上海碧云天生物技术有限公司,RIPA裂解缓冲液、BCA蛋白测定试剂盒与化学发光液ECL购自北京索莱宝科技有限公司,兔抗TRIM26、p-PI3K、PI3K、p-AKT、AKT、p-mTOR以及mTOR均购自美国Santa Cruz公司,鼠抗GAPDH与HRP标记山羊抗兔IgG购自北京中杉金桥生物技术有限公司,其他试剂均为国产分析纯。
1.2乳腺癌与癌旁正常组织中TRIM26蛋白表达的免疫组化法检测将乳腺癌与癌旁正常组织用40 g/L多聚甲醛固定,常规石蜡包埋,制成4 μm厚的石蜡组织切片,经脱蜡处理后,采用0.01 mol/L枸橼酸盐缓冲液修复抗原,体积分数3% H2O2阻断内源性过氧化物酶后,牛血清白蛋白封闭30 min,加入TRIM26一抗(1∶500稀释)4 ℃孵育过夜,次日PBS 冲洗,加入HRP标记山羊抗兔IgG二抗(1∶5 000稀释)室温孵育30 min,PBS冲洗后DAB显色,苏木素复染,脱水透明后中性树胶封片,光学显微镜下观察。应用PBS代替一抗作为阴性对照,用已知乳腺癌组织阳性染色切片作为阳性对照。染色强度评分:无染色为0分,染色弱、呈浅黄色为1分,染色清晰、呈棕黄色为2分,染色强、呈棕褐色为3分。每例观察5个400倍视野,每个视野计数不少于200个细胞,阳性细胞百分比<10%为0分,10%~为1分,26%~为2分,51%~为3分,76%~为4分。两项评分之积≤1为阴性,≥2为阳性。
1.3乳腺癌与癌旁正常组织中TRIM26mRNA表达的qRT-PCR检测使用Trizol试剂盒分别提取乳腺癌与癌旁正常组织的总RNA,测定纯度和浓度,按照cDNA合成试剂盒说明进行反转录获得cDNA,使用SYBR Green qPCR Master Mixes试剂盒进行PCR,以GAPDH作为内参。引物由上海生工生物工程技术服务有限公司合成,TRIM26上游引物5’-TCCAGGCTGCAATCGCTA-3’,下游引物5’-ACTCCGTGACGATCCAGA-3’,产物大小为284 bp;GAPDH上游引物5’-TGAAGGTCGGAGTCAACG-3’, 下游引物5’-CATGTAGTTGAGGTCAATGAG-3’,产物大小为233 bp。扩增条件:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 30 s,72℃ 10 s,35 个循环。采用2-ΔΔCt法计算TRIM26 mRNA的相对表达量。
1.4细胞培养、分组及siRNA转染将MCF-7 接种于含体积分数10%胎牛血清、100 U/mL青霉素与100 mg/L链霉素的 DMEM培养液中,置于37 ℃、体积分数5% CO2培养箱中进行培养。待细胞融合度达到80%左右时,采用2.5 g/L胰蛋白酶进行消化传代。取对数生长期的细胞以 2×105个/孔接种于6孔板中进行培养,细胞融合度达到70%左右时进行转染。将细胞分为空白对照组(正常培养)、siRNA-NC组(转染阴性对照 siRNA-NC)和siRNA-TRIM26 组(转染 siRNA-TRIM26),siRNA序列由上海生工生物工程技术服务有限公司设计并合成。按照Lipofectamine 2000说明书操作。转染后细胞在37 ℃、体积分数5% CO2培养箱中孵育6 h,弃原培养基,更换为DMEM新鲜培养基培养。
1.5细胞活性的CCK-8法检测将转染后的3组MCF-7细胞以3×103个/孔的密度接种到96孔板中,在37 ℃、体积分数5% CO2培养箱中继续培养。分别于24、48、72、96 h时每孔加10 μL CCK-8溶液,继续培养2 h,在酶标仪上于450 nm 处检测各孔吸光度(A)值。实验重复3次。
1.6细胞集落形成数目的检测将转染48 h后的3组MCF-7细胞以2×103个接种到培养皿中,并轻轻晃动使细胞分散均匀,随后置于37 ℃、体积分数5% CO2的细胞培养箱中培养14 d。当出现肉眼可见的细胞集落,PBS洗涤后,40 g/L多聚甲醛固定,结晶紫染色10 min,流水冲洗,干燥后在100倍镜下观察并计数细胞集落数目(将≥50个细胞聚集作为1个细胞集落)。实验重复3次。
1.7细胞凋亡与细胞周期的检测①细胞凋亡:将转染48 h后的3组MCF-7细胞用预冷的PBS洗涤,采用Annexin V-FITC细胞凋亡检测试剂盒进行检测。首先使用500 μL Binding Buffer重悬细胞,在悬浮液中加入5 μL Annexin V-FITC,接着加入10 μL PI,室温避光孵育30 min,随后立即采用流式细胞仪检测细胞凋亡率。②细胞周期:将转染后的MCF-7细胞用预冷的PBS洗涤,并使用预冷的体积分数75%乙醇重悬细胞,在-20 ℃固定24 h,PBS再次洗涤并重悬细胞,每组取 450 μL 细胞悬液,加2 μL RNase后,37 ℃孵育 10 min,接着加500 μL PI,37 ℃避光孵育30 min,过300目筛网,采用流式细胞仪检测细胞周期。实验均重复3次。
1.8细胞侵袭与迁移能力的检测在Transwell 小室的上室加50 μL稀释的 Matrigel 胶,37 ℃放置40 min。将转染48 h后的3组MCF-7细胞调整为1×106个/mL,Transwell小室的上室每孔加入100 μL 细胞悬液,下室加入600 μL含体积分数10% 胎牛血清的DMEM培养液培养至细胞贴壁,换无血清培养液培养12 h,放入37 ℃、体积分数5% CO2培养箱中孵育12 h ,取出小室,弃培养液,用棉签擦去上室的细胞,以40 g/L多聚甲醛固定15 min,结晶紫染色10 min,PBS洗涤,封片,在200倍镜下拍照并统计侵袭细胞数。迁移实验无铺Matrigel 胶步骤,其他操作与侵袭实验相同。实验均重复3次。
1.9细胞中p-PI3K、PI3K、p-AKT、AKT、p-mTOR及mTOR蛋白表达的Western blot检测使用RIPA裂解缓冲液提取转染48 h后3组MCF-7细胞的总蛋白,检测蛋白浓度。每个样本取30 μg蛋白进行聚丙烯酰胺凝胶电泳,将分离后蛋白转移至PVDF膜上,50 g/L脱脂奶粉液室温封闭2 h,加入兔抗p-PI3K、PI3K、p-AKT、AKT(1∶1 000稀释)及兔抗p-mTOR、mTOR(1∶2 000稀释),以鼠抗GAPDH(1∶5 000稀释)作为内参,4 ℃孵育过夜,次日弃一抗,TBST洗涤,滴加HRP标记的山羊抗兔IgG(1∶10 000稀释),室温孵育1 h,TBST洗涤后,滴加ECL发光显影,凝胶成像系统中曝光,利用 Bio-Rad软件分析各条带灰度值。以目的条带与 GAPDH条带灰度值的比值表示目的蛋白相对表达量。实验重复3次。
1.10统计学处理使用SPSS 22.0进行数据分析。乳腺癌与癌旁正常组织中TRIM26 mRNA相对表达量的比较采用配对资料的t检验,TRIM26蛋白阳性表达率的比较采用配对资料的χ2检验;3组细胞A值、集落形成数目、细胞周期、凋亡率、侵袭细胞数、迁移细胞数和细胞中p-PI3K、PI3K、p-AKT、AKT、p-mTOR、mTOR蛋白相对表达量的比较均采用单因素方差分析和SNK-q检验。检验水准α=0.05。
2 结论
2.1乳腺癌与癌旁正常组织中TRIM26表达的比较癌旁正常组织和乳腺癌组织中TRIM26 mRNA的相对表达量分别为(1.00±0.02)和(3.67±0.54)(t配对=20.786,P<0.001)。乳腺癌组织中TRIM26蛋白阳性表达率高于癌旁正常组织,见图1与表1。
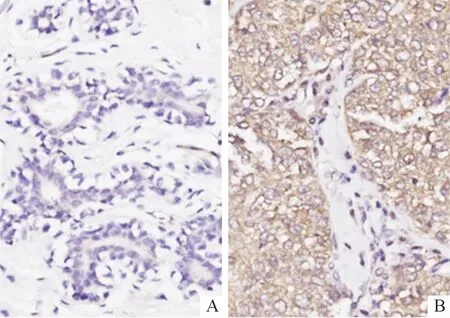
图1 癌旁正常组织(A)与乳腺癌组织(B)中TRIM26蛋白的表达(IHC,×400)
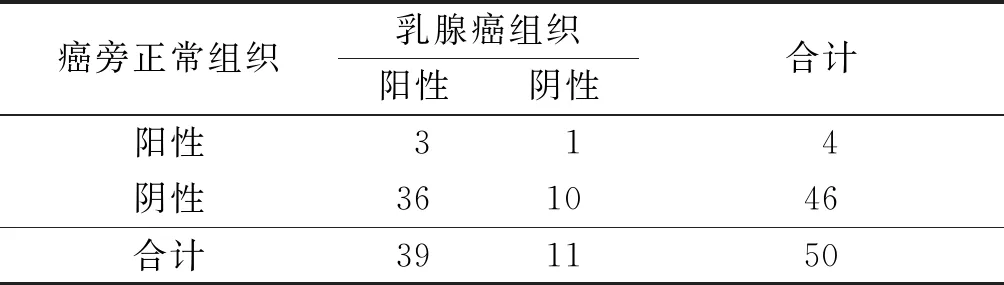
表1 乳腺癌与癌旁正常组织中TRIM26蛋白表达的比较例
2.23组MCF-7细胞A值与细胞集落形成数目的比较结果见图2与表2。转染24、48、72、96 h后,siRNA-TRIM26组MCF-7细胞A值均小于空白对照组和siRNA-NC 组;siRNA-TRIM26组MCF-7细胞集落形成数目小于空白对照组和siRNA-NC组。
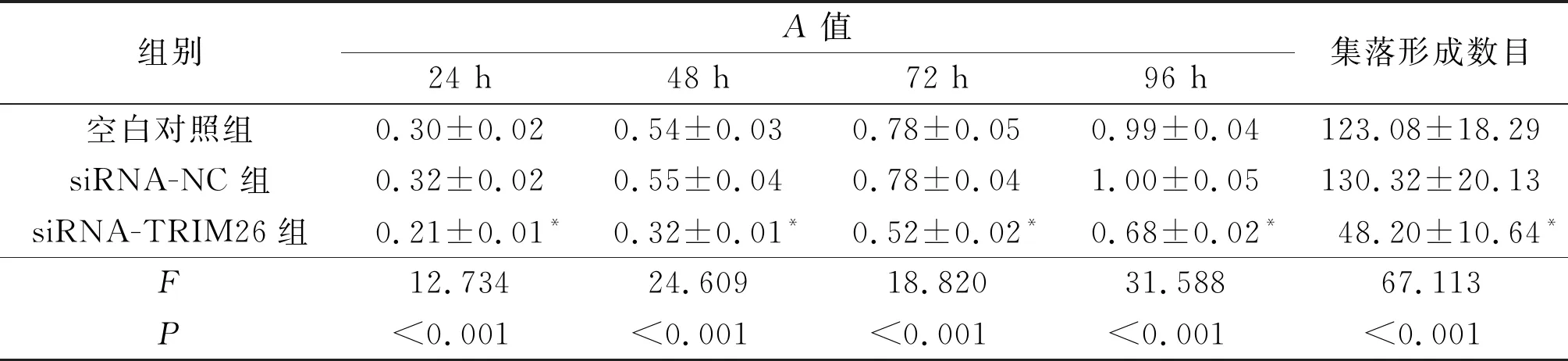
表2 3组MCF-7细胞A值与集落形成数目的比较(n=3)
2.33组MCF-7细胞细胞周期比较siRNA-TRIM26组G0/G1期细胞比例较空白对照组和siRNA-NC组降低,而G2/M期细胞比例较空白对照组和siRNA-NC组增加,见表3。
A:空白对照组;B:siRNA-NC 组;C:siRNA-TRIM26组

表3 3组MCF-7细胞细胞周期比较(n=3) %
2.43组MCF-7细胞凋亡率、侵袭细胞数、迁移细胞数比较siRNA-TRIM26组MCF-7细胞凋亡率高于空白对照组和siRNA-NC组,侵袭细胞数与迁移细胞数低于空白对照组和siRNA-NC组,见表4。
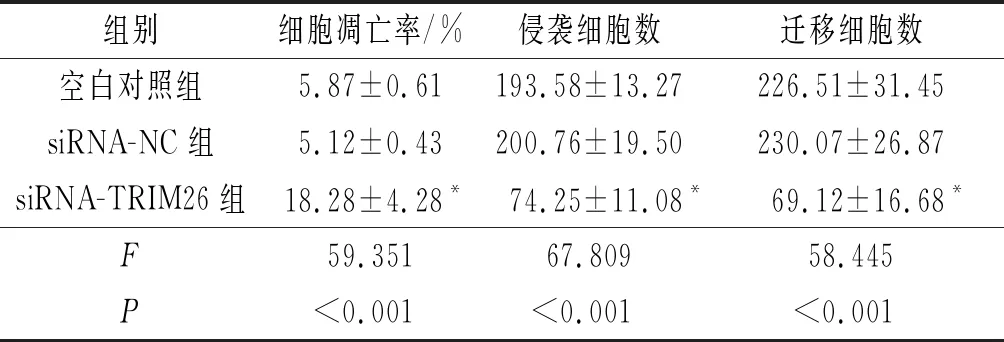
表4 3组MCF-7细胞凋亡率、侵袭细胞数与迁移细胞数比较(n=3)
2.53组MCF-7细胞PI3K/AKT/mTOR信号通路相关蛋白表达比较siRNA-TRIM26组细胞中p-PI3K、p-AKT、p-mTOR蛋白相对表达量较空白对照组和siRNA-NC 组降低,见图3与表5。
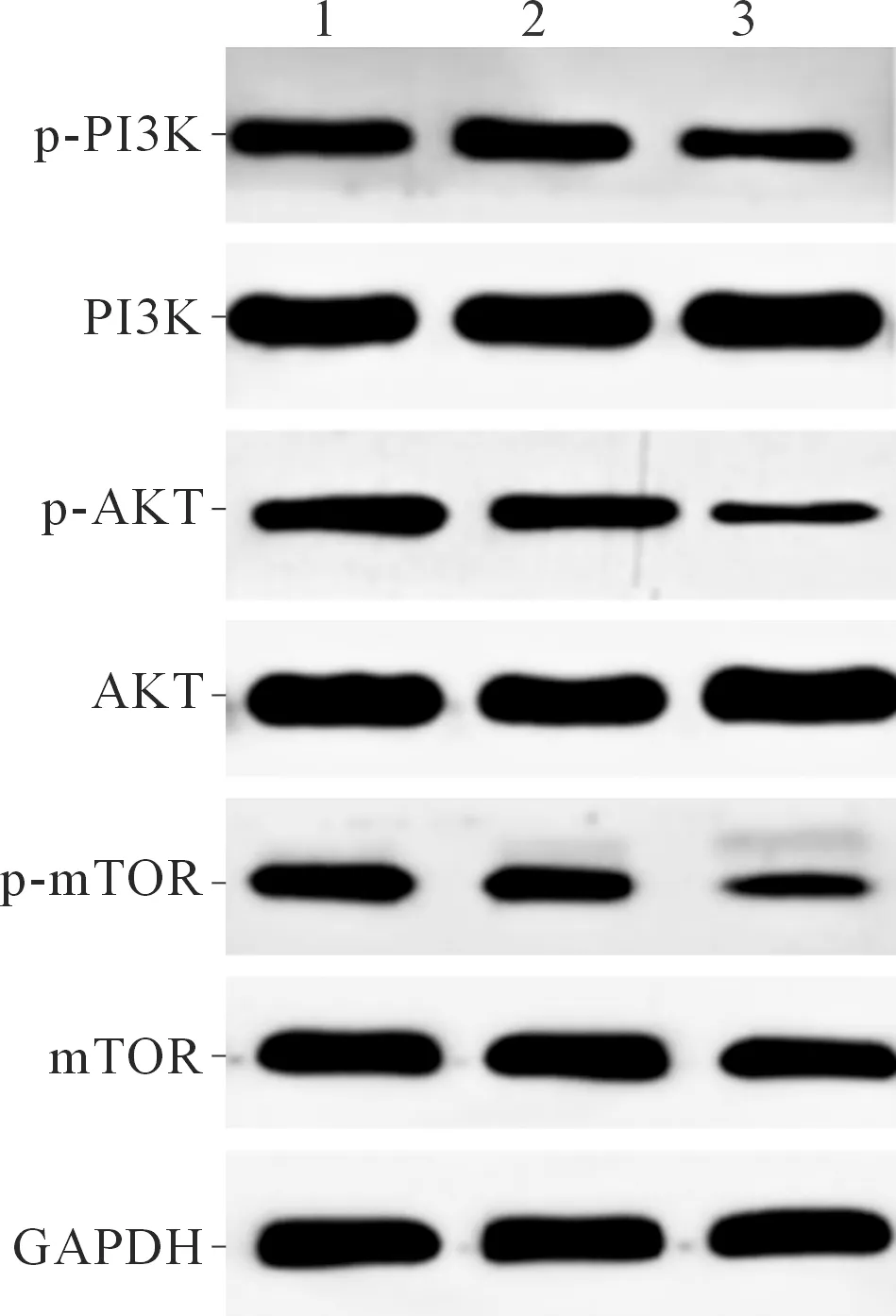
1:空白对照组;2:siRNA-NC 组;3:siRNA-TRIM26组
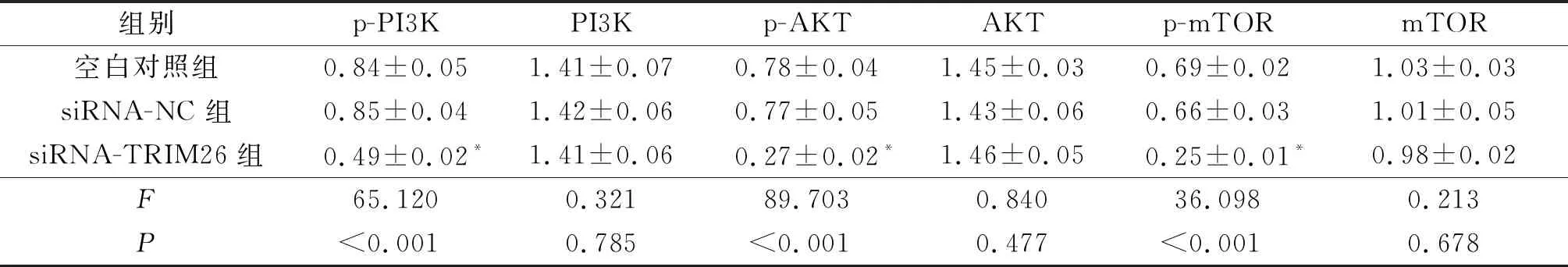
表5 3组MCF-7细胞中PI3K/AKT/mTOR信号通路相关蛋白表达的比较(n=3)
3 讨论
乳腺癌的主要治疗方法包括手术切除、激素治疗、放疗和新辅助化疗等[3]。近年来,基因靶向治疗在肿瘤治疗领域表现出广阔的应用前景[8]。TRIM家族中许多成员在肿瘤中发挥促癌或抑癌作用。例如,TRIM44通过刺激TLR4激活AKT/mTOR信号通路诱导黑色素瘤进展[9],TRIM29通过激活Wnt/β-catenin信号通路促进大肠癌的上皮-间质转化与发展[10]。TRIM26作为TRIM超家族成员之一,已发现其在天然免疫反应中发挥重要作用[11]。此外,TRIM26同样参与肿瘤的生物学进程,如TRIM26在肝癌组织中表达下调,与肝癌细胞的增殖、迁移和侵袭能力呈负相关,并促进细胞凋亡,发挥抑癌作用[12]。TRIM26 在胶质瘤组织中呈高表达,过表达TRIM26可促进胶质瘤细胞U87及U251的增殖[13]。本研究结果显示乳腺癌组织中TRIM26蛋白和mRNA表达水平较癌旁正常组织升高,提示TRIM26可能参与乳腺癌发生发展。
本研究还探讨了TRIM26对乳腺癌细胞生物学行为的影响,结果显示,沉默乳腺癌MCF-7细胞中TRIM26的表达后,细胞的增殖活性明显下降,细胞集落形成数目也明显减少,细胞被阻滞于G2/M期,侵袭与迁移能力明显下降,凋亡率升高。PI3K/AKT/mTOR信号通路与细胞周期、增殖及凋亡等行为密切相关。在多种恶性肿瘤组织中PI3K/Akt/mTOR 信号通路的异常激活可增强细胞活性,促进细胞生长和蛋白质合成,从而促进癌症的发展[14]。本研究发现,在乳腺癌细胞中沉默TRIM26表达后,细胞中p-PI3K、p-AKT、p-mTOR蛋白表达水平明显下降。因此,我们推测沉默TRIM26表达可阻碍PI3K/AKT/mTOR信号通路,从而抑制乳腺癌的一些恶性生物学行为。
综上所述,沉默TRIM26表达可抑制乳腺癌细胞增殖、侵袭与迁移能力,并诱导细胞凋亡,其机制可能与抑制PI3K/AKT/mTOR信号通路有关,提示TRIM26可能是乳腺癌诊治的有效靶点之一。
