线粒体钙单向转运体在无镁致痫海马神经元凋亡中的作用
2020-08-04谢南昌李英娇连亚军孟祥荷李钰娟杜丽媛
谢南昌,李英娇,王 翠,连亚军,孟祥荷,李钰娟,杜丽媛
1)郑州大学第一附属医院神经内科 郑州 450052 2)郑州大学第一附属医院临床检验科 郑州 450052
癫痫是仅次于脑血管病的神经系统常见病,我国癫痫患者超过900万,且每年新增病例(40~70)万,给社会、家庭及患者都带来沉重负担。最近研究[1-2]表明线粒体钙离子稳态在细胞代谢、生存中发挥重要调节作用。线粒体钙离子稳态失衡在癫痫引起的神经元损伤中扮演重要角色[3]。线粒体主要通过其内膜上的线粒体钙离子单向转运体(mitochondrial calcium uniporter, MCU) 对细胞内钙离子进行摄取,MCU在细胞和线粒体钙离子稳态的维持中发挥重要作用[4]。内质网是钙离子储存、调节及蛋白加工的重要场所,各种细胞内外环境的改变如氧化应激状态、钙离子紊乱等,均可导致内质网应激(endoplasmic reticulum stress, ERS)[5]。ERS时通过增加ERS相关蛋白葡萄糖调节蛋白78(glucose regulating protein 78, GRP78)的表达促进蛋白正确折叠、协助错误折叠蛋白转移以恢复内质网功能。但当ERS过于强烈或持久,超过细胞负荷时,就会启动ERS介导的细胞凋亡,引起相关凋亡分子CHOP(C/EBP homologous protein, CHOP)和Caspase-12的表达上调[6-7]。我们前期研究[8]发现MCU在匹鲁卡品诱导的急性颞叶癫痫大鼠海马神经损伤中发挥重要作用。
多项研究[9-10]表明体外培养的原代海马神经元在无镁细胞外液中培养3 h可形成稳定的癫痫样放电,并且恢复正常细胞培养液培养后仍存在自发的癫痫样放电,其为癫痫发病机制的研究提供了理想的模型。在本研究中,我们采用MCU特异性抑制剂Ru360、激动剂精胺(Spermine)以及线粒体靶向抗氧化剂Mito-Q预处理大鼠无镁致痫海马神经元,探讨MCU在癫痫神经元凋亡中的作用及可能的机制。
1 材料与方法
1.1实验动物及主要试剂
1.1.1 实验动物 取新生24 h以内的SPF级SD大鼠100只,由河南省实验动物中心提供,许可证号SCXK(豫)2015-0004。依据郑州大学实验动物伦理委员会要求进行手术操作。
1.1.2 主要试剂 Ru360(美国 Sigma公司),Spermine(美国Millipore公司),Mito-Q(美国MedChemExpress公司),使用时均溶解于无菌生理盐水中。胰蛋白酶、MTT试剂盒(美国 Sigma公司);TUNEL 试剂盒(德国Roche公司);钙离子荧光探针 Rhod-2(美国Life Technologies公司),线粒体MitoSOX 荧光探针(美国Invitrogen公司);青链霉素混合液、L-多聚赖氨酸、RIPA裂解液(北京索来宝科技有限公司);NSE抗体(武汉博士德生物公司),β-actin抗体(武汉三鹰公司),GRP78、CHOP和Caspase-12抗体(美国CST公司);Neurobasal-A培养基、特级胎牛血清、B27、L-谷氨酰胺(美国Gibco公司);DMEM(美国Hyclone公司)。
1.2海马神经元的分离、培养及鉴定将新生24 h内的SD大鼠在乙醇中浸泡消毒1 min左右,在超净工作台上断头取脑,分离取出海马并去除其表面血管膜。将海马转移至培养皿中,加入DMEM及2.5 g/L胰蛋白酶各2 mL,混匀后放入37 ℃细胞培养箱中消化15 min,每5 min摇晃数次。消化结束后将组织转移到15 mL离心管中并加入等体积的种植培养基(以体积分数89%DMEM、10%特级胎牛血清和1%青链霉素混合液构成)终止消化,反复吹打后1 000 r/min离心5 min,弃上清,加入种植培养基,再次离心弃上清,加入适量种植培养基吹打制成细胞悬液。调整细胞密度达3.5×105个/mL,种植到预先用L-多聚赖氨酸包被的培养板中,置于37 ℃、体积分数5% CO2细胞培养箱中培养24 h,然后更换为维持培养基(以体积分数96%Neurobasal-A培养基、2%的B27、1%青链霉素混合液和1%谷氨酰胺构成)继续培养,每2 d半量换液1次。培养至第7 d,NSE免疫荧光染色法鉴定。
1.3Ru360和Spermine对无镁致痫海马神经元凋亡的作用及机制探讨
1.3.1 实验分组及处理 将培养至14 d的海马神经元分为空白对照组、无镁诱导组、Ru360组、Spermine组。空白对照组用正常的含镁细胞外液处理3 h后,用维持培养基继续培养。无镁诱导组用无镁细胞外液处理3 h后,用维持培养基继续培养。Ru360组和Spermine组分别用5 μmol/L的Ru360和10 μmol/L的Spermine处理1 h[11],然后用无镁细胞外液处理3 h[9-10],再用维持培养基继续培养24 h。
1.3.2 神经元活力检测 海马神经元分组处理并维持培养24 h后,每孔加入20 μL MTT溶液,在37 ℃孵育4 h后吸出液体,向每孔加入150 μL的DMSO,在摇床上摇晃15 min后用酶标仪测定吸光度值。以实验组吸光度值/对照孔吸光度值表示神经元存活率。每组设3个复孔,实验重复6次。
1.3.3 神经元凋亡检测 海马神经元分组处理并维持培养24 h后,吸出培养基,多聚甲醛固定30 min,TritonX-100处理5 min,每孔加入50 μL TUNEL反应混合液,阴性对照仅加50 μL荧光素标记的dUTP液,阳性对照加入100 μL DNase 1于37 ℃反应1 h。加入50 μL标记有荧光素抗体的辣根过氧化酶,于37 ℃反应30 min后,加入50~100 μL的DAB底物反应20 min,苏木精复染。在光学显微镜下随机选取5个200倍视野观察,计算阳性细胞(呈深棕色)占总细胞的百分比,即神经元凋亡率。实验重复6次。
1.3.4 神经元线粒体钙离子浓度和ROS生成水平测定 海马神经元分组处理并维持培养24 h后,吸出培养基用HEPES浸洗3次,加11 μmol/L的Rhod-2 孵育15 min,用分光光度计在激发波长575 nm和发射波长605 nm条件下检测荧光强度,以荧光强度代表神经元内线粒体钙离子浓度。分组处理并维持培养24 h后,吸出培养基,每孔加入 5 μmol/L的MitoSOX工作液2 mL,在37 ℃避光孵育15 min,上流式细胞仪检测,以荧光强度表示ROS生成水平。实验重复6次。
1.3.5 神经元中ERS通路相关蛋白表达的检测 海马神经元分组处理并维持培养24 h后,用含蛋白酶抑制剂的裂解缓冲液裂解细胞,提取总蛋白并用BCA法定量。上样25 μg总蛋白,经SDS-PAGE电泳、转膜及封闭后,分别加入GRP78(1∶1 000)、CHOP(1∶500) 、Caspase-12(1∶1 000)和β-actin(1∶3 000)抗体4 ℃孵育过夜。TBST洗5 min×3次,加入二抗室温下孵育1 h,TBST洗5 min×3次。用ECL化学发光试剂显像,用图像系统扫描,并用Image J软件分析,以目的条带与内参条带灰度值的比值表示目的蛋白表达水平。实验重复6次。
1.4Mito-Q对无镁致痫海马神经元线粒体ROS生成和ERS通路相关蛋白表达的影响海马神经元培养14 d后,分为空白对照组、无镁诱导组和Mito-Q组。Mito-Q组预先用500 nmol/L的Mito-Q处理1 h[12-13],然后用无镁细胞外液处理3 h;其他两组处理方法同1.3.1。分组处理并维持培养24 h后,检测神经元中GRP78、CHOP、Caspase-12蛋白的表达及线粒体ROS生成水平,方法同前。实验重复6次。
1.5统计学处理用SPSS 21.0进行统计分析,多组间上述各指标的比较采用单因素方差分析,组间两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1原代海马神经元的鉴定原代海马神经元分离后培养至第7天,NSE免疫荧光染色后在荧光显微镜下可观察到呈红色荧光的胞质和树突,呈蓝色荧光的胞核(图1),神经元纯度达95%以上。
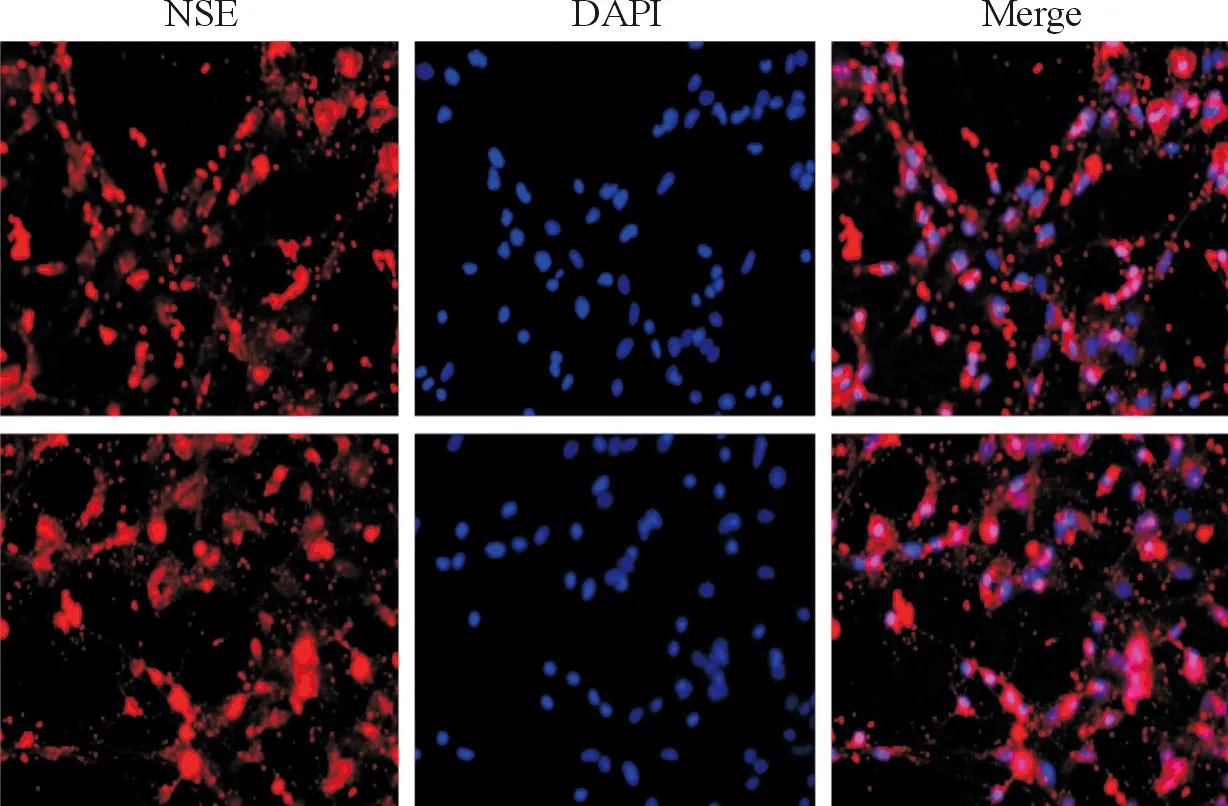
图1 原代海马神经元的鉴定
2.2对照组、无镁诱导组、Ru360组、Spermine组神经元存活率、凋亡率的比较见图2和表1。与空白对照组相比较,无镁诱导组海马神经元存活率降低,凋亡率增加(P<0.05)。与无镁诱导组比较,Ru360组神经元存活率增加,凋亡率降低;而Spermine组海马神经元存活率降低,凋亡率增加(P<0.05)。

A:空白对照组;B:无镁诱导组;C:Ru360组;D:Spermine组
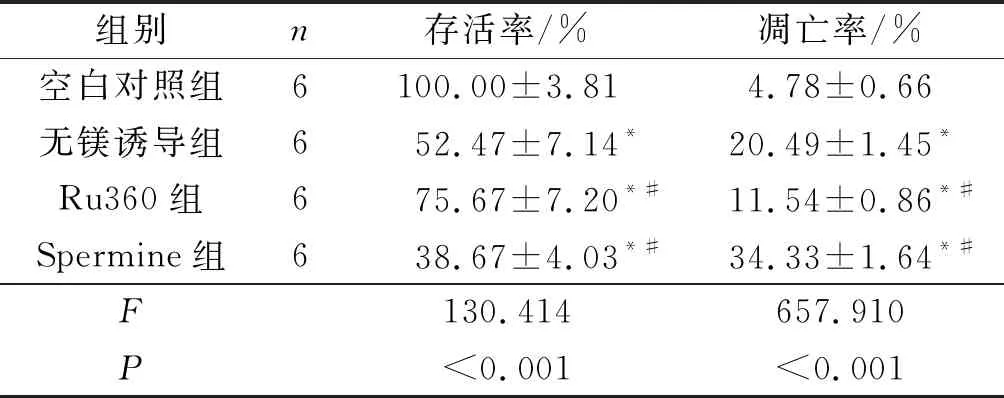
表1 4组海马神经元存活率和凋亡率的比较
2.3对照组、无镁诱导组、Ru360组、Spermine组线粒体钙离子浓度和ROS生成水平的比较如表2所示,与空白对照组相比,无镁诱导组海马神经元线粒体钙离子浓度和ROS生成水平增加(P<0.05)。与无镁诱导组相比,Ru360组线粒体钙离子浓度和ROS生成水平降低,而Spermine组均升高(P<0.05)。
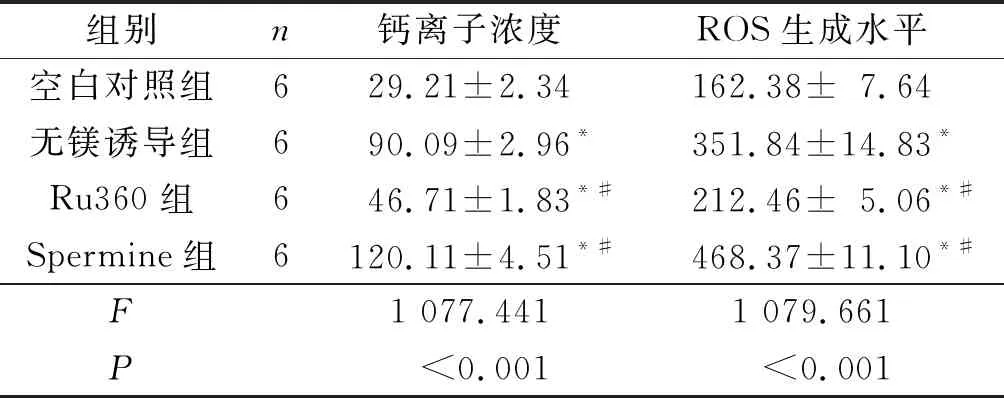
表2 4组线粒体钙离子浓度和ROS生成水平的比较
2.4对照组、无镁诱导组、Ru360组、Spermine组ERS通路相关蛋白表达的比较如图3、表3所示,与空白对照组相比,无镁诱导组海马神经元GRP78、CHOP和Caspase-12表达水平增加(P<0.05)。与无镁诱导组相比,Ru360组GRP78、CHOP和Caspase-12表达水平降低,而Spermine组表达水平升高(P<0.05)。
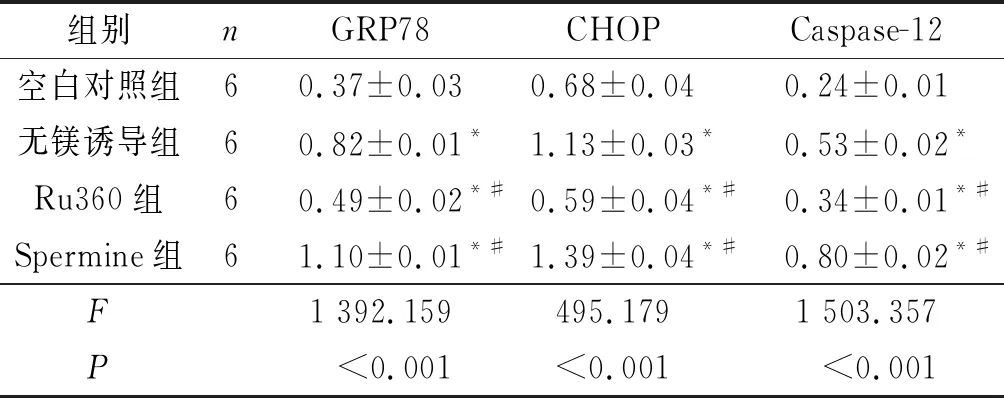
表3 4组海马神经元中ERS通路相关蛋白表达水平的比较
2.5对照组、无镁诱导组和Mito-Q组线粒体ROS生成水平和ERS通路相关蛋白表达的比较如图4和表4所示,与无镁诱导组相比,Mito-Q组线粒体ROS生成水平及GRP78、CHOP和Caspase-12表达水平降低(P<0.05)。

表4 3组ERS通路相关蛋白的表达和线粒体ROS生成水平的比较
3 讨论
近年来研究[14]表明钙离子稳态失衡与癫痫的发生发展关系密切。癫痫发作可使过多的钙离子进入细胞内,导致细胞内钙超载,而线粒体可通过摄取细胞内过多的钙离子从而降低细胞内的钙离子浓度,以发挥代偿作用。但线粒体钙超载又可导致ROS过度生成、线粒体通透性增加、跨膜电位下降、细胞色素C释放等,从而导致细胞凋亡和坏死[15-16]。本研究发现,体外无镁致癫大鼠海马神经元中线粒体钙离子浓度、ROS生成量及神经元凋亡明显增加;MCU抑制剂Ru360可明显减轻模型细胞线粒体钙超载及ROS生成水平,降低神经元凋亡率,而MCU激动剂Spermine的作用与Ru360相反。以往研究[17]发现Spermine可以增加缺血再灌注诱导的氧化应激,这与本研究结果一致。但是最近研究发现Spermine抑制Pb2+诱导的ROS产生,而Ru360则发挥相反作用。虽然MCU对氧化应激的影响有待进一步研究,但相关研究均表明MCU在氧化应激反应中发挥重要作用。
癫痫可引起内质网功能失衡,使内质网中未折叠和错误折叠的蛋白大量累积,发生ERS[18]。ERS时,GRP78蛋白表达上调以恢复内质网稳态,然而当ERS过于强烈或持久,细胞就会启动CHOP和Caspase-12通路介导的细胞凋亡[19]。CHOP通过下调Bcl-2、上调Bax的表达诱导细胞凋亡,而Caspase-12则通过活化Caspase-9、Caspase-3促进细胞凋亡[20-21]。以往研究表明线粒体-内质网相互串话和相互作用在凋亡调控过程中发挥重要作用。本研究发现无镁致癫大鼠海马神经元中GRP78、CHOP及Caspase-12表达均增加,提示癫痫激活了海马神经元的ERS;Ru360可显著抑制模型神经元中GRP78、CHOP及Caspase-12的表达,而Spermine则增加了GRP78、CHOP及Caspase-12的表达;表明MCU 调控的ERS在癫痫诱导的海马神经元凋亡中发挥重要作用。
研究[22]表明线粒体氧化应激和ERS密切相关。线粒体是内源性自由基的主要来源,线粒体钙超载可引起线粒体ROS过度产生,而ROS又会导致ERS[23-24]。本研究发现线粒体靶向抗氧化剂Mito-Q预处理可明显降低无镁致癫大鼠海马神经元线粒体ROS生成水平,降低GRP78、CHOP和Caspase-12的表达,说明线粒体氧化应激在癫痫诱导的ERS中发挥重要调节作用。
综上所述,我们发现抑制MCU可以减轻癫痫诱导的海马神经元凋亡,而激动MCU则促进癫痫诱导的海马神经元凋亡,其潜在机制可能与调控线粒体氧化应激介导的ERS有关。因此,选择性地调控MCU可能是癫痫治疗的新思路。

1: 空白对照组; 2: 无镁诱导组; 3: Ru360组; 4: Spermine组

1: 空白对照组; 2: 无镁诱导组; 3: Mito-Q组
