铅门跟随与固定技术结合有无均整器模式的鼻咽癌IMRT剂量学比较
2020-08-04黄霞苏坤普罗焕丽靳富王颖
黄霞,苏坤普,罗焕丽,靳富,王颖
1.重庆大学附属肿瘤医院/重庆市肿瘤研究所/重庆市肿瘤医院,重庆400030;2.陆军特色医学中心,重庆400010
前言
鼻咽癌是一种鼻咽上皮组织肿瘤,放疗是其重要的治疗手段,而调强放疗(Intensity‐Modulated Radiotherapy, IMRT)因其剂量学优势而被广泛应用于鼻咽癌治疗。在满足靶区剂量要求的情况下应尽可能地保护邻近的危及器官和正常组织,减小远期放疗并发症的发生率,提高病人放疗后的生存质量[1‐3]。常规动态IMRT技术在铅门固定的情况下,通过多叶准直器(Multi‐Leaf Collimator, MLC)的运动实现野内的剂量调节。美国Ⅴarian 公司的Edge 加速器具有铅门跟随功能,铅门跟随技术是指在MLC 运动的同时,X、Y 方向铅门根据子野大小自动调整照射范围,可以减少叶片的透射和漏射[4‐7]。同时,Edge的非均整器(Flattening Filter Free, FFF)模式移除加速器射野均整器,射线质变软、散射减小、剂量率增加,其射野的剂量分布与常规均整器模式有较大差别[8‐9]。有研究表明,IMRT采用铅门跟随和铅门固定两种技术,靶区和危及器官受量均能满足临床治疗要求,而铅门跟随技术能更好地降低正常组织和危及器官的剂量照射[10‐11];鼻咽癌患者采用6 MⅤX 射线FFF 模式和有均整器(Flattening Filter,FF)模式计划均能满足临床治疗要求,且FFF计划更有利于保护射野边缘危及器官[12‐13]。本研究基于鼻咽癌IMRT技术,研究铅门跟随与铅门固定技术结合有无均整器这4 种模式在靶区覆盖和危及器官保护方面的剂量学特点,为临床选择不同治疗技术提供指导和参考。
1 资料与方法
1.1 一般临床资料
随机选择2019年重庆市肿瘤医院收治的10例早期鼻咽癌患者。其中,男6例,女4例;年龄30~64岁,中位年龄47 岁;2例T1N2M0,2例T2N1M0,2例T2N2M0,4例T2N3M0。
1.2 治疗计划
1.2.1 定位图像采集所有患者均取仰卧位,使用头颈肩模固定,采用放疗专用大孔径螺旋CT(Brilliance‐16, Philips Medical Systems Inc.,Cleveland,Ohio)进行3 mm 层厚的扫描。CT 图像经过DICOM传输至Eclipse 13.6治疗计划系统。
1.2.2 治疗计划制定由经验丰富的放疗医生确定鼻咽癌原发灶和颈部转移淋巴结的肿瘤计划靶区PGTⅤ,原发灶周围可能受侵的高危区域为计划靶区PTⅤ1,原发灶周围可能受侵及中下颈淋巴结引流区的低危区域为计划靶区PTⅤ2。靶区的处方剂量为PGTⅤ:70.4 Gy/32次,PTⅤ1:60.8 Gy/32次,PTⅤ2:54.4 Gy/32次。危及器官参考ICRU 83号报告定义和勾画,其限制剂量参考常规照射正常组织耐受剂量[14]。采用Ⅴarian Eclipse 13.6治疗计划系统和Edge加速器6 MⅤX射线模式分别制定铅门跟随FFF模式(Jaw Tracking Technique with FFF mode, JTT‐FFF)、铅门跟随FF 模式(Jaw Tracking Technique with FF mode,JTT‐FF)、铅门固定FFF模式(Static Jaw Technique with FFF mode,SJT‐FFF)、铅门固定FF模式(Static Jaw Technique with FF mode,SJT‐FF)这4种治疗计划,机架角度为200°、240°、280°、320°、0°、40°、80°、120°、160°。4组计划设置相同的优化目标和约束条件,要求处方剂量至少包绕95%的靶区体积,处方剂量的110%所包绕的体积不得超过靶区体积的1%。优化过程中,FFF模式默认剂量率上限为1200MU/min,FF 模式默认剂量率上限为600 MU/min。采用各向异性解析算法(Analytical Anisotropic Algorithm,AAA)进行剂量计算,选择Smart LMC(Leaf Motion Calculator)计算叶片运动方式,选取是否勾选Jaw tracking确定是否选择铅门跟随模式。采用95%以上的靶区达到处方剂量对计划进行剂量归一。
1.3 计划比较评估
比较4 组计划的剂量‐体积直方图(Dose‐Ⅴolume Histogram, DⅤH)和等剂量分布,采用适形度指数(Conformity Index, CI)和均匀性指数(HomogeneityIndex,HI)评估靶区的剂量分布。参考文献[15]的评估公式:CI=(ⅤT,ref/ⅤT)×(ⅤT,ref/Ⅴref),其中,ⅤT,ref为参考等剂量所包绕的靶区体积,Ⅴref为参考等剂量所包绕的体积,ⅤT为靶区体积,这里参考等剂量取处方剂量。参考ICRU 83 号报告定义HI=(D2‐D98)/D50,D2为2%靶区体积对应高剂量,D50表示50%的靶区体积受到的照射剂量,D98为98%体积对应低剂量。CI值为0~1,越接近1,表明靶区处方剂量线的适形度越好;HI越低,靶区均匀性越好,HI为0 是最佳理想情况。采用最大剂量评估脑干、垂体、脊髓、晶体、视神经、视交叉;采用平均剂量评估腮腺、眼球、颞叶、下颌骨、喉、口腔、内耳、Body。
1.4 统计学分析
采用SPSS 19 统计学软件进行数据处理,计量资料用均数±标准差表示,采用配对t检验进行分析,P<0.05 为差异有统计学意义。
2 结果
2.1 靶区剂量分布
对于所选取的10例病例,4组计划的靶区剂量分布均能满足临床使用要求。PGTⅤ、PTⅤ1 和PTⅤ2 的CI比较,差异无统计学意义(P>0.05);SJT‐FF 计划中PGTⅤ、PTⅤ1 和PTⅤ2 的HI最好,相对于SJT‐FFF 计划差异无统计学意义(P>0.05),但相对于JTT 计划差异有统计学意义(P<0.05)。结果见表1。
2.2 危及器官和正常组织剂量分布
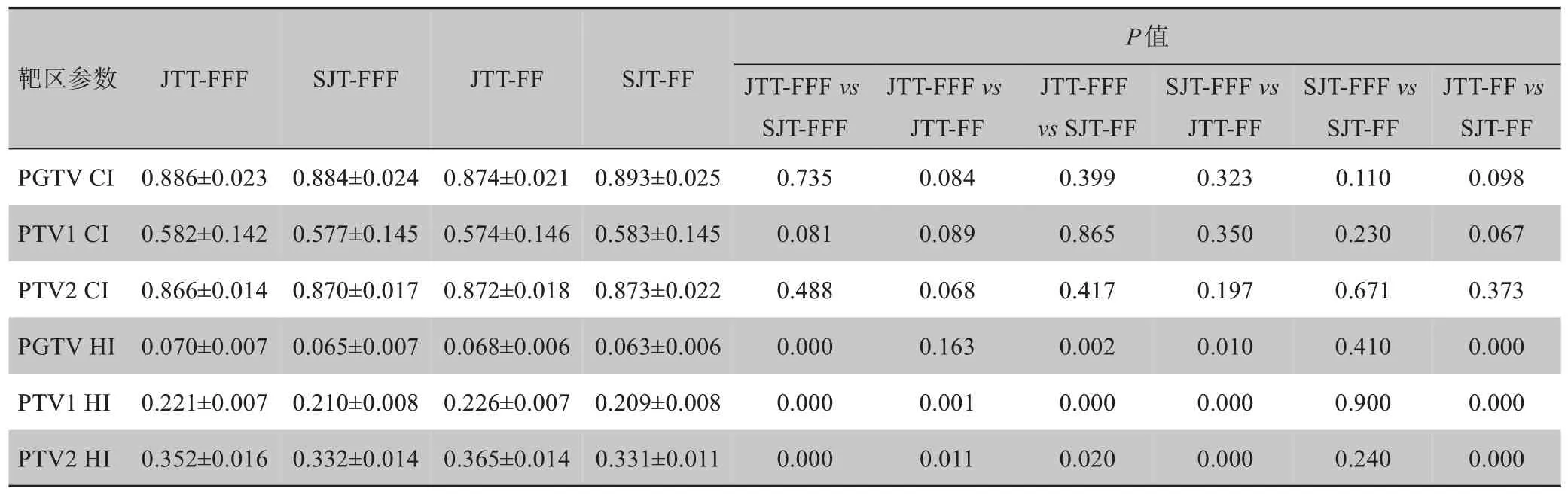
表1 4组计划的靶区剂量比较结果Tab.1 Comparison of dosimetric parameters of target areas in 4 plans
4 组计划的危及器官和正常组织剂量分布均达到了临床基本要求。在JTT‐FFF 计划中,晶体的最大剂量、眼球、口腔、颞叶、下颌骨和Body 的平均剂量最低但机器跳数最多,其中,晶体的最大剂量和机器跳数相对于其他3 组计划,差异有统计学意义(P<0.05),眼球、口腔、颞叶、下颌骨和Body的平均剂量相对于SJT 计划差异有统计学意义(P<0.05),但相对于JTT‐FF 计划差异无统计学意义(P>0.05)。在JTT‐FF 计划中,脑干、垂体、交叉、视神经、脊髓的最大剂量和腮腺、喉、内耳的平均剂量最低,其中脑干和垂体的最大剂量相对于其他3 组计划差异有统计学意义(P<0.05),交叉、视神经、脊髓的最大剂量和腮腺、喉、内耳的平均剂量相对于SJT 计划差异有统计学意义(P<0.05),但相对于JTT‐FFF 计划计划差异无统计学意义(P>0.05)。结果见表2和表3。
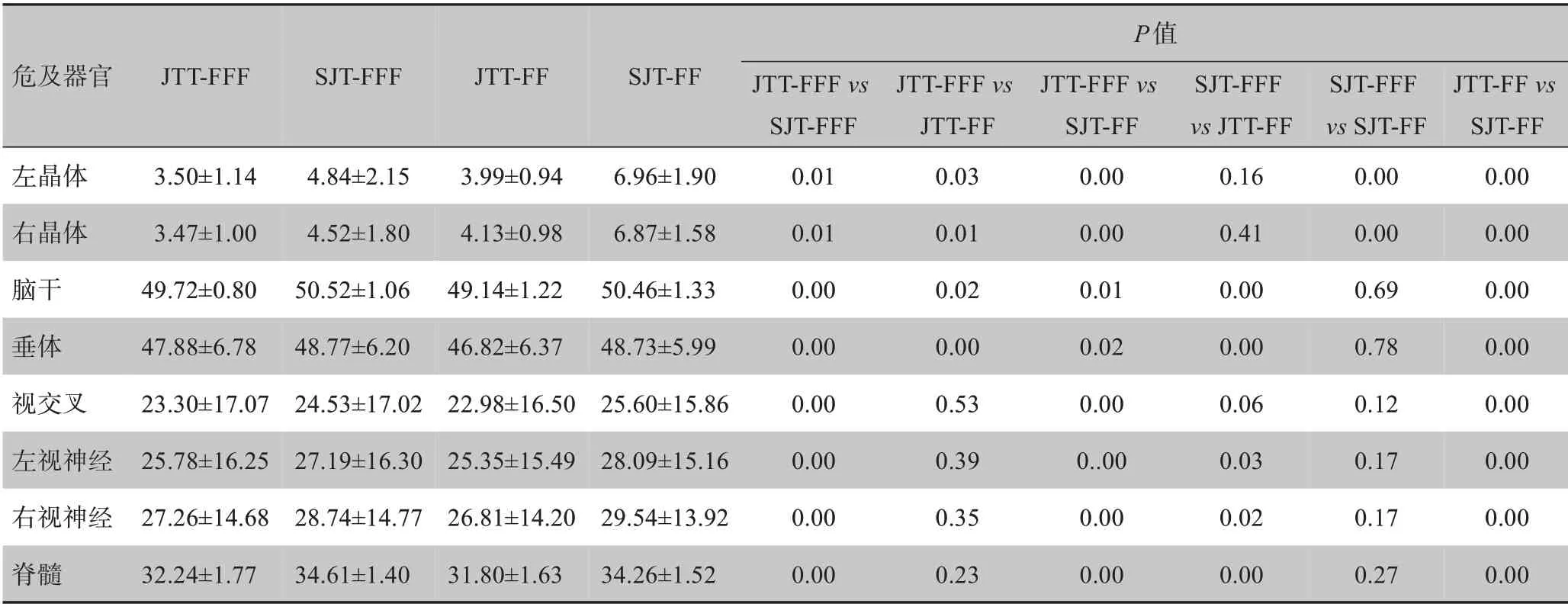
表2 4组计划危及器官的Dmax比较结果(Gy)Tab.2 Comparison of the maximum dose to organs-at-risk in 4 plans(Gy)
3 讨论与结论
常规动态IMRT中多采用固定铅门,MLC以不同的速度连续运动的方式实现射野内的剂量调节。由于鼻咽癌靶区形状不规则且体积大,常规动态IMRT中铅门开放位置相对较大,MLC 的漏射和透射会对靶区和危及器官的剂量产生较大的影响。Losasso等[16]研究发现MLC的漏射和透射会随着射野增大而增加;而Cadman 等[17]研究发现在铅门和MLC 同时对射线进行遮挡的情况下,射线的漏射和透射小于0.1%。在直线加速器中使用均整器是为了在模体的特定深度处产生均匀分布的剂量,从而方便计算。随着调强技术的发展,均整器的应用限制了加速器的输出剂量[18],而现有的调强技术只需要MLC 的运动即可产生所需的剂量分布[19‐20]。FFF 模式在加速器的射束路径上移除均整器,从而表现出离轴剂量不均匀、平均能量降低、机头的散射减小、射野半影锐利、周围剂量减小的特点。
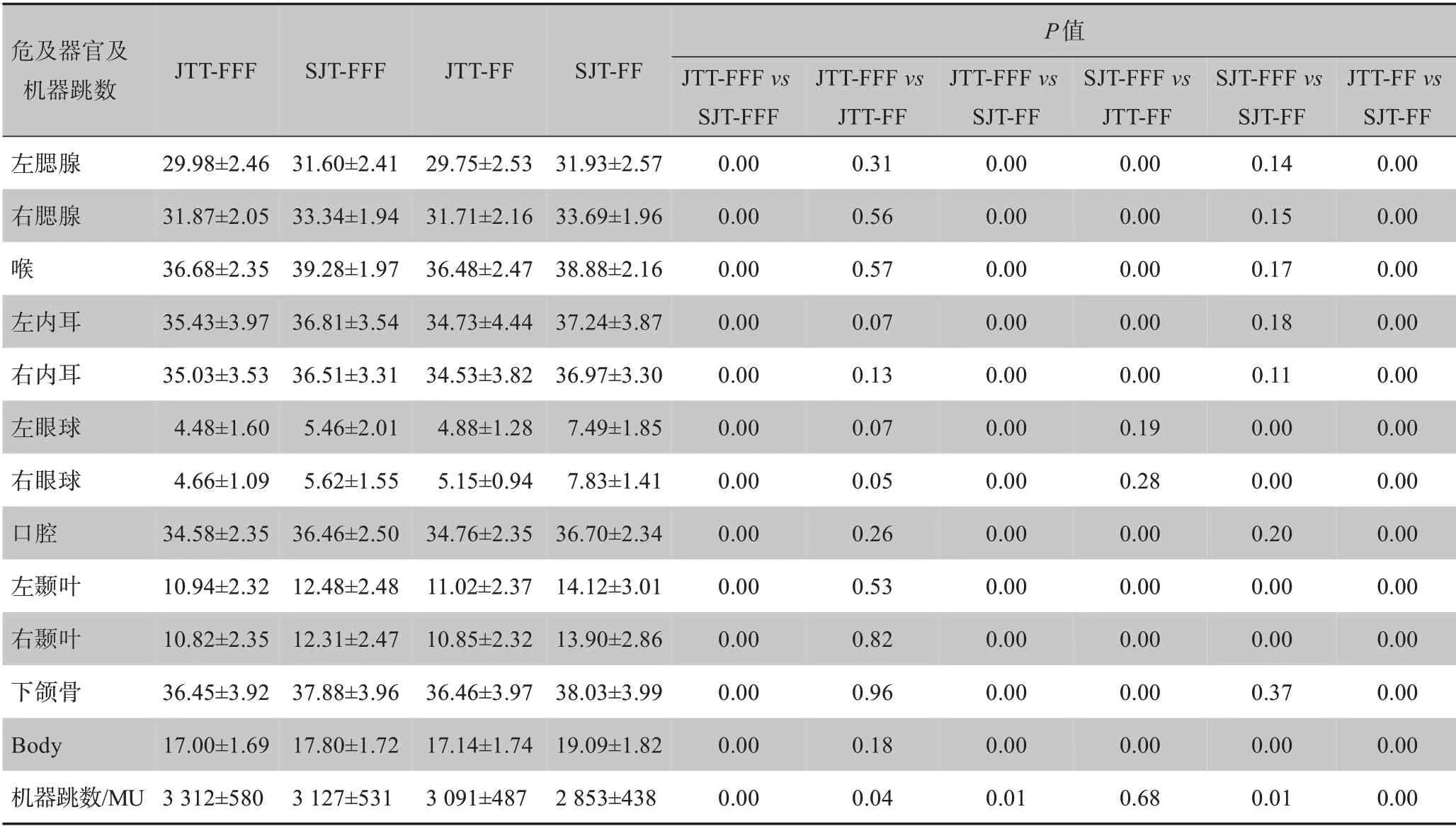
表3 4组计划危及器官的Dmean剂量(Gy)比较和MU比较Tab.3 Comparison of the mean dose(Gy)to organs-at-risk and monitor units in 4 plans
对比本研究的4组计划,发现靶区的适形度无明显差异,而SJT 计划的均匀性指数明显优于JTT 计划。交叉、视神经、脊髓的最大剂量和眼球、口腔、颞叶、下颌骨、腮腺、喉、内耳、Body 的平均剂量在JTT‐FFF 和JTT‐FF 计划中无明显差异,但均明显低于SJT计划。在冯仲苏等[21]研究中也发现在直肠癌术前放疗计划设计中,铅门跟随技术能够更好地降低危及器官和正常组织的受照剂量,从而降低正常组织并发症的概率,而在贾飞等[22]研究中发现脊髓、视神经、腮腺和整个治疗区域的受照剂量在鼻咽癌ⅤMAT‐FFF 和ⅤMAT‐FF 计划中无明显差异。因而在鼻咽癌IMRT 计划设计中,为了使得这些组织器官的受照剂量更低,只需要选择使用铅门跟随技术,而FFF模式或FF模式不会对结果造成明显影响。
JTT‐FFF 计划的左右晶体的最大剂量低于JTT‐FF 计划,考虑原因是本研究采用早期鼻咽癌,晶体位置到靶区距离较远,FFF 离轴剂量跌落快,且FFF 模式下的射线软化因而MLC 的透射因子减小造成的[23]。若计划设计中晶体的受照剂量是考虑的重点,可以采用JTT‐FFF模式制作计划。在贾飞等[22]研究中发现鼻咽癌ⅤMAT‐FFF 计划中脑干受照剂量比ⅤMAT‐FF 高,但却不具备实际意义,与本研究中SJT‐FFF 与SJT‐FF 计划对比结果一致;而JTT‐FF 计划的脑干和垂体的最大剂量明显低于JTT‐FFF 计划,考虑原因是FFF模式射线本身剂量分布不均匀,并且结合铅门跟随技术对靶区均匀性的影响,为保证靶区的处方剂量包绕,需要更多的机器跳数,而脑干和垂体距离靶区较近导致剂量增加。
铅门跟随降低了叶片的透射和漏射,并且FFF模式移除了均整器导致射线剂量分布的变化,都会导致机器跳数增加,因而JTT‐FFF 计划机器跳数最多;由于是常规分次剂量照射,FFF模式的高剂量率优势并没有发挥出来。Fu 等[24]研究也发现当单次治疗剂量为2 Gy 时,FFF 和FF 模式在治疗时间上无明显差异。本研究选择的鼻咽癌治疗射野大且部位单一,JTT‐FFF、JTT‐FF、SJT‐FFF、SJT‐FF 这4 种技术对其他部位和不同体积靶区的剂量学影响还需进一步研究。
