机器学习在肺癌ⅤMAT计划中对危及器官剂量预测的可行性
2020-08-04闫凤牛振洋费振乐吴先想崔相利刘苓苓
闫凤,牛振洋,费振乐,吴先想,崔相利,刘苓苓
1.联勤保障部队第901医院放疗科,安徽合肥230031;2.蚌埠医学院第一附属医院放疗科,安徽蚌埠233004;3.中国科学院合肥肿瘤医院,安徽合肥230031
前言
容积旋转调强(ⅤMAT)技术具有靶区外剂量快速跌落、靶区的剂量适形度高、剂量均匀性好等特性。相对于IMRT,ⅤMAT 具有缩短治疗时间和总MU较低的特点,在临床中被大量使用[1‐3]。计划设计过程中,物理师一般根据RTOG 指南、临床数据或自身经验去设定优化目标,但由于不同病人的解剖结构差异,计划目标会出现很容易实现或者很难实现的情况[4]。危及器官(OAR)剂量学参数和OAR 与靶区空间位置以及两者的体积等解剖信息具有相关性[5‐6]。Jun 等[7]构建Lian 空间解剖信息与剂量学指数的数学模型可以对腮腺、喉、脊髓、脑干及下颌下腺的剂量学指数做出准确预测。Appenzoller 等[8]构建OAR空间解剖信息与剂量学指数的数学模型可以对直肠、膀胱及腮腺的剂量学指数做出准确预测。本次研究主要分析患侧肺、对侧肺及心脏的剂量学参数和解剖信息的相关性,建立以患者解剖信息为输入、OAR 的剂量学参数为输出的机器学习人工神经网络模型[9‐11]。
1 材料与方法
1.1 病例选择
选取2017年5月至2018年3月接受放疗的51例肺癌病例,其中,男27例,女24例;年龄40~72 岁,平均年龄51岁。由细胞学或组织学证实为非小细胞肺癌,且全部未进行手术,其中左肺癌23例,右肺癌28例。
1.2 靶区及OAR勾画
患者均采用仰卧位、热塑体模固定。CT 模拟定位时体位选择为双手举过头顶,扫描范围从颈部到肝脏下缘,图像层厚为5 mm。勾画肺门病灶为GTⅤ,局部转移淋巴结为GTⅤnd,同侧肺门及纵隔与淋巴引流区为CTⅤ,外扩0.5~1.0 cm 获得PTⅤ(外扩范围和是否选用4D‐CT、CBCT、千伏影像验证片等影像引导技术有关)。勾画肺、心脏、脊髓、肝脏等OAR,其中患侧肺、对侧肺和心脏的平均体积分别为1 674.32、1 830.42、711.96 cm3,PTⅤ的平均体积为193.67 cm3。
1.3 治疗计划设计
采用Monaco(Ⅴersion 5.11)计划系统设计ⅤMAT计划,采用6 MⅤX 线,射野由前后共面双弧构成,为降低肺部受照射的低剂量体积,根据肿瘤的空间位置,选择合适的弧度大小及起始角度。PTⅤ的处方剂量为60 Gy,分次数为30,要求处方剂量覆盖95%的靶区体积。
1.4 空间解剖信息描述
根据已有的相关研究,OAR 的剂量学指数主要受体积和空间位置两种解剖信息影响[6‐7]。本研究中体积信息包括患侧肺、对侧肺、心脏和PTⅤ的体积(肿瘤位置偏向的一侧所在的肺部定义为患侧肺,相对一侧的肺定义为对侧肺);使用OAR 和PTⅤ的空间相对位置关系表示空间位置信息。肺癌患者的患侧肺和靶区空间相对位置较为稳定,和对侧肺和心脏的空间相对位置稳定性一般,且ⅤMAT 治疗计划中靶区剂量具有良好的适形性,靶区外剂量快速跌落。因此,OAR 的DⅤH 与OAR 到PTⅤ的表面距离有关。本研究采用R(d) 来描述OAR 与PTⅤ的相对空间位置信息。R(d) 的表达公式为:

其中,VPTⅤ‐d为PTⅤ外扩距离为d时所包含的体积(考虑到射束半影对靶区边缘GT 方向上的影响,所以在0~0.6 cm 内为各向均匀外扩,外扩步进为0.3 cm;0.6~15.0 cm 内为身体前后左右方向均匀外扩,外扩步进为0.3、0.5、0.7、0.9、1.1、1.3、1.5、1.7、2.1、2.7 cm,以最少的外扩来描述OAR 的空间解剖信息,同时符合靶区外剂量跌落规律);VOAR为OAR 自身的体积;R(d)为VPTⅤ‐d与VOAR相交的体积和VOAR的比值。
1.5 人工神经网络构建和DⅤH预测
将51例肺癌患者的解剖信息数据和OAR 剂量学数据(Ⅴ2.5、Ⅴ5、Ⅴ7.5…、Ⅴ57.5、Ⅴ60)导入Matlab 2017a中已经编写好的机器学习人工神经网络程序,流程如图1所示,随机选择其中43例病人的解剖信息数据和OAR 的DⅤH 数据作为训练集用于训练人工神经网络,剩下8例病人作为验证集用于验证人工神经网络输出的准确性。人工神经网络训练过程中采用N次k 折交叉验证方法[12]。其中每个人工神经网络中包含输入层(Input layer)、隐藏层(Hidden layer)、输出层(Output layer)[13]。
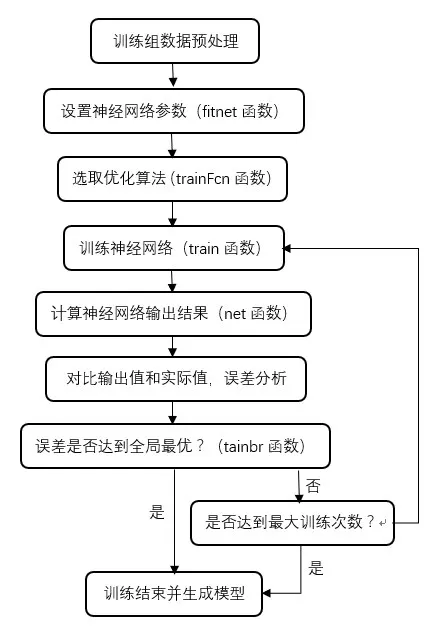
图1 训练人工神经网络程序流程图Fig.1 Flowchart of artificial neural network training
1.6 统计学方法
采用SPSS 19.0软件中Pearson法对训练组中患侧肺和对侧肺的Ⅴ5、Ⅴ20指数及心脏的Ⅴ30、Ⅴ40指数与自身体积、PTⅤ体积大小以及R(d)指数进行相关性分析[14],r>0.6为强相关,r=0.4~0.6为中度相关,r<0.4为弱相关,r<0为负相关。将人工神经网络的预测值和实际值做配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 人工神经网络模型结构
优化调整后,生成3 种人工神经网络结构模型,其中构建的患侧肺、对侧肺、心脏的人工神经网络结构模型中隐藏层分别含有41、38、34 个神经结点(neural node)。
2.2 训练组中OAR的R(d)关系曲线
在距PTⅤ表面一定范围内,训练组中R(d)值随着外扩距离d的增加逐渐增大,达到一定距离后,R(d)值将趋于稳定,如图2所示。
2.3 训练组中OAR剂量学指数与自身体积的相关性
OAR 的剂量学指数均在较大范围内波动。患侧肺、对侧肺、心脏的剂量学指数和自身体积的r值在‐0.13~0.15内,呈现为弱相关性,如表1所示。

图2 OAR的R(d)关系曲线Fig.2 R(d)relationship curve of organs-at-risk(OAR)
表1 训练组中OAR的剂量学指数与自身体积相关性(±s)Tab.1 Relationship between dosimetric indexes and the corresponding OAR volume in training group(Mean±SD)
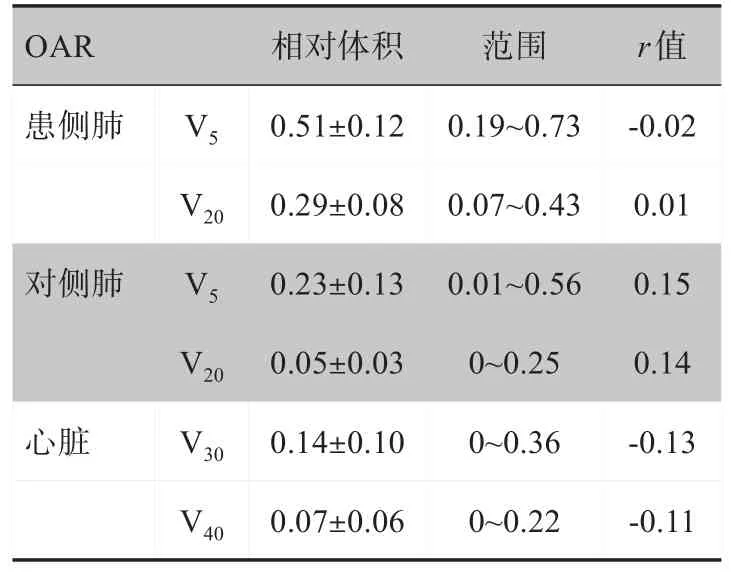
表1 训练组中OAR的剂量学指数与自身体积相关性(±s)Tab.1 Relationship between dosimetric indexes and the corresponding OAR volume in training group(Mean±SD)
OAR患侧肺Ⅴ5Ⅴ20对侧肺Ⅴ5Ⅴ20心脏Ⅴ30Ⅴ40相对体积0.51±0.12 0.29±0.08 0.23±0.13 0.05±0.03 0.14±0.10 0.07±0.06范围0.19~0.73 0.07~0.43 0.01~0.56 0~0.25 0~0.36 0~0.22 r值‐0.02 0.01 0.15 0.14‐0.13‐0.11
2.4 训练组中OAR 剂量学指数与PTⅤ体积、部分R(d)的相关性
训练组中只有对侧肺Ⅴ20与PTⅤ体积呈现为中度相关性(r=0.44),其它OAR 剂量学指数与PTⅤ体积皆呈弱相关。患侧肺Ⅴ5与PTⅤ的R(0.9)表现为弱相关性(r=0.3),剩下的OAR 剂量学指数和R(d) 多数表现为强相关性,部分表现为中度相关性,如表2所示。
2.5 人工神经网络模型在训练集中对输出结果的线性回归分析
图3a 是关于患侧肺的输出结果,线性回归性较好,输出沿着回归直线(R=0.994)分布;图3b 是关于对侧肺的输出结果,输出分布较为散乱,部分输出沿回归直线(R=0.975)分布,整体线性回归性较差;图3c 是关于心脏的输出结果,输出的剂量指数Vx在0~40%内线性回归表现较好,40%~100%内,输出回归性一般,整体输出沿着回归直线(R=0.986)分布,部分输出远离回归直线。

表2 训练组中OAR剂量学指数与PTV体积、部分R(d)相关性Tab.2 Correlation between OAR dosimetry indexes and PTV volume and partial R(d)in training group
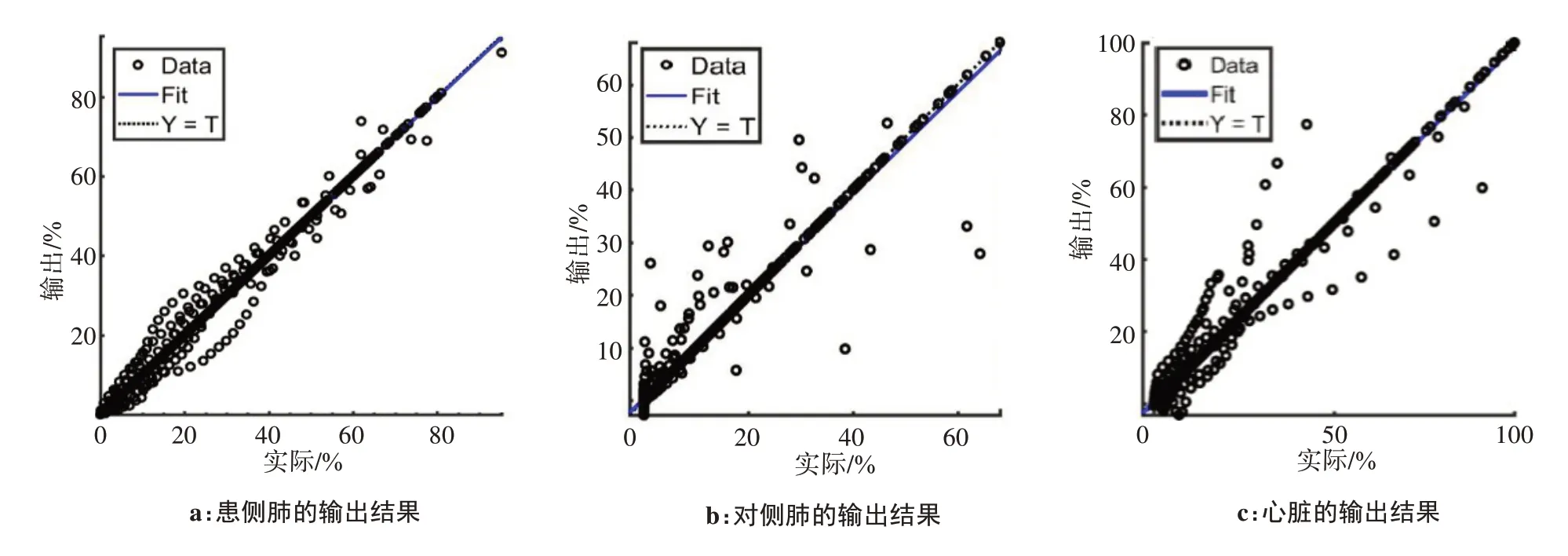
图3 人工神经网络输出结果线性回归分析Fig.3 Linear regression analysis on the output of artificial neural network
2.6 人工神经网络模型输出结果的验证
对患侧肺预测的DⅤH数据与TPS数据表现为较好的重合性;对侧肺的DⅤH 数据与TPS 数据整体重合性较差(未予以作图);心脏的DⅤH 数据与TPS 数据在Ⅴ25~60范围内重合性较好,在心脏Ⅴ0~25范围内表现不太稳定,如图4所示。对验证组中OAR 的预测数据中,仅对侧肺Ⅴ5的预测值和实际值差异有统计学意义。其中患侧肺Ⅴ5、Ⅴ20的预测误差分别为2.70%±1.83%、2.84%±1.97%,对侧肺Ⅴ5、Ⅴ20的预测误差分别为 13.7%±7.8% (t=‐3.93,P<0.05) 、0.72%±0.75%,心脏的Ⅴ30、Ⅴ40的预测误差分别为3.20%±0.63%、2.1%±1.5%。
3 讨论
临床中,DⅤH 主要为计划优化中约束函数调整和计划评估提供参考,以及用于预测患者在放射治疗后可能出现的并发症。虽然Njeh 等[15]认为DⅤH缺乏对剂量的空间信息表达,用于靶区和OAR 的评估具有局限性,但在剂量评估中仍具有指导意义。治疗计划设计时,物理师首先根据自身经验对DⅤH参数做出估计,然后不断调整靶区和OAR 的限制参数,此过程费时费力,因此对OAR 的DⅤH 受影响因素的定量分析及其预测是有必要的。医师将靶区和OAR 勾画完成之后,基于该方法可以对患者OAR 剂量学数据做出大概预测,方便医师及时对靶区进行调整和修改治疗方案,缩短治疗方案设计周期。
目前已经有关于患者解剖信息与OAR的剂量学指数之间相关性的研究[16‐17]。Zhu 等[18]采用靶区距离直方图(DTH)指数描述靶区和OAR的相对空间解剖信息,构建基于Ɛ-SVR 算法的数学模型预测膀胱和直肠的DⅤH,但需多次调节误差Ɛ。本研究引入R(d)指数量化描述OAR 与靶区相对空间位置信息,与DTH 具有相似的属性。R(d)指数相对于DTH 指数容易获取,与靶区表面距离呈现出简单的非线性关系,仅需少量的R(d)信息就可以较好地描述OAR与靶区的空间位置信息。

图4 验证组中8例肺癌患者实际的DVH数据和预测的DVH数据对比Fig.4 Comparison of actual DVH data and predicted DVH data of 8 lung cancer patients in validation group
本研究相关性分析表明,双侧肺和心脏的剂量学指数受自身体积影响较小,负相关说明OAR 的剂量指数随着自身体积增大而减小。患侧肺Ⅴ5、Ⅴ20和R(0.9)、R(2.1)呈现为弱相关,主要原因是在距离靶区表面2.1 cm 范围内,该区域的剂量一般在40 Gy 以上,所以该区域内靶区和OAR 的相对空间位置关系对患侧肺的Ⅴ5、Ⅴ20影响有限。但在距离靶区表面4.1~6.9 cm 和4.1~10.7 cm 内的R(d)值分别和患侧肺的Ⅴ20、Ⅴ5有很强的相关性,原因在于距离靶区表面4.1~10.7 cm 内,剂量已经分别跌落至20 Gy 以下,所以在该距离范围内的R(d)值表现为对患侧肺的Ⅴ5、Ⅴ20影响很大,因此构建出的关于患侧肺的人工神经网络模型的输出结果较为准确,并且性能较为稳定。由于为了保护对侧肺,射束入射方向仅有部分穿过对侧肺,因此对侧肺受照射量较小,DⅤH 数据对射野方向较敏感,导致相同解剖结构可能对应不同的DⅤH 数据,使得人工神经网络输出误差增大。在对侧肺中Ⅴ5与表2所示的距离范围内的R(d)值一直表现为中度相关,在该范围内Ⅴ20与R(d)值一直表现为强相关,说明患侧肺与PTⅤ的相对空间位置对对侧肺的Ⅴ5影响一般,对Ⅴ20影响较为显著,又因为对侧肺受照射的剂量较低,对侧肺的Ⅴ20在0~25%范围内且其平均值为5%,这就导致了在低剂量区域内构建的关于对侧肺的人工神经网络模型稳定性较差,很难根据解剖信息准确地预测出DⅤH 数据,只能对部分剂量指数做出准确预测,如Ⅴ20,回归分析结果显示的Vx处于0~10%内网络模型线性回归性较好。在距离靶区表面0.9~4.1 cm 内,心脏Ⅴ30、Ⅴ40和R(d) 值呈现为强相关性,说明该区域内解剖信息对心脏Ⅴ30、Ⅴ40影响较大,所以构建的关于心脏的人工神经网络可以对心脏DⅤH 的高量区进行准确预测,这和对关于心脏的人工神经网络模型输出的线性回归分析的结果相一致。
综上所述,利用机器学习方法对肺癌ⅤMAT 计划中解剖信息和OAR 的DⅤH 数据学习后,可以根据肺癌患者的解剖信息对OAR 的DⅤH 做出较为准确的预测,可以为肺癌治疗计划的设计和评估提供参考,提高计划设计效率,具有一定的临床应用价值。
