低强度脉冲电磁场加速2型糖尿病表皮软组织创伤愈合实验
2020-08-04霍博丁元钧蔡婧张美霞
霍博,丁元钧,蔡婧,张美霞
1.空军军医大学第一附属医院呼吸内科,陕西西安710032;2.空军军医大学军事生物医学工程学系,陕西西安710032;3.空军军医大学第一附属医院护理部,陕西西安710032
前言
糖尿病是一种以机体葡萄糖代谢失衡为主要表现的代谢性的临床疾病。全球约有超过4.2 亿人饱受糖尿病折磨,而预期到2030年全球的糖尿病患者可能达到8 亿多人。糖尿病主要包括1 型糖尿病和2型糖尿病两类,其中2型糖尿病的患者人数占糖尿病总人数约90%。2 型糖尿病与遗传学因素、生活方式和饮食结构改变等密切相关,多发生于中老年人群[1‐2]。随着我国人口老龄化进程的加剧,2型糖尿病患者的人数也在逐年增加。2 型糖尿病溃疡及创伤愈合困难问题一直是临床上最为棘手的问题,严重影响着病患的生理和心理健康[3‐4]。而目前临床上尚缺乏安全有效的加速2 型糖尿病组织损伤修复的治疗方法。 低强度的脉冲电磁场(Pulsed Electromagnetic Fields,PEMF)作为一种安全、有效的物理治疗方法,已于20 世纪80年代开始应用于临床骨折及骨不连的治疗[5]。近年来的临床和动物实验研究均发现,PEMF 能够加速软组织损伤的修复和愈合进程[6‐7]。也有研究发现,PEMF对于链脲佐菌素诱发的1 型糖尿病软组织损伤修复具有积极效果[8‐9]。但是,PEMF 对于人口比例最大的2 型糖尿病软组织损伤的作用效果如何国内外尚未见研究报道。在本研究中,通过使用瘦素受体缺陷诱导的自发型2型糖尿病db/db 小鼠,系统探究低强度PEMF 对于2 型糖尿病组织损伤修复的治疗效果。
1 材料与方法
1.1 实验材料、试剂和仪器
3月龄雄性2 型糖尿病db/db 小鼠(C57BKS 背景,BKS.Cg‐m+/+Leprdb/J)及与其同背景的野生型小鼠(美国Jackson lab);用于麻醉的戊巴比妥钠缓冲液(美国Sigma 公司);便携式血糖仪(美国Johnson &Johnson 公司);生物组织力学测试系统(东莞昆仑仪器有限公司);数码照相机(日本Canon公司);组织切片机(德国Leica 公司);高斯计(美国Lakeshore 公司);ELISA试剂盒(武汉华美生物公司);有机玻璃小鼠饲养笼(电磁场研究专用),课题组自制。
1.2 实验设计和分组
本研究中涉及的动物实验程序均由空军军医大学动物伦理委员会授权批准。动物饲养于恒定温度(23 ℃)、湿度(50%~60%)和12 h/12 h光‐暗循环的房间内。在整个实验期间,所有动物均可随意摄取干净自来水和标准鼠粮。动物适应环境1周后,通过尾静脉取血,使用血糖仪测量db/db 小鼠的随机血糖值,血糖值高于16.7 mmol/L的小鼠被纳入实验。整个实验分为3组,分别为Wild type野生型小鼠组(Wild type)、db/db小鼠组(db/db)及db/db施加以PEMF刺激组(db/db+PEMF),每组16只。分别于创伤模型构建的第5、12、19天处死每组的4只小鼠,每组剩余的4只小鼠于伤口完全愈合的时间点处死。全部3组小鼠均构建背部表皮创伤模型,仅db/db+PEMF组小鼠施加以全身的PEMF刺激,每天刺激2 h。
1.3 背部软组织创伤模型的构建
使用戊巴比妥钠麻醉小鼠,并用酒精刮除和清洁其背部。使用皮肤活检针在每只小鼠的背部构建直径为1 cm 的圆形伤口,充分分离皮肤、皮下组织和肌纤膜组织,并覆盖Tegaderm 透明伤口敷料,以保持伤口湿润。术后注射青链霉素合剂以防止感染的发生。
1.4 低强度PEMF发生装置
PEMF 发生装置为课题组自行研制,整个系统主要包括电磁信号发生器和3‐Helmholtz线圈系统两部分。PEMF 波形脉冲群波形,频率为15 Hz,该波形已在课题组的先前研究中广泛使用,且其对于机体的积极作用效果也已被大量研究证实[10‐12]。3 个线圈(直径80 cm)同轴放置,彼此相距30.4 cm,中心线圈和外部线圈的匝数分别为266 和500,该三线圈结构比两个线圈的组装具有更高的磁场均匀性[10]。塑料笼的底部与线圈的中心对齐,以确保小鼠位于电磁场的中心位置。使用高斯计测量线圈中的电磁场强度,线圈中的峰值磁场强度为2.0 mT,而背景电磁场为(50±2)μT。
1.5 伤口闭合率的检测分析
使用数码相机拍摄各时间点小鼠伤口。在拍摄照片前,动物被固定在观察台上,相机放置于观察台上方20 cm 处,数码照片的水平和垂直分辨率分别为2 600 和2 000 像素。使用Matlab 软件对伤口面积进行分析计算。利用颜色阈值、边缘提取等多种图像分析算法对目标信息进行识别和提取。伤口愈合率作为评价伤口愈合过程的标准,按以下公式表示:伤口愈合率=(第0 天的原始伤口面积‐第n 天的伤口面积)/第0天的原始伤口面积。
1.6 伤口组织抗张强度、伤口组织病理和ELISA 检测分析
在每个时间点的动物处死后,组织样本被切成3块:一块用于生物力学测试,一块用于组织病理性检测分析,另一块用于ELISA 检测。将用于评估伤口抗张强度的组织样本修剪成8 mm×8 mm 的方形条带。实验前,将样品浸泡在生理盐水溶液中,以避免组织性能发生变化。采用生物力学材料测试系统进行组织拉伸实验。皮肤条固定在张力计的两个夹子之间,伤口部位位于两个夹子的中线处。通过两个夹钳的20 mm/min移动,向条带施加拉力。当观察到试样的最终破裂时,记录最大断裂载荷。组织学研究的伤口标本固定于10%中性福尔马林中,随后进行石蜡包埋,用锯片切片机切割5 μm 厚的切片。切片脱皮复水,梅耶尔苏木精伊红染色,光学显微镜下观察载玻片。ELISA 检测使用武汉华美生物公司的ELISA 商业试剂盒,检测指标分别为IL‐1β、TNF‐α、ⅤEGF 和IGF‐1,所有操作严格按照试剂盒的说明执行。
1.7 统计学方法
使用Microsoft SPSS 22.0 计算机软件进行数据统计分析,所有数据用均数±标准差表示,采用单因素方差分析(ANOⅤA)评估3 组之间的差异。一旦发现显著性差异,采用确定Benferoni 检验确定两组之间的差异显著性。P<0.05为差异有统计学意义。
2 结果
2.1 低强度的全身PEMF 刺激对于db/db 小鼠血糖和体质量的影响
3组小鼠在组织创伤模型构建后的第5、12、19天的体质量和血糖水平如图1所示。db/db 组和db/db+PEMF组小鼠的体质量值在术后的第5、12、19天均显著高于Wild type 组小鼠(P<0.01),但是db/db 组和db/db+PEMF 组小鼠的体质量值在各时间点均无统计学差异(P>0.05)。与Wild type 组小鼠相比,db/db组和db/db+PEMF组小鼠的血糖值在术后的第5、12、19 天均显著升高(P<0.01),但是db/db 组和db/db+PEMF 组小鼠的血糖值在各时间点均无统计学差异(P>0.05)。结果显示,低强度的全身PEMF 刺激并未对db/db小鼠的体质量和血糖产生显著性影响。
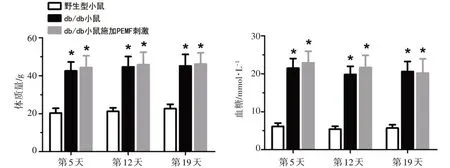
图1 PEMF刺激对于db/db小鼠血糖和体质量的影响Fig.1 Effects of pulsed electromagnetic field(PEMF)stimulation on blood glucose and body weight in db/db mice
2.2 低强度的全身PEMF 刺激对于db/db 小鼠伤口愈合速率和总愈合时间的影响
3组小鼠在组织创伤模型构建后的第5、12、19天的伤口愈合率以及伤口组织的创伤总愈合时间如图2所示。结果显示,2型糖尿病的db/db组在术后的第5、12、19 天的伤口愈合率均显著低于Wild type 组(P<0.01),而db/db+PEMF 组小鼠的伤口愈合率在术后的第5、12、19 天均显著高于db/db 组(分别增加101.9%、47.1%和39.4%)。db/db 组的创伤总愈合时间相比于Wild type 组增加了74.2%,而PEMF 刺激显著降低了db/db 小鼠的伤口总愈合时间(总愈合时间减少31.3%)。
2.3 低强度的全身PEMF 刺激对于db/db 小鼠伤口组织抗张强度的影响
3组小鼠在组织创伤模型构建后的第5、12、19天的伤口组织抗张强度如图3所示。结果显示,db/db组小鼠创伤组织的生物力学的抗张强度在术后的第5、12、19 天均显著低于Wild type 组(P<0.01),而db/db+PEMF 组小鼠的创伤组织的生物力学的抗张强度在术后的第5、12、19 天均显著高于db/db 组(分别增加97.8%、58.3%和69.2%)。
2.4 低强度的全身PEMF 刺激对于db/db 小鼠伤口组织病理学的影响
3 组小鼠在组织创伤模型构建后的第12 天的伤口组织病理性结果如图4所示。结果显示,db/db 组小鼠的组织创伤位置在术后的第12天仍可见大量的炎性细胞聚集,而Wild type 组小鼠的组织创伤位置的炎性细胞数量较少。而经过低强度的PEMF 治疗12 d 后,db/db 小鼠的组织创伤位置的炎性细胞在术后12 d显著减少。
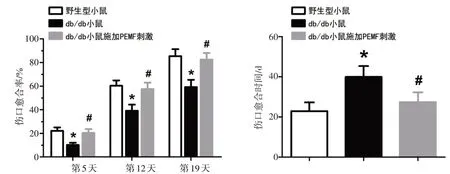
图2 PEMF刺激对于db/db小鼠伤口愈合速率和总愈合时间的影响Fig.2 Effects of PEMF stimulation on the wound healing rate and overall wound healing period in db/db mice
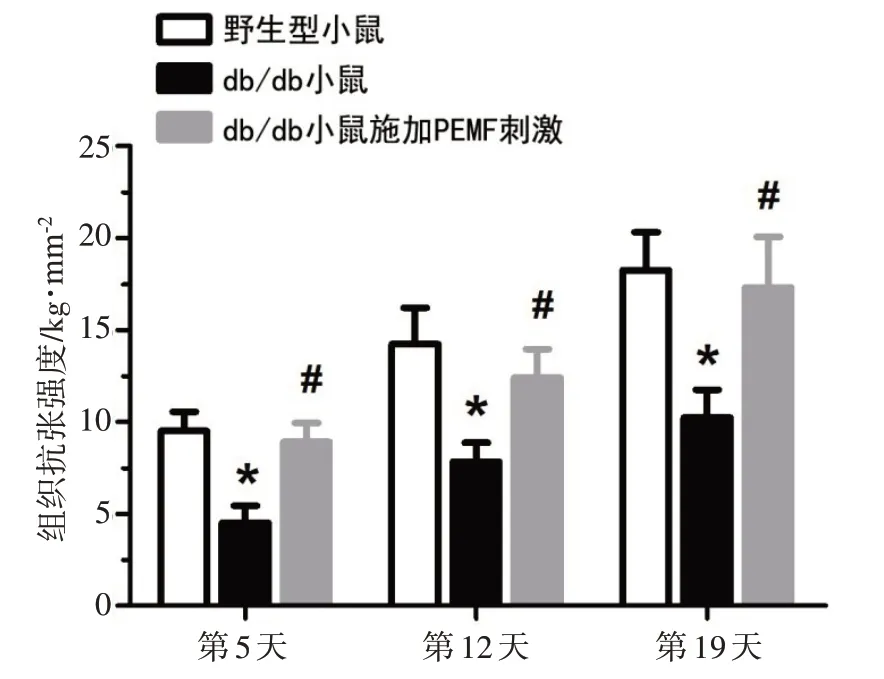
图3 PEMF刺激对于db/db小鼠伤口组织抗张强度的影响Fig.3 Effects of PEMF stimulation on the wound tensile strength in db/db mice
2.5 低强度PEMF 刺激对于db/db 小鼠伤口组织中重要细胞因子表达的影响
3组小鼠在组织创伤模型构建后的第5、12、19天的伤口组织中重要细胞因子表达水平如图5所示。ELISA 结果显示,Wild type 组的炎症相关因子IL‐1β和TNF‐α 的蛋白表达水平呈现出先增后减的变化趋势(以第12天最高)。而db/db组的IL‐1β和TNF‐α的蛋白表达水平在术后的第5、12、19 天均显著高于Wild type 组(P<0.01)。而db/db+PEMF 组的IL‐1β 和TNF‐α 表达水平在术后的第5、12、19 天均显著低于db/db 组(P<0.05),并且db/db 组和db/db+PEMF 组的IL‐1β 和TNF‐α 的表达水平在术后的第5、12、19 天无统计学差异。ELISA 结果进一步显示,db/db 组的ⅤEGF 和IGF‐1 的表达水平在术后的第5、12、19 天均显著低于Wild type 组(P<0.01),而db/db+PEMF 组的ⅤEGF 和IGF‐1 表达水平在术后的第5、12、19 天均显著高于db/db组(P<0.05)。
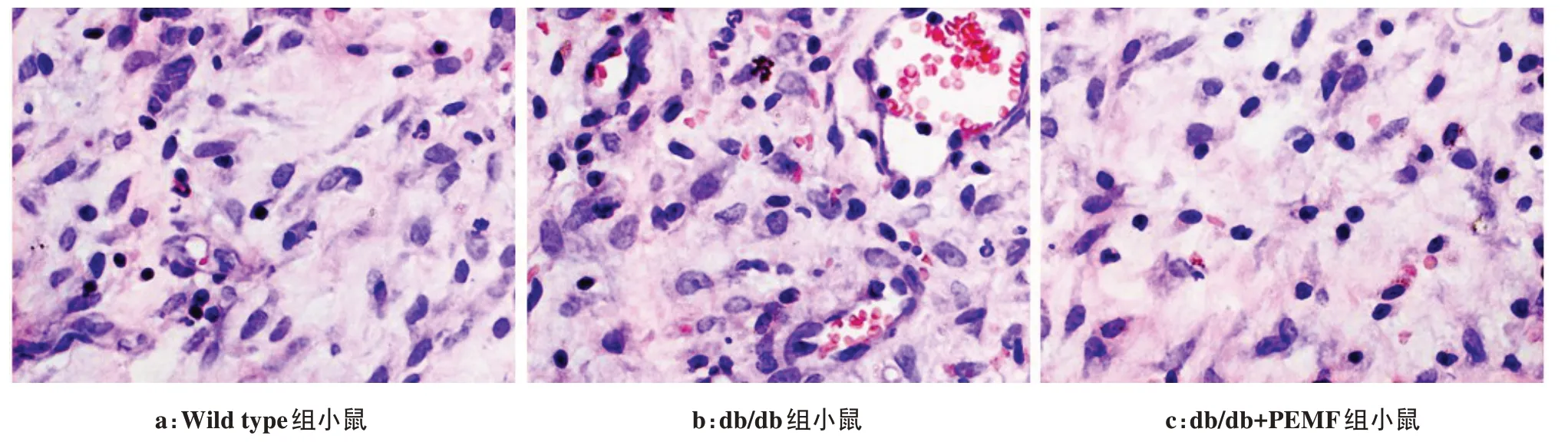
图4 PEMF刺激对于db/db小鼠伤口组织病理学的影响(术后12 d,40倍镜)Fig.4 Histopathological effects of PEMF stimulation on the wound tissues in db/db mice (on the 12nd day postoperatively,with 40×objective)
3 讨论
3.1 PEMF 显著改善db/db 小鼠创伤愈合能力,且与其对糖尿病体征的影响无关
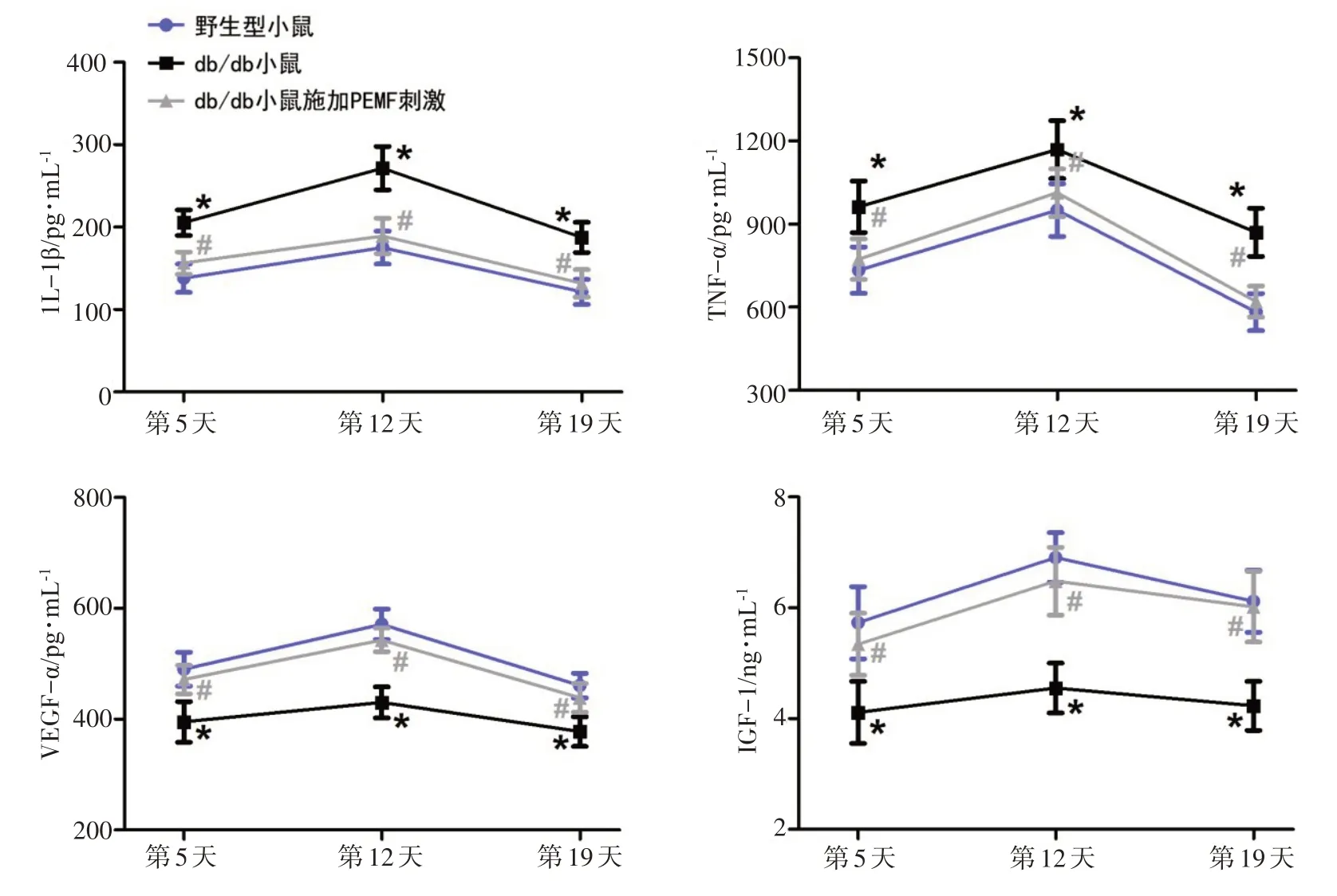
图5 通过ELISA检测PEMF对db/db小鼠伤口组织中重要细胞因子表达的影响Fig.5 Effects of PEMF stimulation on the expressions of critical cytokines in the wound tissues in db/db mice based on ELISA assay
目前糖尿病软组织损伤的动物实验大多使用腹腔注射链脲佐菌素的方式构建糖尿病动物模型,但是该方法构建的糖尿病模型为典型的1 型糖尿病体征。在本研究中使用db/db小鼠作为2型糖尿病动物模型。db/db 小鼠是一种全身性瘦素受体缺陷小鼠,表现为摄食过度、肥胖、高血糖和高胰岛素血症等典型的2 型糖尿病体征。db/db 小鼠也是目前研究2 型糖尿病及其相关并发症(如心血管疾病、肾病、神经病变、骨骼肌病变、溃疡等)最为理想的动物模型[13‐14]。
本文研究发现,2 型糖尿病的db/db 小鼠相比于非糖尿病小鼠在软组织损伤模型构建的第5、12、19天表现出伤口愈合修复的显著延迟,并且db/db 小鼠的创伤总愈合时间也相比于非糖尿病小鼠显著延长。上述特征与临床上的2 型糖尿病患者的软组织创伤愈合特征相似。本研究也进一步揭示,低强度的PEMF 刺激从术后的第5 天开始即显著加速了db/db小鼠软组织创伤的修复进程,使2型糖尿病的创伤修复速率进程与非糖尿病小鼠类似,并且PEMF 将2型糖尿病小鼠的创伤总愈合时间缩短约30%。同时研究也发现,在治疗的全过程中PEMF 并未对db/db小鼠的血糖和体质量产生显著影响,提示PEMF 对2型糖尿病动物软组织损伤的修复效应与其对糖尿病体征的影响无关。
3.2 PEMF 改善db/db 小鼠软组织抗张强度,揭示了对胶原结构的潜在优化效应
软组织的抗张强度是评价伤口愈合的重要生物力学指标,能够反映新合成和沉积的胶原蛋白的数量、质量和排列结构特性[15]。在伤口愈合过程中,随着组织的持续修复,皮肤的抗张强度会逐渐增加。本研究的生物力学检测结果表明,2 型糖尿病大鼠在整个创面愈合全过程中,其软组织的抗张强度明显低于正常大鼠。先前的动物实验研究也报道了类似的实验结果[16]。更重要的是,本研究发现低强度的PEMF刺激在软组织损伤模型构建的第5、12、19天均显著提升了db/db 小鼠软组织的生物力学抗张强度。研究表明,PEMF 对于提升2 型糖尿病动物的胶原纤维数量、加速胶原纤维沉积、促进胶原纤维的排布和定位具有积极效应,从而有助于改善2型糖尿病软组织的修复速率和修复质量。
3.3 PEMF 抑制db/db 小鼠伤口组织炎性因子表达、促进血管新生细胞因子表达
伤口愈合是一个系列化的复杂事件,涉及到成纤维细胞、内皮细胞、角质细胞、炎性细胞和细胞外基质之间的合作和相互作用[17]。组织病理学染色结果显示,2 型糖尿病db/db 小鼠在组织损伤的修复进程中(术后12 d)其炎性细胞数量显著多于非糖尿病小鼠。本研究发现,2 型糖尿病小鼠在软组织创伤后的炎症反应相比于非糖尿病小鼠更为严重,而这种更为剧烈的炎性反应也会进一步阻碍软组织的创伤修复进程。ELISA 结果也进一步揭示了2 型糖尿病db/db 小鼠损伤软组织中促炎性因子IL‐1β 和TNF‐α的表达在术后的第5、12、19 天相比于非糖尿病小鼠均显著增加。而组织病理性结果和ELISA 结果均揭示,低强度的PEMF刺激在组织创伤愈合的各阶段均能够抑制2型糖尿病小鼠的过度炎性反应,从而在促进db/db小鼠的组织损伤愈合中发挥积极效应。
血管内皮生长因子ⅤEGF 是一种组织创伤愈合的重要细胞因子,它参与血管生成并使毛细血管通透性增加,能够反映创伤修复过程中的血管再生情况[18]。ELISA 结果显示,db/db 小鼠损伤软组织中的ⅤEGF表达水平在术后的第5、12、19天均显著低于正常小鼠,提示2型糖尿病破坏了组织损伤修复过程中的血管再生能力。而PEMF刺激在术后的第5、12、19天均显著增加了db/db 小鼠损伤组织中的ⅤEGF 表达,提示PEMF具有显著的促新生血管再生潜能。其次,胰岛素样生长因子IGF‐1 作为机体中最重要的促组织生长和修复因子,而IGF‐1 同样具有促血管再生的作用[19]。笔者同样发现其在db/db 小鼠损伤软组织中表达显著降低。而本研究也发现,PEMF 治疗在术后的第5、12、19 天均能够显著提升2 型糖尿病小鼠软组织中的IGF‐1 表达,进一步证实PEMF 的促组织再生和促血管新生的潜能。
3.4 结论
综上所述,本研究首次揭示了低强度PEMF能够显著加速2型糖尿病db/db小鼠的软组织修复速率并改善组织的生物力学弹性属性,这一效应可能与PEMF 的抗炎性反应及促血管再生具有密切关系。本研究结果提示,低强度PEMF 作为一种安全、经济的物理作用方式,有望成为临床治疗2型糖尿病组织创伤愈合困难这一棘手问题的新治疗手段。
