粪便钙卫蛋白不同检测方法分析前及分析中影响因素分析*
2020-08-04曾俊祥吕婕罗婷余悠悠潘秀军上海交通大学医学院附属新华医院检验科上海200092
曾俊祥,吕婕,罗婷,余悠悠,潘秀军(上海交通大学医学院附属新华医院检验科,上海 200092)
炎症性肠病(inflammatory bowel disease,IBD)的疾病管理一直是临床诊疗关注的热点问题。消化道内窥镜检查虽然是IBD诊断及病情监测的金标准,但也有着成本较高、准备工作繁琐、检查流程有创且易造成患者的不适与痛苦等缺点。实现相对无创的实验室指标的快速检测,能为IBD临床决策提供更为便捷和快速的支持。近年来欧洲克罗恩病以及结肠炎组织(european Crohn′s and Colitis Organization,ECCO)、世界胃肠病组织(World Gastroenterology Organization,WGO)以及亚太胃肠病学会(Asian Pacific Association of Gastroenterology,APAGE)的共识指南[1-4]纷纷提出,粪便钙卫蛋白(fecal calprotectin, FC)是一种较为理想的标志物,可以在IBD的疾病管理中扮演重要角色,至此FC的临床应用受到重视[5-6]。
FC的准确检测是临床决策正确的前提条件,但由于检测样本为粪便,其特殊性造成FC检测分析前、分析中存在较多难以控制的实验影响因素[7],目前尚未得到国内学者及临床医师的足够重视,但这些因素却是检测结果主要的潜在误差来源。因此,本研究拟通过分析在FC检测分析前及分析中对检测结果产生影响的因素,以期控制并减少实验误差,实现FC的精确测定。
1 材料和方法
1.1研究对象 (1)IBD组:选取2019年1月至2019年6月上海交通大学医学院附属新华医院消化内科及肛肠外科IBD确诊患者30例,其中克罗恩病21例、溃疡性结肠炎9例,男17例、女13例,年龄18~63岁,诊断均符合《炎症性肠病诊断与治疗的共识意见(2018年,北京)》[8],所有病例临床资料完整、彼此间无血缘关系;(2)其他肠炎组:为同期在我院就诊以“腹痛、腹泻”为主诉、经消化道内窥镜排除IBD的患者30例,其中男18例、女12例,年龄27~68岁,包括急性感染性肠炎、肠结核等;(3)健康人对照组:选取同期于我院体检的表观健康者30名作为正常对照组,其中男14名、女16名,年龄18~53岁,入选标准:无反复发作的腹痛、腹胀、腹泻等消化道症状;既往无消化道出血、肿瘤、溃疡等病史;粪便成形,粪便常规结果正常且隐血试验阴性。3组之间性别、年龄差异均无统计学意义(P>0.05)。本研究通过上海交通大学医学院附属新华医院医学伦理委员会审核批准(No.XHEC-D-2018076),所有研究对象均签署知情同意书。
1.2试剂与仪器 试剂A:粪便钙卫蛋白检测试剂盒(ELISA法,瑞士BÜHLMANN公司),试剂B:粪便钙卫蛋白检测试剂盒(荧光免疫层析法,厦门为正公司),试剂C:粪便钙卫蛋白检测试剂盒(胶体金法,宁波美康公司);Multiskan Ascent酶联仪(美国Thermo Fisher Scientific公司),连续式免疫分析仪WIZ-A202(厦门为正公司)。
1.3粪便采样及萃取 向IBD组患者分发3个依次标记“早”、“中”、“晚”的清洁容器,嘱受试者按排便时间采集24 h内粪便(1~3个样本),并按时间区间进行留样(早晨:4:00—12:00;中午:12:00—20:00;晚上:20:00—次日4:00)。其他肠炎组和健康人对照组则嘱其收集当日第1次排便的粪便样本。在接收所有受试者样本1 h内按照试剂盒配套萃取管说明书进行等质量样本萃取。
1.4方法
1.4.1FC检测与结果判读 分别用ELISA法、荧光免疫层析法、胶体金法进行FC测定,按照试剂说明书进行操作。ELISA法和荧光免疫层析法检测分别在Multiskan Ascent酶联仪、连续式免疫分析仪WIZ-A202上读取结果,并同时根据试剂盒说明书推荐的cut-off值将结果判定为阳/阴性;胶体金法通过人工肉眼观察,对于包含抗原的条带位置出现着色均匀和清晰可见的颜色反应时,结果判读为阳性。

1.4.3留样时间对FC结果的影响 所有IBD组患者按1.3中方法采集24 h内粪便,ELISA法测定不同时间区间样本的FC浓度,计算同一患者不同时间段的粪便样本的FC结果变异系数(coefficient of variation,CV)。
1.4.4不同方法学对FC检测结果的影响 所有研究对象标本分别采用3种不同检测方法学试剂盒配套萃取管按照说明书进行萃取,萃取完毕后按照其各自对应检测方法进行FC测定。3种检测试剂盒相关性能参数见表1。
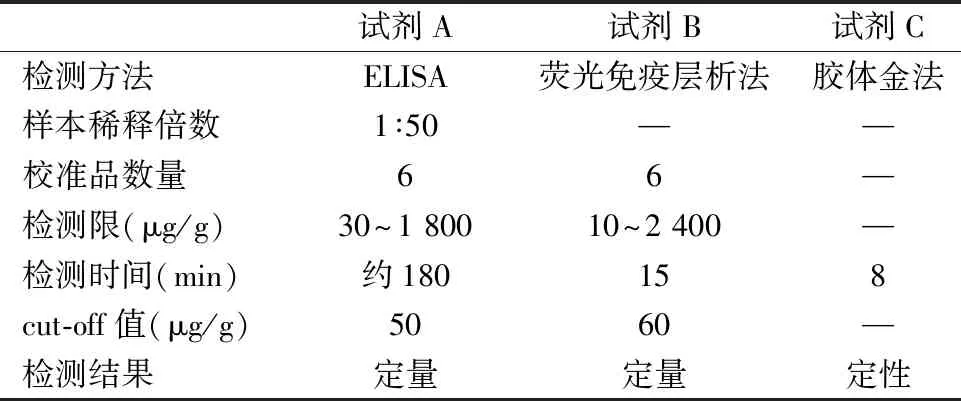
表1 3种检测试剂盒相关性能参数
2 结果
2.1FC分析前稳定性 随机选取3组研究对象各6例样本分别置于不同贮存温度并在不同时间点检测FC浓度。结果发现,7 d内不管在25 ℃还是4 ℃保存条件下,3组样本FC检测浓度较初始检测浓度均未出现明显变化(P>0.05),但在14 d、25 ℃下3个水平的 FC值较初始检测浓度均出现明显下降(P<0.05),而在4 ℃保存14 d FC浓度未见变化,由此可判定FC可以在室温下稳定7 d,4 ℃可稳定至少14 d。25 ℃下14 d后FC平均降解率为42.1%。见表2、图1。

表2 不同保存条件下FC检测结果(μg/g)
2.2分析前留样时间对FC结果的影响 30例IBD组患者共收集61份粪便样本(12个患者留样3份,7个患者留样2份,11个患者留样1份)。留样3份的患者24 h内FC结果变化见图2,早晨样本FC浓度为541.54(350.82,1 574.25)μg/g,中午样本为394.65(244.78,629.55)μg/g,晚上样本为426.75(156.78,785.85)μg/g。同一患者日间FC检测结果差异较大(CV:5.1%~80.2%),平均CV值为39.6%。
2.3分析中FC不同方法学测定结果一致性分析 试剂盒A、B为定量检测,试剂盒C为定性检测。对于定性结果,根据Kappa系数,3种方法学一致性尚可,见表3。对于定量检测结果,Bland-Altman分析显示(图3A),ELISA与荧光免疫层析法平均差值398.7 μg/g,B为558.79%,大于可接受范围(22.6%)[10];而Passing-Bablok回归分析显示(图3B),ELISA与荧光免疫层析法相关方程为Y=0.134 565X+5.730 871,提示2种方法的相关性差,量值结果不具备可比性。
3 讨论
FC在粪便离体后易被胰蛋白酶降解,Acevedo等[11]对18位活动期UC患者在2 d内留取的287例粪便样本进行研究,发现经过室温放置7 d,标本中的FC水平下降28%。但不同研究报道的FC在室温下的稳定时间尚未有一致结论,最短1 d,最长7 d。分析原因可能在于:在相同的时间内,高值标本的降解率要明显高于低值标本,若研究样本中高值标本占比过大,则研究结论中稳定时间会明显偏短,反之亦然。基于此,本研究特选取IBD患者标本作为潜在的高值样本分析,而其他肠炎组和健康人对照组作为潜在的中等值和低值样本,因此可以较好地规避该因素的影响。本研究结果表明,FC可以在室温下稳定7 d,而在4 ℃保存条件可以稳定14 d及以上,25 ℃下FC平均降解率为42.1%。因此建议新鲜标本要尽快送检,但对于一些门诊随访在自家留样的患者而言,若样本不能及时送检,需尽量冰袋保存。
有研究报道,FC具有较大生物变异性,同一患者同一天不同时间段所排出的粪便的FC含量之间也有较大差异[7],排便的次数与排便间隔的长短也会对结果产生影响。本研究结果也支持这一结论,同一患者同一天内FC检测结果差异较大(CV:5.1%~80.2%),平均CV值为39.6%,与Calafat等[12]研究的结果(52%)接近,清晨样本FC浓度最高,中午样本FC浓度最低。由于指南中推荐将FC浓度变化差(△FC)作为疗效监测指标,连续监测FC浓度变化对IBD疗效评估和疾病管理有重要意义,因此为保证结果具有可比性,我们推荐将清晨第一次排便的标本作为检测样本。
由于目前钙卫蛋白没有参考的检测方法和合适的参考物,不同检测方法的反应原理各不相同,不同的检测方法中所用的抗体的来源也不同,且这些抗体所针对的识别位点也有所差别,直接造成了检出限、灵敏度等差异[12-13]。根据英国国家外部质量评估服务(the United Kingdom National External Quality Assessment Service)的数据表明,不同检测方法检测同一样本的FC所得到的定量值结果间的差异最大能达到3.8倍[14]。本研究纳入3种不同检测方法的试剂盒,结果发现,对于定性结果(阴/阳性)3种检测方法一致性尚可接受。但对于定量结果,不同检测方法的一致性差,量值结果不具备可比性。因此,对于临床上IBD患者的初筛鉴别,不同检测方法不会对临床决策产生决定性影响,但对于IBD患者长期随访与病情监测,FC结果则需要考虑方法学一致性。
综上,作为分析前误差来源,粪便样本的送检时间和样本留取时间可以通过规范化的手段进行有效控制,而不同方法学FC检测尽管定性结果一致性良好,但是其定量数值却差异较大,无法做到结果互认。因此,有必要对FC的实验室检测进行标准化与规范化[15],使FC的检测结果更加准确、可靠,才更具有临床参考价值。
