早期胰腺导管腺癌相关肿瘤标志物的筛选及临床意义*
2020-08-04李雪洁崔大伟滕晓东浙江大学医学院附属第一医院病理科输血科杭州310003
李雪洁,崔大伟,滕晓东(浙江大学医学院附属第一医院.病理科,.输血科,杭州310003)
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是常见的恶性肿瘤之一,5年生存率仅为2%[1]。虽然切除术后PDAC患者具有较高的生存率,但多数患者就诊时已是晚期,仅有15%~20%的PDAC患者在发生早期病变时有手术机会[2]。糖类抗原19-9(CA19-9)作为临床上常用的PDAC诊断肿瘤标志物,其敏感性和特异性均不甚理想[3]。因此,迫切需要寻找更好的肿瘤标志物或多项肿瘤标志物联合检测,以提高早期PDAC的检出率。目前已报道的PDAC筛查肿瘤标志物种类繁多,非常有必要对候选肿瘤标志物进行系统性评估[4]。本研究拟通过筛选癌症基因图谱计划(TCGA)数据库,并对初步筛选的候选肿瘤标志物进行ELISA法检测,以期构建早期PDAC筛查的肿瘤标志物模型。
1 材料与方法
1.1研究对象 收集2018年10月至2019年12月浙江大学医学院附属第一医院肝胆胰外科就诊的PDAC患者100例,男65例,女35例,年龄38~79岁,中位年龄55岁。均按照PDAC诊断标准[5]明确诊断。纳入标准:(1)手术切除标本或B超引导下细针穿刺细胞学标本经病理组织学检查明确诊断;(2)B超、CT、MRI、逆行胰胆管造影(ERCP)、超声内镜(EUS)、经皮肝穿刺胆管造影(PTC)等证实胰腺有占位性病变。排除标准:(1)已接受放、化疗的患者;(2)同时患有严重的肝肾功能不全、糖尿病、感染、其他类型肿瘤;(3)非PDAC初诊患者。按照美国国立综合癌症临床实践指南[6]进行临床分期,分为早期PDAC 75例,中晚期PDAC 25例。相关疾病对照组收集同期就诊的30例慢性胰腺炎患者(按照慢性胰腺炎确诊标准[7]确诊),男12例,女18例,年龄36~69岁,中位年龄52岁;以及30例胰腺良性囊肿患者(经病理组织学明确诊断为胰腺囊腺瘤),男17例,女13例,年龄42~68岁,中位年龄55岁。另收集同期本院体检中心体检健康者40例作为健康人对照组,男17例,女23例,年龄28~55岁,中位年龄48岁。本研究通过浙江大学医学院附属第一医院医学伦理委员会审核批准(No.ZYYY-D-2019940),所有研究对象均知情同意。
1.2标本采集 采集各研究对象治疗前的空腹静脉血(体检健康者于体检时采集)3 mL,EDTA-K2抗凝,2 000 r/min离心5 min,收集血清,于2 h内完成检测。
1.3主要试剂与仪器 CA19-9、白细胞激活粘附因子(ALCAM)、壳多糖酶3样蛋白(CHI3L1)、醛脱氢酶8A1融合蛋白(COL18A1)、胰岛素样生长因子结合蛋白(IGFBP2)、脂质运载蛋白2(LCN2)、亮氨酸糖蛋白1(LRG1)、溶菌酶(LYZ)、尼曼病蛋白2(NPC2)、帕金森氏病蛋白7(PARK7)、再生胰岛衍生蛋白3(REG3A)、分泌性白细胞蛋白酶抑制因子(SLPI)、组织蛋白酶S(CTSS)、血小板凝血酶蛋白1(THBS1)、组织金属蛋白酶抑制因子(TIMP1)、肿瘤坏死因子受体超家族成员1A(TNFRSF1A)和四二硫化物核心域蛋白2(WFDC2)ELISA检测试剂盒(美国Abcam公司);Thermo Scientific Multiskan GO酶联仪(美国赛默飞世尔科技公司)。
1.4数据库筛选肿瘤标志物 收集TCGA数据库中所有可获取的近5年PDAC研究数据(2014年12月至2019年12月)。步骤:(1)登录TCGA数据库优化后的GEPIA数据库(www.gepia2.cancer-pku.cn),选择癌肿类型为PAAD(胰腺导管腺癌在TCGA数据库中的样本代号)进行检索,网站输出突变的mRNA共计85个;(2)文献检索:在PubMed数据库检索对应时间(2014年12月至2019年12月)发表的PDAC研究,检索上述85个mRNA,并分析每个mRNA在PDAC和健康人组织中表达水平的高低(以表达量中位数为分界点),以P<0.05为差异有统计学意义,共筛选出17个目标基因,分别为:CA19-9、ALCAM、CHI3L1、COL18A1、IGFBP2、LCN2、LRG1、LYZ、NPC2、PARK7、REG3A、SLPI、CTSS、THBS1、TIMP1、TNFRSF1A和WFDC2。
1.5ELISA法检测各肿瘤标志物 取各研究对象血清标本100 μL,按照上述17种肿瘤标志物ELISA检测试剂盒说明书检测,Thermo Scientific Multiskan GO酶联仪检测吸光度(A450 nm)值,绘制标准曲线,根据线性回归方程,计算各指标的浓度值。实验重复3次。各肿瘤标志物参考范围(ng/mL)分别为:CA19-9<5.2,ALCAM<3.4,CHI3L1<2.9,COL18A1<1.9,IGFBP2<4.8,LCN2<5.7,LRG1<2.3,LYZ<1.7,NPC2<2.3,PARK7<4.2,REG3A<3.1,SLPI<3.6, CTSS<2.4,THBS1<2.3,TIMP1<2.8,TNFRSF1A<2.9和WFDC2<4.1。
2 结果
2.1各组17种候选肿瘤标志物的表达水平 ELISA法检测结果表明,17种候选肿瘤标志物中有7种蛋白质(分别为IGFBP2、LRG1、CA19-9、REG3A、COL18A1、TIMP1和TNFRSF1A)在PDAC组中的表达水平显著高于相关疾病对照组及健康人对照组,差异有统计学意义(P<0.05)。见表1。

表1 17种候选肿瘤标志物在各组中表达水平(ng/mL)的比较
2.27种肿瘤标志物在早期、中晚期PDAC患者血清标本中的比较结果 进一步分析表1中呈差异表达的7种肿瘤标志物在早期、中晚期PDAC患者血清标本中的表达水平,结果发现CA19-9、 TIMP1、LRG1在两组中的差异有统计学意义(P<0.05)。见表2。

表2 7种肿瘤标志物在早期、中晚期PDAC患者血清中的表达(ng/mL)
2.3CA19-9、 TIMP1、LRG1单独及联合检测对早期PDAC的诊断效能 以早期PDAC患者作为疾病组,非PDAC患者 (健康人对照组、良性囊肿患者、慢性胰腺炎患者)作为对照组,经二元Logistic回归分析,3种肿瘤标志物与诊断早期PDAC的相关程度见表3。建立的Logistic回归模型为:ln[P/(1-P)]= 0.412× TIMP1+0.054×LRG1+25.6×CA19-9-14.4,计算出每个样本的P值,得到预测概率。绘制ROC曲线,该预测概率的ROC曲线下面积(AUCROC)为0.950,结果见图1和表4。分别以CA19-9>38.2 ng/mL、TIMP1>21.9 ng/mL、LRG1>16.9 ng/mL、三者联合的预测概率>60%作为cut-off值,3种肿瘤标志物联合检测诊断早期PDAC的敏感性、特异性及准确性均高于单独检测和两两联合检测。见表4。
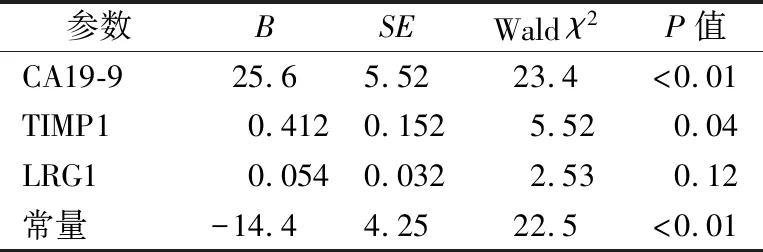
表3 3种肿瘤标志物的Logistic回归分析结果
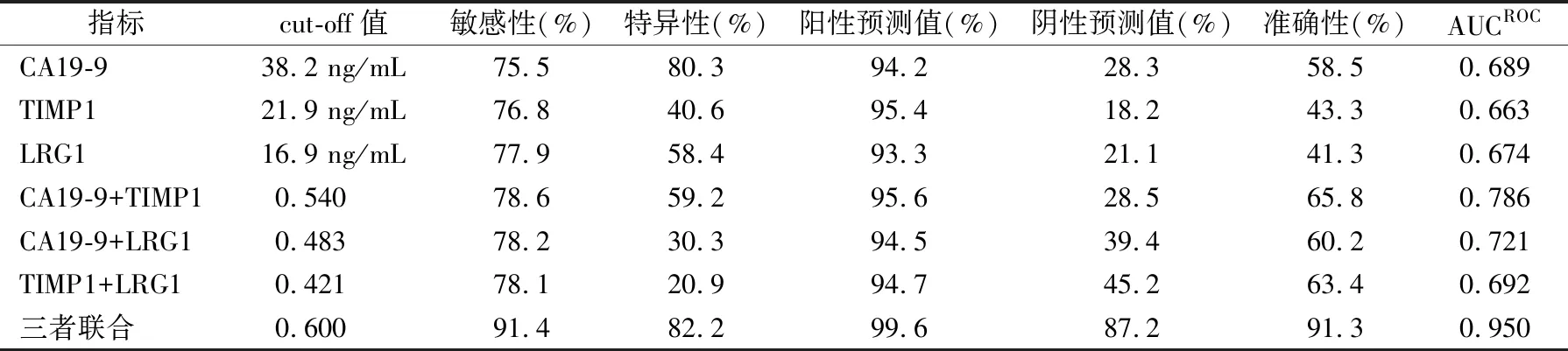
表4 CA19-9、TIMP1和LRG1单独及联合检测对早期PDAC的诊断效能比较
3 讨论
本研究首先从数据库中检索并初步筛选出17个目标基因(CA19-9、ALCAM、CHI3L1、COL18A1、IGFBP2、LCN2、LRG1、LYZ、NPC2、PARK7、REG3A、SLPI、CTSS、THBS1、TIMP1、TNFRSF1A和WFDC2),与Kim等[8]的研究结果相比少了3个(分别为MMP2、MMP10和THBS2),较Song等[9]的研究结果相比少了6个(OPG、OPN、ICAM-1、SAA、ApoA1、CEA和CRP)。可能是由于限定条件不完全相同,导致初步目标基因数量略有差异,但本研究与上述文献均重叠了这17个目标基因,由此可见这些基因可能作为筛选早期PDAC的潜在肿瘤标志物。
本研究采用ELISA法进一步验证在PDAC患者血清标本中存在明显差异的7种肿瘤标志物(IGFBP2、LRG1、CA19-9、REG3A、COL18A1、TIMP1和TNFRSF1A),这7种肿瘤标志物在健康人群或相关疾病对照者血清中含量较低,能较好地用于疾病的区分。Root等[10]检测了30例PDAC患者、20例健康人和10例慢性胰腺炎患者血清标本中7种与本研究相同的候选生物学标志物,结果发现这7种蛋白质的表达差异均具有统计学意义。其与本研究结果仅存在表达水平的差异,可能是地域和人群选择,亦或是样本类型(血清)、储存和测定条件(试剂和ELISA选择)等造成的结果差异。
本研究应用Logistic回归模型并结合ROC曲线分析在早期与中晚期PDAC患者血清中表达差异的3种肿瘤标志物(CA19-9、TIMP1、LRG1),并进一步分析其在早期PDAC诊断中的临床意义,结果发现该3种标志物联合检测诊断早期PDAC患者的AUCROC、敏感性、特异性和准确性均高于任一肿瘤标志物单项检测及两两联合检测,提示该3种标志物联合检测可有效提高早期PDAC检出率。本研究的不足之处是纳入的早期PDAC患者例数偏少,且缺少癌前病变患者,后续研究中应继续增加相应的标本量。此外,仍需要进一步对肿瘤标志物组合进行严格验证,并除去循环蛋白质之外的其他类型肿瘤标志物的干扰,以进一步提高早期PDAC的诊断效能。
