纳米钛酸亚铁的制备及刚果红吸附性能*
2020-08-03王晓欢史志铭刘肖灼
王晓欢,史志铭,孙 丽,赵 涛,刘肖灼
(内蒙古工业大学 材料科学与工程学院,呼和浩特010051)
0 引 言
钛酸亚铁(FeTiO3)是钛铁矿的主要成分,钛铁矿在世界上有着丰富的储量。目前,制备FeTiO3的方法有溶胶凝胶法[1-5]、水热法[6-9]、球磨法[10-12]和连续溶剂热法[13]等,其中溶胶凝胶法因其制备工艺简单而被广泛应用。对于FeTiO3的性能研究表明,到目前为止,对于FeTiO3性能研究较多的就是其光催化性能,Ali Abbasi等人[14]利用溶胶-凝胶法和光沉积法制备合成FeTiO3/TiO2/Ag纳米复合材料,合成的光催化剂在以罗丹明B、亚甲蓝、甲基橙为污染物模型,各种染料水溶液的脱色反应中表现出良好的光催化性能。Zhang等人[15]在800℃还原Fe3O4@TiO2合成α-Fe/FeTiO3/二氧化钛,随后氮化处理,制得的样品对亚甲基蓝有很好的光催化效果。原因是由于存在大量的Ti3+和氧空位。另外,FeTiO3还可作为电池材料[16-17]。而本研究提出FeTiO3还可以作为一种染料吸附材料。目前环境问题仍在是热点话题,其中染料排放是水污染的主要来源。吸附法是染料处理的最简便的方法,常用的吸附剂有氧化物、氢氧化物、有机聚合物、粘土矿物和活性炭等。然而,这些材料也存在一些缺点,如价格高、运行成本高、回收困难、再生过程能耗高等。因此,制备出更合适的吸附剂也是研究的一个方向。本文利用简单的溶胶凝胶法制备出一组不同铁钛摩尔比例的FeTiO3基纳米粉体,以染料中使用较为广泛的刚果红作为被吸附物质。由于FeTiO3具有一定的磁性,吸附后可通过外加磁场将其回收,因此本研究将为染料污水处理提供参考价值。
1 实 验
1.1 样品制备
钛酸亚铁采用溶胶-凝胶法制备而成,原料为硝酸铁(Fe(NO)3·9H2O)、钛酸四丁酯、无水乙醇和氨水。其中铁钛离子摩尔比例分别0.25∶1,0.5∶1,1∶1和2∶1,对应质量分别1.4845,2.969,5.938和11.878 g(分别记为FT025、FT05、FT1和FT2)。首先量取5 mL钛酸四丁酯滴加入10 mL无水乙醇中,在磁力搅拌器快速搅拌10 min,形成A溶液。再将一定量的Fe(NO)3·9H2O溶于10 mL无水乙醇溶中,形成B溶液,将B溶液缓慢滴加到A溶液中,并剧烈搅拌10 min,之后缓慢滴加氨水,直至成为凝胶状。将此凝胶陈化24 h后80 ℃下干燥,即可得到不同离子掺杂的FeTiO3干凝胶。将干燥后的FeTiO3放置于管式气氛电炉中在不同温度下烧结,氩气400 mL/min,一氧化碳100 mL/min,保温2 h后随炉冷却,取出样品,研磨即得到钛酸亚铁纳米粉体。
1.2 吸附实验
采用去离子水配制初始浓度为60 mg/L的刚果红 (CR) 染料溶液。将10 mg样品分别加入30 mL的CR溶液中。吸附剂吸附后离心分离,离心速度为3 000 r/min离心时间5 min。取上清液通过紫外可见分光光度计在最大吸收波长497 nm处测试其吸光度,平衡吸附量 (mg/g)的计算使用公式:
(1)
其中:C0(mg/L)为初始染料浓度,Ce(mg/L)为平衡浓度,V(L)为CR溶液体积,m(g)为吸附剂的质量。
1.3 样品表征
经不同温度烧结后的氧化钛粉体用X射线衍射仪(XRD,D/MAX-2500/PC,日本理学)进行物相分析。测试使用的靶为CuKα1波长λ=0.15406 nm,测试电压为40 kV,电流300 mA,扫描方式连续扫描,扫描范围20~80°。利用 X射线光电子能谱(XPS, SCALAB 250Xi, 赛默飞)分析样品的价态组成。利用Brunauer-Emmett-Teller (BET,3H-2000PS2,Bei Shi De)对比表面积、孔隙率和孔径进行表征。利用紫外可见光分光光度计(UV-Vis,UV-3600,日本岛津)测试染料吸附前后溶液的吸光度。
2 结果与讨论
2.1 相变过程研究
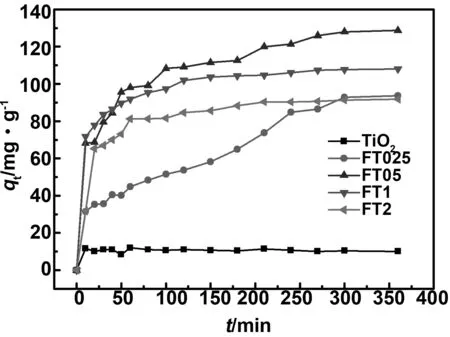
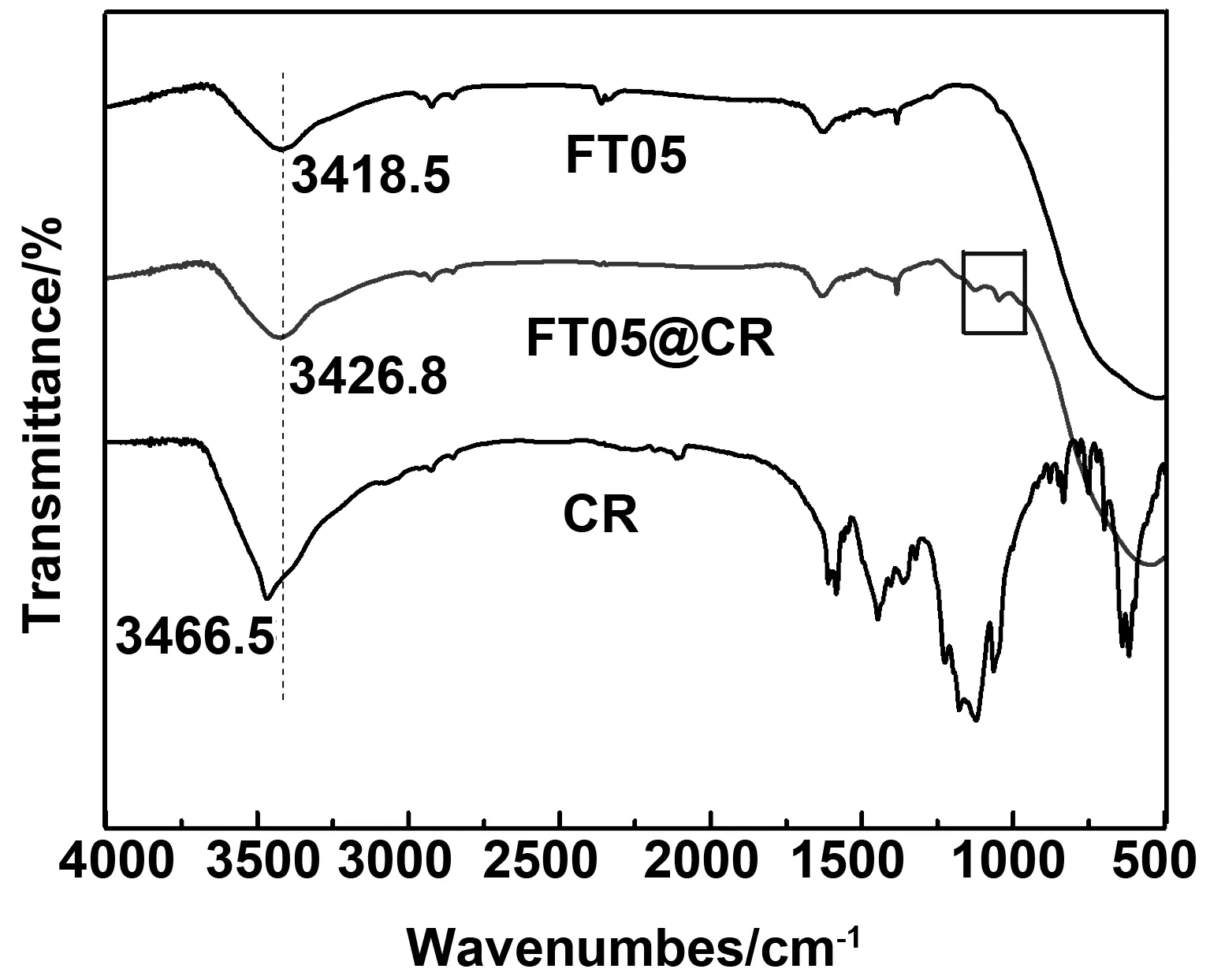
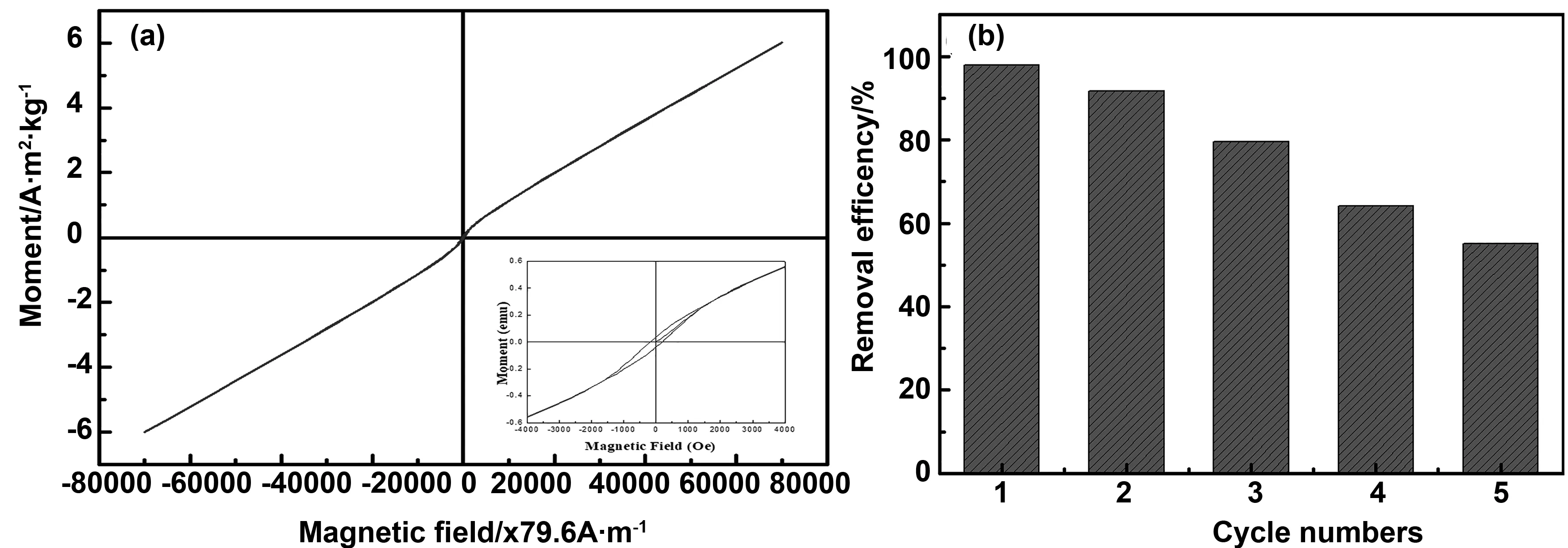
图1(a)为还原气氛600℃烧结的铁钛离子比例不同情况下的XRD衍射图谱。从图中可以看到,对于FT025样品,衍射峰对应为FeTiO3相(JCPDS#00-29-0733),2θ=32.49, 35.24,48.76 和 53.03°对应 (104), (110) (024) 和(116)晶面。2θ=27.43, 36.12和54.38°对应金红石相(JCPDS#00-021-1276)(110),(101)和 (211)晶面,以及非常少量的锐钛矿相(JCPDS#00-021-1272),2θ=25.34, 48.11和53.96°对应 (101),(200)和(105)晶面。通过Reitveld 全谱拟合与结构精修得出FT025样品中FeTiO3约占52.9%,金红石约占46.67%,锐钛矿仅约占0.43%;当铁钛离子比例增加到0.5∶1时,仍然存在少量的锐钛矿相和金红石相,而FeTiO3相的相对含量有所增加。精修得出,FT05样品中FeTiO3约占74.8%,金红石约占23.4%,锐钛矿约占1.8%。铁离子比例增加样品中TiO2的比例相对减少,而FeTiO3的比例增加,这表明掺杂的铁离子部分取代TiO2的Ti形成FeTiO3相。铁钛离子比1∶1时得到纯FeTiO3相。当铁钛摩尔比增加到2:1时,相组成为FeTiO3相,约占65.49%,Fe3C(JCPDS#03-0989)约占26.57%,以及少量的Fe3O4相(JCPDS#89-0951)约占7.94%。可以看出,当铁离子的比例过多时,无法制备出FeTiO3纯相。有研究表明[18-19], Fe3C 的生成按温度可以分为3个阶段,即高温阶段(t>628 ℃),中温阶段(586 ℃ 图1 不同铁钛比例样品的X射线衍射图谱和晶粒度Fig 1 X-ray diffraction patterns and grain size of samples with different Fe-Ti ratios 图2为铁钛离子0.5∶1的样品XPS图谱,样品中含有Fe、Ti和O元素。其中图2(a)为Ti 2p轨道的特征峰,经过Avantage软件进行分峰拟合,峰位从左到右分别对应Ti4+(2p1/2)、Ti3+(2p1/2)、Ti4+(2p3/2) 和Ti3+(2p3/2),图2(b)为Fe 2p轨道的特征峰,分峰拟合后峰位从左到右分别对应Fe (2p1/2) Satellite、Fe3+(2p1/2)和Fe2+(2p1/2),Fe (2p3/2) Satellite、Fe3+(2p3/2)和Fe2+(2p3/2)的特征峰[21]。同样,Fe 2p轨道的卫星峰(Satellite)是由于电子弛豫、多重分裂、多电子效应引起的。图2(c)为O 1s轨道的特征峰,两个峰位分别对应于表面晶格氧(Olatt)和表面吸附氧(Oads)。表面吸附氧越来越多,对应样品中氧空位也越来越多。 图2 FT05样品的XPS图谱Fig 2 XPS spectra of FT05 samples 图3(a)为采用Barrett-Joyner-Halenda (BJH)方法得到的氮吸附-解吸等温线及相应的孔径分布曲线。在等温线中观察到迟滞回线,表现出典型的IV型等温线特征,说明样品为介孔材料[22]。吸附-解吸曲线形成了明显的H3滞回曲线。滞回曲线没有明显的饱和吸附平台,孔隙结构非常不规则。吸附等温线与脱附等温线分离的部分出现了一个吸附滞后环,这是由于吸附是从孔内半径大的位置开始,逐步充满细孔脱附首先从已充满的、半径小的孔口开始脱附时的平衡压力小于吸附时的平衡压力,孔口处的吸附量比孔内的吸附量小,尽管吸附量几乎不变,却产生平衡压力差,因此出现了吸附滞后环。从BET 多点法计算可以看出所制备样品的比表面积分别为36.72、49.15、40.77和48.59 m2/g,其中FT05的样品比表面积最大。从插图的孔径分布可以看出,样品均属于介孔材料。表1中列出了不同铁钛摩尔比样品的比表面积、孔尺寸和孔容积。 表1 FeTiO3比表面积结果 图3(b)为还原气氛600 ℃下烧结不同铁钛比样品的Zeta电位分布图,从数据可以看出,所有样品表面均带正电荷,样品FT025、FT05、FT1和FT2的Zeta电位值分别为+19.12、+27.12、+26.19和+16.55 mV。这表明样品表面带负电,且分散性较好。 图3 FT05样品的比表面积和孔径分布及Zeta电位分布图Fig 3 BET and pore size distributions (inset), and Zeta potential distributions of FT05 sample 2.4.1 吸附曲线 图4为不同铁钛离子比例的钛酸亚铁纳米粉体随时间的变化吸附量变化曲线。从图中可以看出,当铁离子比例为零,即样品为纯氧化钛时,样品对刚果红的吸附量基本不变,表明纯氧化钛对刚果红没有吸附性能。样品FT025具有吸附性,但吸附速率较慢。FT05、FT1和FT2样品对刚果红吸附速率明显增加,其中FT05样品的吸附效果最好,其最大平衡吸附量为128.7 mg/g。FT2样品的吸附效果较差,是因为随着铁比例增加,样品中存在Fe3O4而使得其磁性增强,团聚严重,导致吸附效果变差。另外,FT2样品中出现的杂相Fe3C和Fe3O4可能影响其吸附效果。 图4 铁酸亚铁纳米粉体吸附量与时间的关系Fig 4 Relationship between the adsorption quantity and time 2.4.2 吸附动力学 图5分别为准一级动力学吸附模型和准二级动力学吸附刚果红模型拟合后的情况。表2列出两个模型分别适用于不同铌离子掺杂钛酸亚铁的相关常数和利用动力学模型计算出的理论吸附量。从表中可以看到准二级动力学模型的R2值均大于0.9,因此它更适合解释样品吸附刚果红的吸附动力学过程。利用准二阶动力学模型方程计算出样品的吸附量与实验结果吻合较好。表明样品对刚果红的吸附可能是化学吸附过程。 图5 一级动力学和二级动力学吸附模型Fig 5 The pseudo-first-order model and pseudo-second-order adsorption models 表2 一级动力学和二级动力学模型常数 2.4.3 吸附机理讨论 染料吸附是一个比较复杂的过程,影响染料吸附的因素也比较多,例如氢键作用、静电吸引和π-π络合建作用等。为了验证CR吸附前后样品结构的变化,分别在吸附前后采集了FTIR光谱。图6为FT05吸附前、吸附后FT05@CR和染料CR的FT-IR谱。CR吸附后,FT05中-OH峰由3 418.5向左移至3 426.8 cm-1,说明CR通过-OH基团成功被吸附。同时,吸附CR后,FT05@CR样品在约1 046.05 cm-1处(绿色矩形内)出现明显峰值,与CR分子的S=O振动有关[23]。这表明CR的吸附受氢键相互作用的控制。CR分子中的-NH2基团可以与样品中的-OH基团形成氢键[24]。此外,FT05的BET最大,对应的吸附位点较多,吸附性能最好。样品表面带正电荷,而刚果红属于阴离子型染料,因此静电吸引作用也是吸附的主要原因,且电位值越大吸附性能越好。 图6 FT05染料吸附前后的FT-IR图谱Fig 6 FT-IR spectra of FT05 before and after adsorption CR 2.4.4 重复利用 作为吸附材料,钛酸亚铁最大的优点在于材料具有一定的磁性,图7(a)为FT05样品的磁化曲线,表明样品具备一定的磁性,因此,染料吸附后可能通过外加磁场将其回收,并进行再利用。图7(b)为FT05样品五次重复利用的刚果红染料去除率图,从第一次的97.9%到第五次去除率为55.1%,表明该材料具有较好的回收利用性,具有一定的实际应用价值。 图7 FT05样品的磁化曲线和吸附回收利用Fig 7 The VSM plots and recyclability of adsorbent of FT05 本研究利用溶胶凝胶法制备了不同铁钛离子比的钛酸亚铁基材料,并研究了其对刚果红的吸附性能,得出结论如下: (1)还原气氛下铁钛摩尔比1∶1时,样品为纯FeTiO3相,铁钛离子比例0.25∶1和0.5∶1时样品组成为FeTiO3和氧化钛,铁钛比增加到2∶1时样品中除了FeTiO3还出现少量的Fe3O4和Fe3C。 (2)样品中铁离子以Fe2+和Fe3+形式共存,钛离子以Ti3+和Ti4+形式共存,且存在氧空位。 (3)染料吸附性能研究表明,铁钛摩尔比0.5∶1的样品由于较大的比表面积和Zeta电位值而具有最好的吸附性能,最大平衡吸附量为128.7 mg/g,其吸附过程符合二级动力学模型。且样品具备磁性,吸附后可以回收再利用。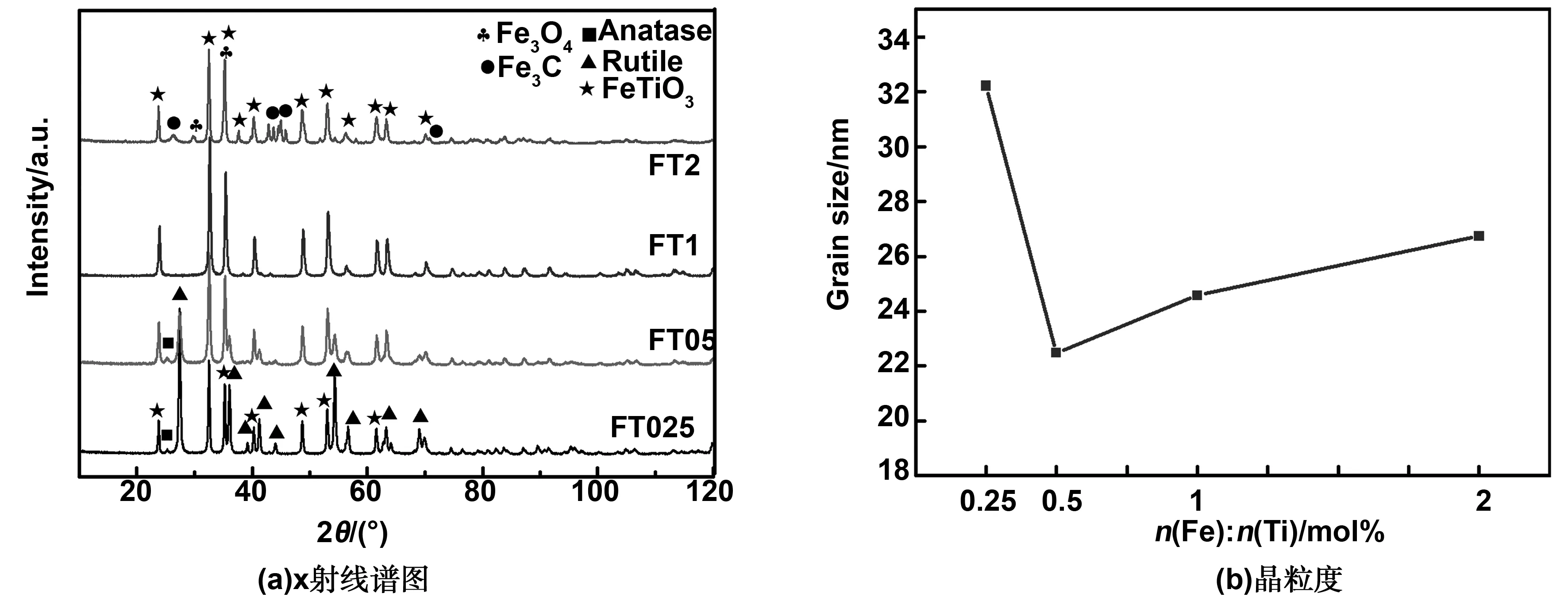
2.2 价态分析

2.3 比表面积及Zeta电位分析


2.4 吸附性能研究


3 结 论
