参附益心方对缺氧条件下大鼠原代心肌细胞线粒体DNA相关基因表达的影响*
2020-08-01王新陆谢世阳朱明军王永霞
马 腾,李 彬,王新陆,谢世阳,高 原,朱明军,王永霞
(1. 河南中医药大学 郑州 450000;2. 河南中医药大学第一附属医院 郑州 450000)
心力衰竭(简称“心衰”)是各种临床心脏疾病发展到晚期阶段的一种表现,其发生、发展过程复杂,死亡率居高不下[1]。心衰时,心肌细胞处于能量代谢失衡状态,可导致心肌收缩功能不全和心室重构的进展。线粒体是能量代谢的枢纽,是细胞中的“发电站”,也是脂肪、糖和氨基酸氧化和释放能量的最后场所。而线粒体DNA(mtDNA)的表达,是电子传递链、氧化磷酸化和ATP 合成的重要组成部分,对心肌细胞能量代谢具有重要意义。
参附益心方源自于河南中医药大学,是孙建芝教授治疗慢性心衰的临床经验方,具有益气、温阳、活血、利水等功效。当下认为,中医中的“气”与现代医学的“能量”、“ATP”具有相同的物质基础[4],从气血理论方面可对参附益心方改善心衰患者心功能、改善预后进行阐述。前期临床研究发现参附益心方能改善心衰患者症状、心功能、提高生活质量及改善预后[5]。另外,本课题组经过前期相关基础研究[6-9],发现参附益心方可能通过调控相关miRNA、信号通路发挥改善心肌细胞能量代谢的作用,从而发挥改善心功能、抗心衰、延缓或逆转心肌重构的作用。本试验在缺氧诱导的原代心肌细胞损伤模型中,通过观察参附益心方对缺氧诱导的心肌细胞ATP 和LDH 含量,ND-1、ND-2、COX、tfam基因的表达,进一步验证参附益心方对心肌细胞线粒体DNA基因表达的影响。
1 材料
1.1 实验动物
SPF 级1-3 d 新生SD 乳大鼠,购自河南省实验动物中心,雌雄不限,生产许可证号:SCXK(豫)2015-0005。
1.2 仪器设备
TDL-50B 型低速台式大容量离心机(北京医用离心机厂);MK3型酶标仪(德国Thermo Scientific 公司);JA203 型电子分析天平(上海海康电子仪器厂);IKAV-MAG HST 型磁力搅拌器(中国苏州艾卡公司);BCM-1000A型生物超净工作台(江苏苏净集团安泰公司);DMI 3006倒置荧光显微镜(德国莱卡公司);CK 40倒置显微镜(奥林巴斯公司,日本);Rco-3000tvbb 二氧化碳培养箱(Revco,美国);Inucyte zom 长时间细胞动态成像分析系统(Sensi技术有限公司);ABI 7300型荧光定量PCR仪(美国AB公司)。
1.3 实验试剂
Dulbecco's Modified EagleMedium(DMEM)培养基(Solarbio公司);0.08%心肌细胞消化液(Trypsin 0.16 g;NaCl 1.6 g;NaHCO30.070 6 g);胎牛血清(FBS,以色列Biological Industries 公司);磷酸盐平衡液PBS(NaCl 8.00 g;KCl 0.20 g;Na2HPO41.56 g;KH2PO40.24 g;ddH2O 1 000 mL);胰蛋白酶(美国Gibco公司);葡萄糖0.198 2 g;KCl 0.059 6 g;HEPES 0.4 g;ddH2O 200 mL);YOYO-1染料(美国Invitrogen公司)4',6-二脒基-2-苯基吲哚(DAPI)(美国西格玛公司);溴脱氧尿核苷(Brdu,美国Sigma 公司);心肌肌钙蛋白I(cTnI)抗体(武汉博士德公司);Strept Actividin-Biotin Complex(SABC-FITC,小鼠IgG)(武汉博士德公司);腺苷三磷酸(ATP)检测试剂盒(瑞士罗氏公司);乳酸脱氢酶(LDH)试剂盒(南京建成);逆转录试剂盒(美国Invitrogen 公司);扩增试剂盒(美国Invitrogen 公司);0.4%台盼蓝(华美生物工程公司);Opti-MEM 培养基(美国Gibco 公司);辅酶(能气朗)Q10 片(Coenzyme Q10)(卫材(中国)药业有限公司,10 mg/片);参附益心方(SF,山东步长制药有限公司),1 g 浸膏≈9.5 g 生药,参附益心方浸膏得率10.5%。
2 方法
2.1 药液制备(现用现配)
2.1.1 参附益心方药液制备
参考相关文献[8],电子分析天平称取SF 浸膏干粉0.25 g,添加DMEM 培养液10 ml,吹打混匀,过滤器(0.22 μm)用于过滤和去除细菌,制成参附益心方母液(25 mg/ml)。
2.1.2 辅酶Q10药液制备
取辅酶Q10 片5 片,研磨压碎,加入5.8 ml DMEM培养基,用过滤器(0.22 μm)过滤,制成辅酶Q10 母液(1×10-2mol/L)。
2.2 原代心肌细胞的分离
取1-3 d 的SD 乳鼠,无菌条件下开胸取乳鼠心脏,弃去心房与心耳部位,获得心室部分,预冷PBS 缓冲液冲洗干净后将其剪成组织块(大小约1-2 mm3)。添加心肌细胞消化液后移至玻璃瓶中,放入37℃水浴锅中,振荡水浴6 min,多次消化,直到组织块变为白色透明(约7-8次),第一次消化后,自然沉淀,去上清,之后自然沉淀后留取上清。向上清液中加入相同量含10%FBS+DMEM 培养液后轻轻吹打制成细胞悬液,离心(1000 r/min)10 min。弃去上清,加入适量10%FBS+DMEM 培养基,吹打混匀,200 目筛网过滤,获得细胞悬液。
2.3 原代心肌细胞的培养
取“2.2”细胞悬液,种于25 cm2培养瓶中,置于37℃、5%的CO2培养箱,差速贴壁法1.5 h,抽出上清液,1000 r/min 离心5 min 后,弃上清得到心肌细胞,加入含10%FBS + DMEM 培养液吹打混匀,台盼蓝染色计算细胞数目,调整细胞浓度为4×105个/mL,接种于培养板,加入BrdU(0.1 mmol/L)抑制成纤维细胞的增殖。培养48 h,弃去上清液,加入DMEM 培养液,无血清同步化24 h。
2.4 原代心肌细胞的鉴定
培养3 d 后,弃培养液,加入4%多聚甲醛固定(10~20 min),滴加cTnI 多克隆抗体(兔多克隆抗体1∶50),4℃冰箱中孵育过夜。SABC-FITC 标记二抗(羊抗兔1∶100)避光孵育2 h 后,DAPI 染料避光5 min,水溶性封片剂封孔,在荧光倒置显微镜下观察并拍照。取拍照视野6 个,镜下计数细胞总数为(N1),计数荧光阳性细胞数作为心肌细胞数(n1),根据公式:心肌细胞比例=n1/N1×100%。
2.5 CCK-8筛选药物最合适浓度
将心肌细胞接种在96孔细胞板上,培养48 h后,无血清同步化24 h,分为Normal组、SF(参附益心方)组(浓度分别为0.1 mg/ml、0.25 mg/ml、0.5 mg/ml、0.75 mg/ml、1.0 mg/ml、1.5 mg/ml)、Coenzyme Q10 组(浓度分别为1×10-3mol/L、1×10-4mol/L、1×10-5mol/L、1×10-6mol/L、1×10-7mol/L),培养24 h 后,更换新鲜培养基,并且每孔加入CCK-8 试剂10 ul,CO2培养箱中避光孵育2 h,酶标仪检测OD值(λ=450 nm)。
2.6 建立缺氧模型
提取的原代心肌细胞在常氧条件下放置48 h,无血清同步化24 h,各缺氧组中加入YoYo-1 染料2 ul,通过惰性气体法制造心肌细胞缺氧模型,液氮罐供气,使得温箱气体成分调整为90%N2、5%O2、5%CO2,经过长时间细胞动态成像分析系统分析后,检测每组活细胞个数,最终确定最合适的缺氧时间为6 h。正常组氧含量正常。
2.7 实验分组及干预方法
确定各组最合适浓度及缺氧时间后,取“2.3”中培养成的原代心肌细胞,每孔中加入含10%FBS +DMEM 培养液2 mL,然后对细胞进行分组,即Model组、Normal 组、Coenzyme Q10 组(1 × 10-4mol/L)、SFL组(0.25 mg/mL)、SFH 组(0.5 mg/mL)五组,置于5%O2、5%CO2、90%N2条件下培养6 h,进行缺氧损伤(正常组除外)。
2.8 试剂盒检测原代心肌细胞ATP含量
采用荧光素酶发光法,通过酶标仪检测心肌细胞中ATP 的含量,前期处理方案及分组同“2.7”,给药和造模后,将上清液吸出丢弃,用PBS 在室温下洗涤2-3次,每次1 分钟,严格按照三磷酸腺苷(ATP)检测试剂盒的规定操作。
2.9 试剂盒检测原代心肌细胞乳酸脱氢酶(LDH)含量
具体步骤如下:2 μmol/mL 丙酮酸标准品用双蒸水稀释制作标准曲线,样品孔中分别加入20 μl 样血清,25 μl底物缓冲液(含0.3 M 乳酸),对照孔以蒸馏水替代血清,37℃孵育15 min,然后加入25 μl的2,4二硝基苯肼溶液(1 mM),37℃孵育15 min,然后加入氢氧化钠溶液(0.4 M),混匀,室温孵育5 min,酶标仪上测定OD 值(λ=420 nm)。代入标准曲线拟合公式,计算乳酸脱氢酶含量。
2.10 RT-PCR 检测线粒体ND-1、ND-2、COX、tfam 基因表达
前期处理方案及分组同“2.7”,缺氧条件培养6 h,RNA 提取 试剂盒 提取RNA,1 ug 总RNA 逆转 录 为cDNA,GAPDH 为内参,20 ul 体系扩增线粒体ND-1、ND-2、COX、tfam 基因,反应条件为:首先进行90 s 的95℃预变性后进行PCR 循环,然后进行10 s 的95℃变性,30 s 的60℃退火,共循环40 次。扩增结束后,缓慢加热升温,从65℃至95℃,建立关于PCR 的产物溶解曲线。2-ΔΔCT法计算各组基因的相对含量,具体各引物序列如下:ND-1 序列:上游引物:CTACATACAACTACGCAAAGGC,下游引物:GCTTAGAGCTAGTGTAAGGGAG,扩增 长 度166;ND-2 序 列:上 游引 物:TACCCGAAGTCACCCAAGGA,下游引物:GGCGCCAACAAAGACTGATG,扩增长度155;COX 序列:上游引物GTCTTGTTTGCTTTCTTTGC,下游引物:GGTACTGTCGTTCCAGACTATC,扩增长度:142;tfam 序列:上游引物:GTCAGCCTTATCTGTATTCCGA,下游引物:ACTTTTGCATCTGGGTGTTTAG,扩增长度131;GAPDH序列:上游引物:ACAGCAACAGGGTGGTGGAC,下游引物:TTTGAGGGTGCAGCGAACTT,扩增长度252 bp。2.11 用SPSS19.0 软件对所有实验结果进行统计分析,实验数据以xˉ±s表示,P<0.05 提示数据的变化趋势有差异性,P<0.01 提示有显著差异性。组间比较采用单因素方差分析。
3 结果
3.1 原代心肌细胞的鉴定
此次实验以山羊抗大鼠cTnI 作为一抗、采用免疫荧光法检测鉴定原代心肌细胞的纯度。使用差速贴壁法1.5 h 后,继续培养48 h,镜下观察原代心肌细胞呈星形或者梭形交织聚集生长,融合成单细胞层,局部致密区形成细胞簇,可见同步化搏动。cTnI 一抗荧光染料细胞胞质染色均匀,纯度达标(85%),符合细胞实验要求,具体数据参照前期本团队发表文章[9]。
3.2 参附益心方对原代心肌细胞活性的影响
结果显示,0.1、0.25、0.5 mg/mLSF 组细胞活性与对照组相比,差异无统计学意义(P>0.05);0.75、1.0、1.5 mg/mLSF 组可使细胞活性明显下降,与对照组相比,差异具有统计学意义(P<0.05)证明此浓度范围对心肌细胞产生毒副作用。基于此浓度摸索,之后选择SF浓度为0.25 mg/mL、0.5 mg/mL进行后续实验。
表1 缺氧条件下参附益心方对原代心肌细胞LDH含量的影响(± s)
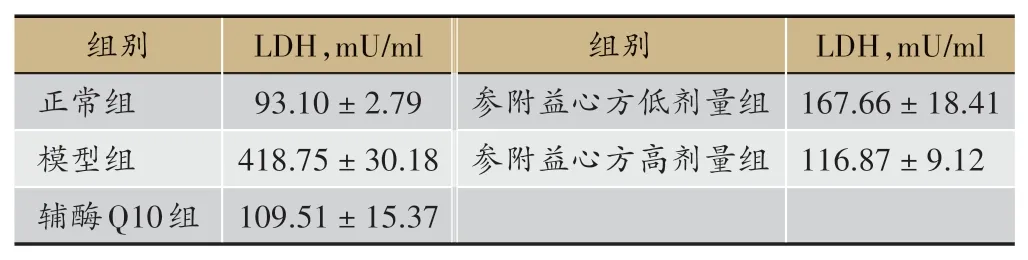
表1 缺氧条件下参附益心方对原代心肌细胞LDH含量的影响(± s)
组别正常组模型组辅酶Q10组LDH,mU/ml 93.10±2.79 418.75±30.18 109.51±15.37组别参附益心方低剂量组参附益心方高剂量组LDH,mU/ml 167.66±18.41 116.87±9.12

图1 缺氧条件下参附益心方对原代心肌细胞LDH含量的影响
3.3 Coenzyme 10对原代心肌细胞活性的影响
结果显示,1×10-3mol/L Coenzyme 10组细胞活性与对照组相比,细胞活性增加,差异有统计学意义(P<0.05);1×10-4、1×10-5、1×10-6、1×10-7mol/L Coenzyme 10 组细胞活性与对照组相比,差异无统计学意义(P>0.05);基于此浓度摸索,选择Coenzyme 10 浓度1 ×10-4mol/L组进行后续实验。
3.4 缺氧条件下参附益心方对原代心肌细胞ATP 含量的影响
前期结果表明,缺氧条件下原代心肌细胞ATP 含量与正常组相比明显降低,差异具有统计学意义(P<0.01);与Model 相比,SFH 组、辅酶Q10 均可提高缺氧条件下原代心肌细胞ATP含量(P<0.01)。具体数据参照前期本团队发表文章[10]。
3.5 缺氧条件下参附益心方对原代心肌细胞乳酸脱氢酶(LDH)含量的影响
结果表明,缺氧条件下原代心肌细胞LDH 含量与Normal 组相比明显升高,差异具有统计学意义(P<0.01);参附益心方、辅酶Q10 均可降低缺氧条件下原代心肌细胞LDH含量,与Model组相比,差异具有统计学意义(P<0.01),见表1、图1。
3.6 缺氧条件下参附益心方对mtDNA 相关基因表达的影响
缺氧条件下,ND-1、ND-2、COX、tfam 基因表达与其他各组相比明显降低,与Normal 组相比,差异具有统计学意义(P<0.05)。SFH组、辅酶Q10组ND-1基因表达可见明显升高,与Model组相比,具有统计学意义(P<0.05);SFH 组、SFL 组、辅酶Q10 组ND-2 基因表达可见明显升高,与Model组相比,具有统计学意义(P<0.05);SFH组、SFL组、辅酶Q10组COX基因表达可见明显升高,与Model组相比,具有统计学意义(P<0.05);SFH 组、SFL 组、辅酶Q10 组tfam 基因表达与Model组相比,无统计学意义(P>0.05)。
4 讨论
线粒体是细胞的能量工厂,在能量生产过程中发挥着重要作用。人类线粒体DNA 包含16569 对碱基,编码基因37 个,其中有13 种编码呼吸链复合体和ATP 合成酶,包含NADH 脱氢酶亚基1(ND-1)、NADH脱氢酶亚基2(ND-2)、环氧化酶(cycloxygenase,COX)等,它们是氧化磷酸化、电子传递链和ATP 合成的重要部分,其基因的突变或者表达的下降,都会影响呼吸链复合体I 酶活性降低,细胞内ATP 合成减少[11-13]。COX 基因对于线粒体呼吸链而言非常重要,是其重要组成部分之一,对ATP 的产生和功能意义重大[14],ND-1、ND-2 不仅是线粒体DNA 的编码基因,也是NADH脱氢酶的一个亚单位,而NADH 是线粒体呼吸链的起始酶和标志物,线粒体内ATP 大多数是经过NADH 的电子传递产生[15],故线粒体DNA 相关因子ND-1、ND-2、COX 基因在ATP 合成、能量代谢中的作用至关重要,其表达水平可以反映出线粒体能量代谢的水平[16],研究其表达对研究心衰治疗药物的作用靶点亦具有重要的意义。此外,线粒体转录因子A(tfam)是一种核基因编码的DNA 结合蛋白。tfam 基因不仅有助于维持线粒体DNA的结构,改善线粒体损伤[17-19],同时也参与氧化磷酸化及ATP 的合成,研究发现,tfam 对mtDNA 的转录、数量、功能维持起关键作用[20],其表达水平的提高,能促进线粒体的合成和数量,从而促进ATP 的合成[21]。综上所述,ND-1、ND-2、COX、tfam 基因的表达水平的改变可以反映出SF 对线粒体能量代谢的影响。乳酸脱氢酶是参与糖酵解和糖异生的重要酶,心力衰竭时心肌细胞处于缺氧状态,LDH 代偿性增加,通过糖无氧酵解以代偿性产生ATP 维持心肌细胞能量[22]。

图2 缺氧条件下参附益心方对原代心肌细胞ND-1、ND-2、COX、tfam基因表达的影响
祖国医学没有“心衰”病名,但其临床症状似属中医典籍水肿、喘症、心悸、胸痹范畴,且对此早有描述,如《金匮要略》:“心水者,其身重而少气,不得卧,烦而燥,其人阴肿”明确的说明其病理因素为“水”。另外,已有前期实验证实西方医学中“ATP”“能量”与祖国医学之“气”具有相似的理论与物质基础[4],心衰患者ATP 合成减少,心肌细胞能量匮乏,从而造成心脏储备力耗竭,中医典籍《伤寒明理论》言:“其心气虚者,由阳气内弱,心下空虚,正气内动而为悸也”对心衰的症状做了描述,且指出其“心气虚”,与ATP 合成减少、能量匮乏不谋而合。参附益心方是河南名医孙建芝教授的临床经验方,配伍精良,选方得当,其具体成分为人参、附子、桂枝、丹参、赤芍、益母草、猪苓、泽泻、葶苈子、砂仁、大枣,经前期研究此方辩证立足于心气虚[23],方中君药为人参,具有补益心气的功效,从西方医学来说,人参能改善心肌细胞的能量代谢,增加ATP 含量。参附益心方总括于阴阳,参之以“水”“淤”等病理因素,以活血化瘀、益气温阳、利水消肿为治法,对于心衰患者效如桴鼓。
经过前期临床研究和实验研究发现,心衰时心肌收缩力降低,心脏输出量减少,缺血缺氧的病理状态使得心衰症状加重,而参附益心方可以增加心肌收缩力、增加ATP 合成,以保护心肌细胞,减轻心力衰竭症状[5-7]。本次实验目的在于探究缺氧条件下参附益心方对心肌细胞线粒体DNA 基因的表达作用。实验结果显示:与Normal 组对比,Model 组ATP 合成减少,LDH 合成增加,ND-1、ND-2、COX、tfam 基因表达下降,说明缺氧条件下,原代心肌细胞线粒体内相关基因表达下降,ATP 合成减少,能量代谢障碍;与Model组对比,SF 组可提高大鼠心肌细胞ATP 含量,降低LDH 含量,增加ND-1、ND-2、COX 基因的表达,因此参附益心方可能通过作用于心肌细胞线粒体的基因表达,来提高ATP的合成,降低LDH 合成,以保护心肌细胞,稳定线粒体膜电位,对缓解心衰患者临床症状与维持心肌细胞能量代谢意义重大。
