ALG3作为潜在生物标志物在膀胱癌组织中的表达及其临床意义
2020-07-29李伯全康胜虎王蕊
李伯全 康胜虎 王蕊
中国人民解放军联勤保障部队第983医院泌尿外科,天津300142
0 引 言
膀胱癌发病率高,是世界上最常见的癌症之一[1]。世界上,每年有将近43万人被诊断为膀胱癌[2]。通常,膀胱癌可分为肌肉浸润性膀胱癌(muscleinvasive bladder cancer,MIBC)和非肌肉浸润性膀胱癌(non-muscle invasive bladder cancer,NMIBC)。据统计,NMIBC占膀胱癌的70%,而MIBC仅占膀胱癌的30%,但80%的NMIBC在后期会发展为MIBC[3]。2012年,美国的一项全国性统计调查结果显示,每10万美国人中就有近7人患有膀胱癌,这一发病率在所有恶性肿瘤中居第9位[4]。膀胱癌的发生没有年龄限制,任何年龄阶段的人群都有可能会患此病,但其发病率随年龄增长而增加,其最高发年龄段为50~70岁,且膀胱癌也呈现出明显的性别特征,男性的发病率是女性的3~4倍[5]。尽管近年来针对膀胱癌的治疗已取得了很大的发展和进步[4],但目前膀胱镜检查和尿细胞学检查仍是膀胱癌的主要诊断和监测手段[6]。但是,这些技术存在很大的局限性,在很多时候不能提供令人满意的结果[7]。因此,开发与膀胱癌发生过程中基因变化相关的新型标记物[8],有助于更好地认识、监测及治疗膀胱癌,并改善膀胱癌患者的临床预后。
天冬酰胺连接糖基化 3(asparagine-linked glycosylation 3,ALG3),即 α-1,3-甘露糖基转移酶,是ALG家族成员,位于染色体3q27.1区[9]。ALG3的上调可能影响食管鳞癌的淋巴结转移。此外,上调的ALG3可刺激宫颈癌细胞的增殖[10]。多项研究结果表明,ALG3在各种癌症中都有显著表达,且提示不良预后。其中,ALG3在头颈部鳞状细胞癌中表达显著。有研究者对ALG3在乳腺癌中的表达特征进行了研究,证明ALG3在癌症中的高表达特征,并提示不良预后[11-12]。大量的研究结果表明,ALG3有望作为许多癌症的诊断生物标志物和治疗靶点。但是,关于ALG3在膀胱癌中的临床病理意义和功能作用的研究较少,有待进一步探讨。
本研究中,旨在探讨ALG3在膀胱癌组织及相应正常组织中的相对表达及其与临床预后的关系,有助于更好地认识ALG3在膀胱癌发展中的作用机制,从而对研究监测及治疗膀胱癌的新方法有十分重要的意义。
1 资料和方法
1.1 临床资料
选择2010年1月至2018年12月,中国人民解放军联勤保障部队第983医院泌尿外科收治的经手术治疗的膀胱癌患者87例。其中,男性59例,女性28例,年龄58.3岁±65.9岁。全部病例均经过临床病理证实,并具有完整的病例资料。收集患者的肿瘤组织样本和相应的癌旁正常组织样本。根据AJCC-TNM-2010分类系统和WHO/ISUP-2016系统分别评估肿瘤分期和分级[13-14]。本研究以1964年赫尔辛基宣言和随后所有修订案中规定的道德标准为基础,所有患者均签署知情同意书。
1.2 方法
1.2.1 主要材料与仪器
山羊血清封闭液、免疫组化二抗试剂盒(北京中杉金桥生物技术有限公司),二氨基联苯胺(3,3’-diaminobenzidine,DAB)(北京康为世纪生物科技有限公司)。
RM2235型石蜡切片机、光学显微镜(德国Leica公司)。
1.2.2 免疫组织化学检测方法
将病理组织石蜡包埋并切片,此后放入58℃的烘箱中45 min;然后将切片先后放进2个二甲苯罐中各处理10 min,梯度乙醇溶液处理(100%、90%、75%,各5 min);将处理过的切片用磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤 5 min,重复 3 次;将切片浸泡在体积分数为3%的H2O2溶液中处理10 min,避免非特异性染色;PBS洗涤3次;将切片放在质量分数为0.05%的胰蛋白酶溶液中,37℃孵育30 min,再冷却至室温,以修复抗原;PBS洗涤3次;将山羊血清滴加到组织块上,室温封闭30 min,根据切片上组织块的大小加入抗体,室温孵育2 h;PBS洗涤3次;吸取适量二抗滴加于组织切片上,37℃下反应 40 min;PBS洗涤 3次;DAB显色 1~4 min,根据染色情况适时终止染色;用自来水冲洗6 min;用适量苏木精复染,随后在PBS中返蓝;将组织切片用梯度乙醇溶液处理(80%、11 s,90%、11s,100%,6 min、100%、6min),然后浸入二甲苯中处理5 min;用中性树胶进行封片,晾干;用显微镜观察并采集图像。
组织中出现棕黄色颗粒,则认为该组织为阳性染色,随机选取5个不同的视野,按照阳性细胞在总细胞数中的比例进行评定。阳性细胞比例评分标准:肿瘤细胞阳性百分数为0%时,记0分;1%~29%时,记 1分;30%~65%时,记 2分;66%~100%时,记3分。阳性染色强度评分标准:阴性染色记0分;弱阳性染色记1分;中阳性染色记2分;强阳性染色记3分。以阳性细胞百分比评分和染色强度评分的乘积判断表达情况,其中结果<1时,记为0分;结果为1~3时,记为1分;结果为4或6时,记为2分;结果为9时,记为3分。
1.2.3 临床样本生物信息学分析
通过基因表达谱交互分析(gene expression profiling interactive analysis,GEPIA)数据库获取临床样本432个,其中包括404例膀胱癌组织样本和28例癌旁正常组织样本。通过GEPIA数据库分析ALG3的mRNA在膀胱癌组织和癌旁正常组织中的差异。
1.3 统计学方法
采用Graphpad8.0软件处理数据。计量资料采用均值±标准差(Mean±SD)表示;组间比较采用学生t检验;利用χ2分析临床病理特征与蛋白表达的关系。以P<0.05表示差异有统计学意义。
2 结 果
2.1 生物信息学分析结果
ALG3在多种肿瘤中异常表达并提示不良预后。为了更好地阐明ALG3在膀胱癌中的作用,通过GPEIA分析ALG3的mRNA在膀胱癌组织和正常组织的表达情况,共分析膀胱癌组织404例及正常组织28例。结果表明,ALG3的mRNA在膀胱癌组织中显著高表达(图1)。为了进一步研究ALG3的表达与膀胱癌患者长期预后的关系,利用Kaplan-Meier分析了ALG3在膀胱癌患者预后中的作用。结果表明,ALG3表达较低的患者中,总生存率和无病生存率都较高(图2A和2B)。结果提示,ALG3的表达与膀胱癌患者的生存期具有显著的相关性,提示ALG3的异常表达可能与膀胱癌患者的不良预后相关(图 2)。
2.2 ALG3在膀胱癌组织中的表达
免疫组化结果显示,ALG3主要定位于胞浆,其在膀胱癌组织中高表达(图3A),而在癌旁正常组织中ALG3的表达显著降低(图3B),这表明ALG3可能影响膀胱癌的生长和发展。根据染色强度,将膀胱癌患者分为ALG3高表达组和ALG3低表达组。
2.3 ALG3蛋白表达水平与膀胱患者的临床病理特征的相关性
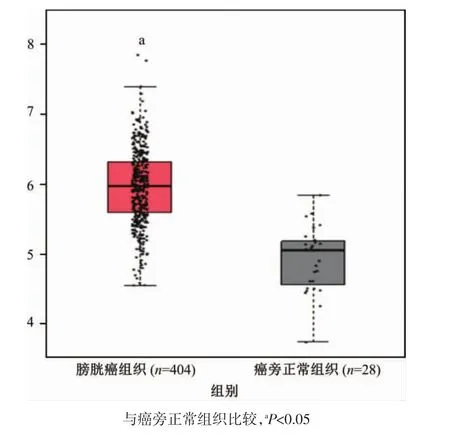
图1 膀胱癌中ALG3的mRNA表达
为了阐明ALG3在膀胱癌进展中的作用,分析比较了ALG3高表达组和ALG3低表达组患者的临床病理特征差异,包括年龄、性别、肿瘤分期、肿瘤分级、淋巴结转移和肿瘤复发率。分析结果表明,ALG3表达水平与肿瘤分期(P<0.05)和肿瘤复发(P<0.05)密切相关,而与年龄(P>0.05)、性别(P>0.05)、肿瘤分级(P>0.05)和淋巴结转移(P>0.05)无显著相关性。(表1)
3 讨论和结论

图2 ALG3表达与膀胱癌患者生存率的相关性
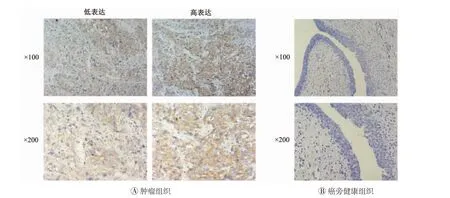
图3 膀胱癌肿瘤组织和癌旁健康组织中天冬酰胺连接糖基化3的免疫组化结果
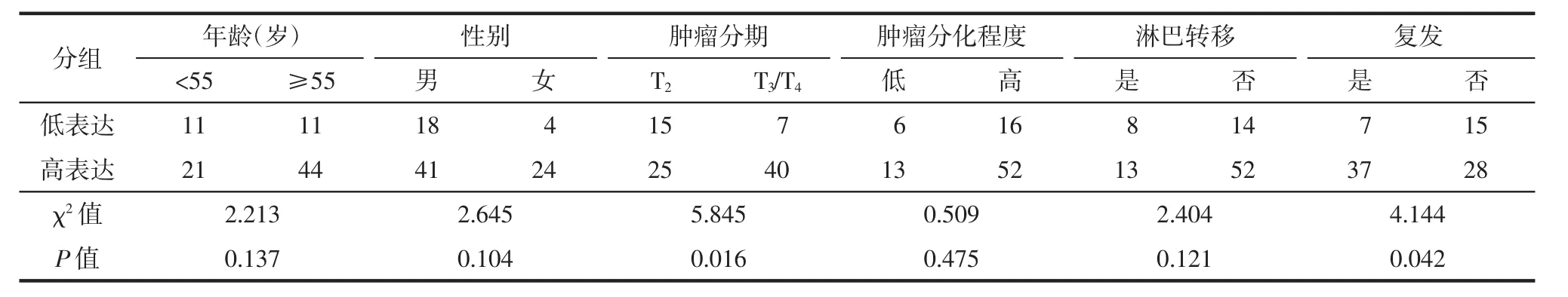
表1 天冬酰胺连接糖基化3蛋白表达与膀胱癌患者临床病理特征的相关性分析
膀胱癌是一种起源于膀胱黏膜的恶性肿瘤[15-16],可发生在任何年龄,且发病率随年龄的增长而上升[17]。常用的膀胱癌检查方法有膀胱镜、电子计算机断层扫描、球镜和膀胱造影[18]。目前为止,手术治疗仍是膀胱癌的主要治疗方法,而膀胱内治疗通常为辅助治疗手段[19-20]。接受手术治疗的膀胱癌患者预后差、5年生存率低、复发率高、生活质量差。近年来,核基质蛋白22(nuclear matrix protein 22,NMP22)、G蛋白偶联受体(Gprotein-coupled receptor 158,GPR158)、GPR25等新治疗靶点被陆续发现[21-22],但其功能有待进一步验证。有研究者发现,ALG3在头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)、乳腺癌等多种癌症中显著表达,提示ALG3很可能在许多癌症中高表达。还有研究者对ALG3在乳腺癌中的表达特征进行了研究,且证明了ALG3在乳腺癌组织中的高表达,且提示不良预后[11-12]。
以往的研究结果表明,ALG3参与了多种癌症的发生和发展。ALG3是3q27扩增的一个新的生物标志物,在食管鳞癌、宫颈癌和乳腺癌中高表达,尤其在淋巴结转移患者中表达更为明显[23]。有报道显示,ALG3的高表达与乳腺癌患者和急性髓系白血病(acute myeloid leukemia,AML)患者的低总生存时间显著相关[11]。最新研究结果表明,在HNSCC组织中,ALG3的mRNA水平高表达,蛋白酪氨酸激酶F相互作用蛋白1(protein tyrosine phosphatase finteracting protein 1,PPFIA1)和 ALG3的联合高表达与不良预后有明显关系[12]。一项最新研究结果表明,ALG3在乳腺癌中高表达,并提示不良预后[11]。
本研究中,发现在膀胱癌组织中ALG3的mRNA表达水平高于正常组织,且ALG3表达较低的患者的总生存率和无病生存率都较高,但是需要进一步的研究来揭示更详细的分子机制。另外,ALG3在膀胱癌肿瘤组织中的高表达与肿瘤分期和肿瘤复发显著相关(均P<0.05),但与年龄、性别、肿瘤分级和淋巴转移无关(均P>0.05)。而且,生物信息学分析结果表明ALG3的表达与膀胱癌患者的长期预后存在相关性,在ALG3表达较低的患者中,总生存率和无病生存率都较高。
综上所述,本研究有助于更好地理解和认识ALG3与膀胱癌之间的关系,所得的研究结果提示ALG3有望成为膀胱癌重要的治疗靶点和预后标志物。因此,笔者下一步将更加具体、更加全面地研究ALG3在膀胱癌中的功能和作用,如通过沉默ALG3、构建小鼠模型等方式研究ALG3对膀胱癌细胞的增殖、迁移等的影响。
利益冲突所有作者均声明不存在利益冲突
