医用羧甲基葡糖胺聚糖凝胶生物安全性评价
2020-07-29程琳李睿智程鹏祝君梅李昕李东风于欢王世炜史梦柔陈斌高萍
程琳 李睿智 程鹏 祝君梅 李昕 李东风 于欢 王世炜 史梦柔陈斌 高萍
1天津市医药科学研究所300020;2爱美客技术发展股份有限公司,北京100022
0 引 言
在温度、催化剂等条件引发下,自交联凝胶原液可通过单体聚合、高分子交联等途径在原位上自行相变为弹性凝胶状。自交联凝胶临床上已被用于关节腔、腹腔、骨、神经等外科手术,其可在腔隙中局部成型并附于创面,形成暂时的物理隔绝,预防局部组织粘连。同时还可抑制创口处的成纤维细胞聚集和新生血管形成,起到抑制瘢痕的效果[1]。常用的聚乳酸防粘连凝胶生物相容性良好,但其降解产物为酸性物质,影响抗炎性能[2-3]。相比于固体防粘连材料需额外与组织缝合固定、手术创伤较大[4],自交联透明质酸钠凝胶润滑性较好,适用于关节囊和妇科手术中预防组织粘连[5-6],但其易从创面周围的缝隙流出[7],且降解过快,影响防粘连效果[8]。医用羧甲基葡糖胺聚糖凝胶具有给药方便、创伤小、自黏附并紧密贴敷创面的优势,更利于创面与外界的物理隔绝,防粘连效果更佳[9]。
本研究采用的是市售的医用羧甲基葡糖胺聚糖凝胶,其植入体内成胶后固定性能好,降解期长,具有一定的抗炎性能和机械性能,有兼作医用黏附剂的潜力,可通过局部填充占位和自身的抗粘连生物活性起到很好的抗粘连效果。已有研究者通过动物实验发现,该产品可有效防止椎板切除术后瘢痕粘连形成,且对实验动物无毒副作用[10]。
因医用羧甲基葡糖胺聚糖凝胶拟用于体内,且需长期存留,故对其生物安全性有严格要求,加之其构成较为复杂,生物相容性检验显得尤为重要。本研究旨在通过鼠伤寒沙门氏菌回复突变实验(Ames实验)、体外染色体畸变实验和体外基因突变实验对医用羧甲基葡糖胺聚糖凝胶的遗传毒性进行较为全面的检测,并检测其急性全身毒性、热原性和溶血性,以验证其生物安全性。
1 材料与方法
1.1 主要材料与仪器
医用羧甲基葡糖胺聚糖凝胶(批号20141008,爱美客技术发展股份有限公司),小鼠淋巴瘤细胞L5178Y、中国仓鼠肺成纤维细胞(中国科学院上海生命科学研究院细胞资源中心),组氨酸缺陷型鼠伤寒沙门氏菌 TA97、TA98、TA100、TA102(天津市疾病预防控制中心),胎牛血清、RPMI-1640培养液(美国Gibco公司),1,8-二羟基蒽醌(美国Fluka公司),2-氨基芴、敌克松、6-巯基鸟嘌呤、7,12-二甲基苯蒽(美国Sigma公司),2,4-二硝基氯苯(天津市光复精细化工研究所),注射用丝裂霉素(批号100110,浙江海正药业股份有限公司),注射用环磷酰胺(批号10110621,江苏恒瑞医药股份有限公司),甲基磺酸乙酯(上海试剂一厂),氯化钠注射液(批号9J93B,中国大冢制药有限公司)。肝微粒体酶(S9)液由笔者采用苯巴比妥和β-萘黄酮联合诱导大鼠获得,其蛋白含量和活力经测定均符合要求,实验时将S9液与6-磷酸葡萄糖、氧化性辅酶Ⅱ、KCl等辅助因子配制成S9混合液。
健康无特定病原体级雄性昆明种小鼠20只,5~6周龄,体质量范围19.6~22.5 g,购自中国人民解放军军事医学科学院卫生学环境医学研究所动物实验中心,许可证号为SCXK(军)2009-003。健康普通级雄性日本大耳白兔5只,3月龄,体质量范围2.1~2.6 kg,购自北京隆安实验动物养殖中心,许可证号为SCX K(京)2011-0003。
HERAcellTM150i CO2培养箱(美国Thermo Fisher Scientific公司),SW-CJ-2F超净工作台(上海善志仪器设备有限公司),Microphot-FXA倒置显微镜(日本Nikon公司),T200电子天平(常熟市双杰测试仪器厂),CL-32L高压灭菌器(日本ALP公司),ZRY-2D智能热原仪(天津市天大天发科技有限公司),T6紫外可见分光光度计(北京普析通用仪器有限责任公司)。
1.2 方法
1.2.1 凝胶浸提液的制备
医用羧甲基葡糖胺聚糖凝胶按照专利配制[11],羧甲基葡糖胺聚糖胶体液和戊二醛溶液分别装载于双联注射装置的A管和B管中,推针注射时,这两种液体在共同针头处自动混合反应,快速形成凝胶。推针时A、B管均推弃初始的0.5 ml,余下的2.0 ml被推注于无菌容器中(共推注4.0 ml),静置30 min待凝胶凝固后,按不同的浸提比例向凝固凝胶中加入不同的浸提介质制备浸提液。其中Ames实验是按浸提比例0.2 g/ml分别加入氯化钠注射液和二甲基亚砜(dimethyl sulfoxide,DMSO),于 37℃振荡培养箱中浸提72 h;急性全身毒性实验和热原实验均按浸提比例0.2 g/ml加入氯化钠注射液,于37℃振荡培养箱中浸提72 h;体外染色体畸变实验和体外基因突变实验均按浸提比例0.2 g/ml加入空白培养基,于37℃CO2培养箱中浸提72 h;溶血实验则按浸提比例0.5 g/ml加入氯化钠注射液,于37℃水浴中浸提30 min。
1.2.2 遗传毒性实验
结合图9、图10可以得到,方铅矿具有较好浮选回收率的矿浆电位区间与元素硫存在的电位-pH区间大致重合,这是因为在此区间内生成的元素硫具有良好的疏水性,从而提高了方铅矿浮选回收率。当矿浆电位过低时,溶液具有强还原性,此时硫元素会被还原成亲水性的两性离子HS-,使矿物疏水性减弱,回收率降低。当矿浆电位过高时,溶液呈强氧化性,会生成PbO,形成亲水钝化层[8],同样会影响方铅矿浮选,使回收率降低。
1.2.2.1 Ames实验
采用平板渗入法进行Ames实验,在活化(+S9)和非活化(-S9)条件下,TA97、TA98、TA100、TA102菌株均设凝胶盐水浸提液组、凝胶DMSO浸提液组、盐水对照组(氯化钠注射液)、DMSO对照组和阳性对照组。阳性对照组设2个平行培养皿,其余每组设3个平行培养皿。其中活化条件下阳性对照为2-氨基芴(200μg/皿),非活化条件下阳性对照为敌克松(50 μg/皿,TA97、TA98、TA100)和 1,8-二羟基蒽醌(50 μg/皿,TA102)。将 0.1 ml受试菌液、0.1 ml浸提液或对照液与2 ml温顶层琼脂液混合,快速倒入已铺好底层琼脂的平皿中,凝固后反转平皿,于37℃条件下培养72 h,计数每皿回变菌落数。
1.2.2.2 体外染色体畸变实验
在活化(+S9)和非活化(-S9)条件下,均设阴性对照组(空白培养基)、阳性对照组和3个剂量组(凝胶培养基浸提液组和1/2、1/4凝胶培养基浸提液组)。活化条件下阳性对照为环磷酰胺(终质量浓度为20μg/ml),非活化条件下阳性对照为丝裂霉素(终质量浓度为0.25μg/ml)。将中国仓鼠肺成纤维细胞传代培养24 h后弃去培养液,活化各组加入浸提液或对照液作用6 h,非活化各组加入浸提液或对照液作用24和48 h。活化各组作用结束后吸弃培养液,洗涤细胞,加入新鲜完全培养基继续培养至24 h,收获细胞;非活化各组作用结束后收获细胞。各组均于收获细胞前4 h加入秋水仙素(终质量浓度为10μg/ml)使细胞停止在中期分裂相。对收获的细胞进行离心、低渗、固定、制片和姬姆萨(Giemsa)染色,光学显微镜下各组选择100个分散良好的中期分裂相进行染色体畸变分析,统计畸变细胞数。
1.2.2.3 体外基因突变实验
在活化(+S9)和非活化(-S9)条件下,均设阴性对照组(空白培养基)、阳性对照组和3个剂量组(凝胶培养基浸提液组和1/2、1/4凝胶培养基浸提液组)。活化条件下阳性对照为甲基磺酸乙酯(终质量浓度为10μg/ml),非活化条件下阳性对照为7,12-二甲基苯蒽(终质量浓度为25μg/ml)。将L5178Y细胞传代培养24 h,消化、计数调整细胞浓度为5×105个/ml;活化各组加入浸提液或对照液于50 ml离心管中37℃、70~80 r/min振荡培养4 h,非活化各组同条件下振荡培养24 h;离心,弃上清,重悬后调整细胞浓度为2×105个/ml;当天取适量细胞悬液,梯度稀释后接种于96孔板中(1.6个/孔),置于37℃、5%CO2培养箱中培养12 d,计数每块平板有集落生长的孔数,计算第0天的平板接种效率(PE0);将上述所得细胞悬液作2 d表达培养,结束后取适量表达后的细胞悬液,梯度稀释并接种于96孔板中,培养12 d后计数每块平板有集落生长的孔数,计算第2天的平板接种效率(PE2)及细胞相对存活率(relative survival,RS)。取适量2 d表达培养后的细胞悬液,调整细胞浓度后(1×104个/ml)加入三氟胸苷,混匀,接种于96孔板中(2 000个/孔),于37℃、5%CO2培养箱中培养12 d,计数有突变集落生长的孔数,突变集落按大、小集落分别计数,再计算大集落突变频率(large colony mutation frequency,L-MF)、小集落突变频率(small colony mutation frequency,S-MF)、总突变频率(total mutationfrequency,T-MF)和小集落突变百分率(percentage of small colony mutants,SCM)。
1.2.3 热原实验
日本大耳白兔于普通级动物室中单笼饲养,室温20~25℃,相对湿度40%~70%,光照节律为12 h光照/12 h黑暗,自由进食饮水。采用自动热原仪对通过体温初筛的大耳白兔进行肛温测量,每隔0.5 h测量1次,一般测2次,两次体温之差≤0.2℃即符合要求,以这两次体温的均值作为该兔的正常体温。在测定正常体温后15 min内,自兔耳缘静脉缓缓注入38℃预热的凝胶盐水浸提液(10 ml/kg)。注射后每隔0.5 h用自动热原仪测量兔体温1次,共测6次,以6次体温中的最高体温减去正常体温即为该兔体温的升温值。
1.2.4 急性全身毒性实验
1.2.5 溶血实验
采用直接接触法检测医用羧甲基葡糖胺聚糖凝胶的溶血性能,设样品组、阴性对照组和阳性对照组,每组3个50 ml锥形瓶;样品组每瓶中放入医用羧甲基葡糖胺聚糖凝胶5.0 g,再加入10 ml氯化钠注射液;阴性对照组每瓶中加入10 ml氯化钠注射液;阳性对照组每瓶中加入10 ml蒸馏水;将上述锥形瓶37℃水浴30 min;每瓶加入0.2 ml稀释后的抗凝兔血,轻轻摇匀,继续37℃水浴60 min;将各瓶中的液体分别转入离心管中,800×g离心5 min,取上清,采用分光光度计在545 nm波长处测定上清的吸光度值,计算样品的溶血率。
1.3 统计学方法
采用SPSS11.5统计学软件处理数据,符合正态分布的计量资料采用均值±标准差(Mean±SD)表示,计数资料采用百分比表示,计数资料比较采用χ2检验,体外细胞基因突变实验数据比较采用Z检验,急性全身毒性实验数据比较采用重复测量资料方差分析,以P<0.05为差异具有统计学意义。
2 结 果
2.1 Ames实验
Ames实验结果见表1,在活化和非活化条件下,阳性对照组4种菌株的回变菌落数均超出阴性对照组的3倍;凝胶盐水浸提液组和凝胶DMSO浸提液组与相应的阴性对照组比较,4种菌株的回变菌落数均未达到后者的2倍,表明医用羧甲基葡糖胺聚糖凝胶对组氨酸缺陷型鼠伤寒沙门氏菌TA97、TA98、TA100和TA102无致突变性。
2.2 体外染色体畸变实验
由表2可知,非活化条件下阳性对照组细胞的染色体畸变率为17%(24 h)和19%(48 h),活化条件下阳性对照组细胞的染色体畸变率为16%(24 h),分别高于同条件下的阴性对照组,差异均具有统计学意义(均P<0.01);在非活化条件和活化条件下,3个剂量组(凝胶培养基浸提液组和1/2、1/4凝胶培养基浸提液组)细胞的染色体畸变率均为0,各剂量组间无量效关系,表明医用羧甲基葡糖胺聚糖凝胶无诱发中国仓鼠肺成纤维细胞染色体畸变的作用。
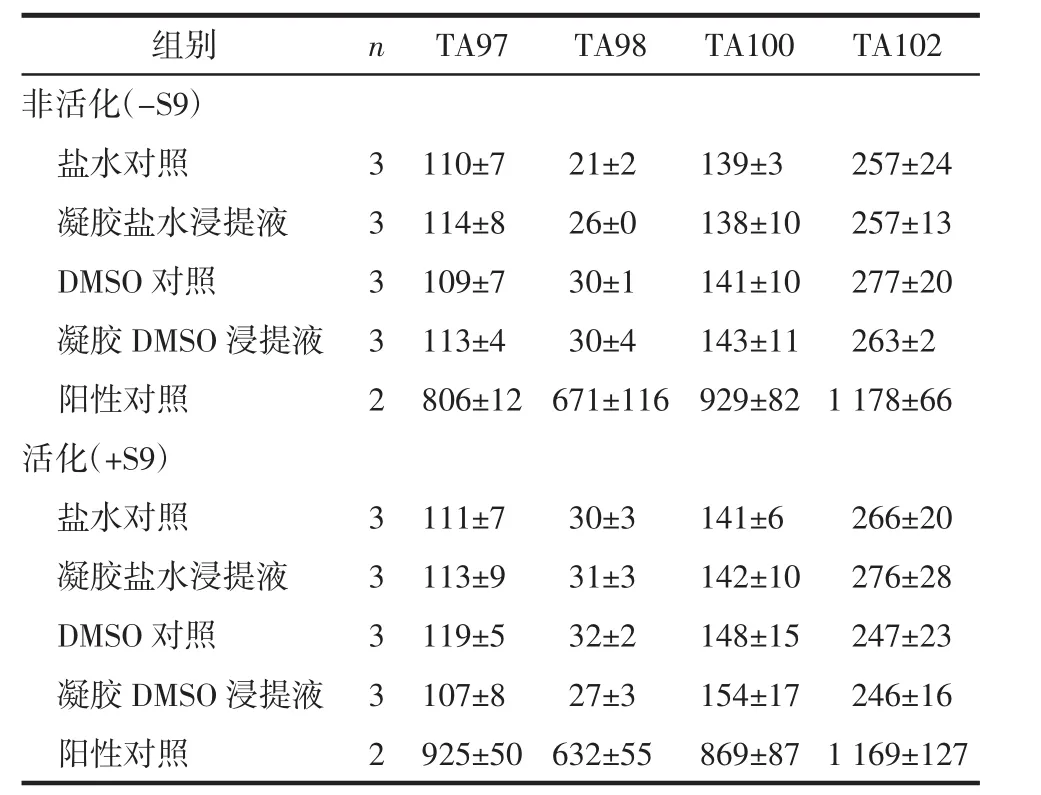
表1 医用羧甲基葡糖胺聚糖凝胶对组氨酸缺陷型鼠伤寒沙门氏菌回变菌落数的影响(个/皿,Mean±SD)
2.3 体外细胞基因突变实验
由表3可知,在活化和非活化条件下,阴性对照组的PE0、PE2、T-MF和SCM均在规定范围内;阳性对照组的T-MF均达到阴性对照组的2倍以上;3个剂量组(凝胶培养基浸提液组和1/2、1/4凝胶培养基浸提液组)诱发的L-MF、S-MF和T-MF均呈剂量依赖性增长,但差异均无统计学意义(均P>0.05)。
2.4 热原实验
由表4可知,注射凝胶盐水浸提液后,3只日本大耳白兔的体温升温值均<0.6℃,体温升温值总和<1.3℃,未见凝胶有热原反应。
2.5 急性全身毒性实验
急性全身毒性实验结果显示,分别经静脉注射和腹腔注射凝胶盐水浸提液和氯化钠注射液(对照)后 4、24、48和 72 h,各组小鼠均无死亡,小鼠活动及精神状态良好,大小便正常,肉眼未见任何毒性反应症状;且由表5可知,随着注射后时间的延长,样品组(静脉注射、腹腔注射)与对应的对照组(静脉注射、腹腔注射)小鼠体质量均有所增长,但两组间比较差异均无统计学意义(均P>0.05)。
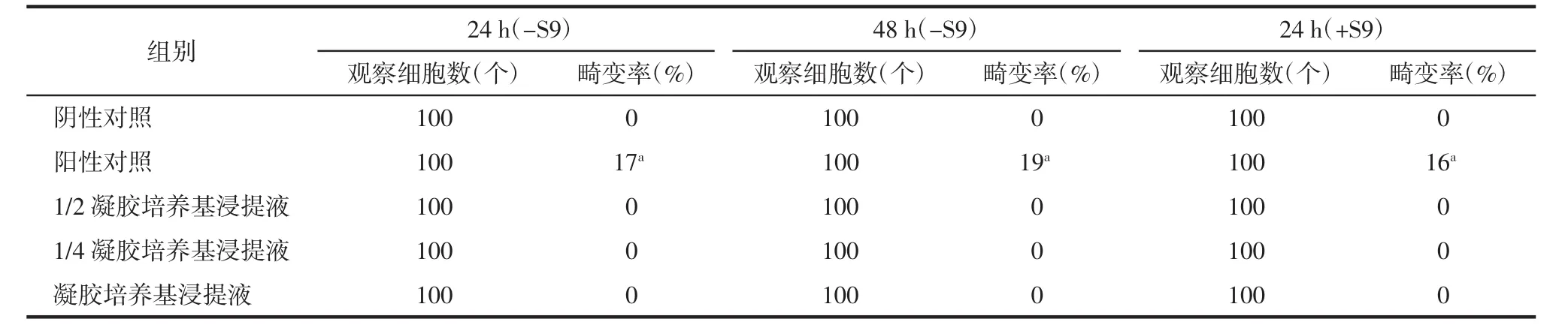
表2 医用羧甲基葡糖胺聚糖凝胶作用不同时间对体外中国仓鼠肺成纤维细胞染色体畸变率的影响
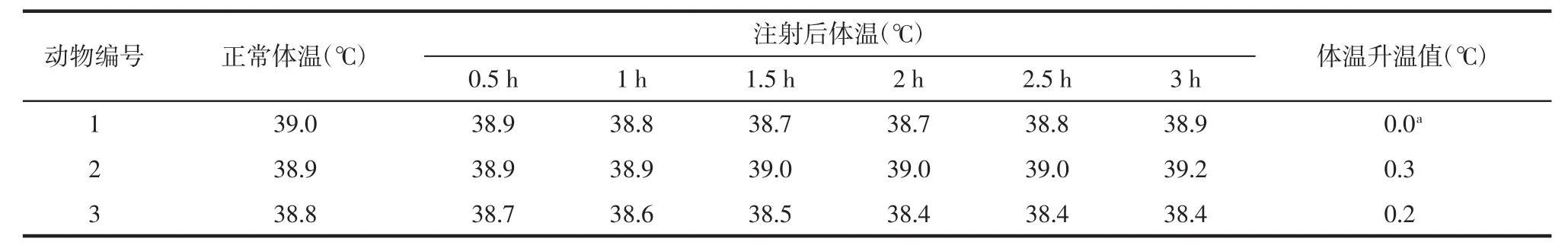
表4 耳缘静脉注射羧甲基葡糖胺聚糖凝胶盐水浸提液后不同时间3只日本大耳白兔的体温变化

表5 注射后不同时间各组小鼠的体质量变化(g,Mean±SD)
2.6 溶血实验
溶血实验结果显示,阴性对照组、阳性对照组和样品组的平均吸光度值分别为0.002、0.834和0.003,计算得到医用羧甲基葡糖胺聚糖凝胶的溶血率为0.1%,表明该凝胶无溶血作用。
3 讨论与结论
羧甲基葡糖胺聚糖凝胶是一种新型医用抗粘连材料,其配方新颖,成分较多,使用时反应相对复杂,且预期要在体内长期存留,尤其是用于神经外科时,血脑屏障完整性受损,对检品的生物安全性要求更为严苛。本研究依据国家标准,同时考虑到医用羧甲基葡糖胺聚糖凝胶产品的自身特点和预期临床应用,选择了相应的体内外安全性实验对产品的生物相容性进行了较为全面的检测。
遗传毒性研究的目的是检测受试物是否能引起遗传物质损伤,从而导致细胞衰老、突变、癌变和遗传性状的改变,并评价其对人体的潜在致畸、致癌和致突变作用,是生物安全性评价的重要环节。经多年发展,遗传毒性研究已形成了多种实验体系,涉及的微核实验、Ames实验、DNA损伤实验、体外基因突变实验等各有优劣。研究结果表明,受试物在一种遗传毒性实验中可诱发某种基因突变,但在另一种遗传毒性实验中未必会诱发基因突变,若该受试物在多种遗传毒性实验中均能诱发基因突变,才表明其可能对人体有潜在的遗传毒性作用。因此,依据国家标准,在安全性评价中需要将不同原理、覆盖不同遗传学终点的遗传毒性实验组合使用,以提高遗传毒性实验的准确性和效率。
本研究选择Ames实验、体外染色体畸变实验和小鼠淋巴瘤细胞胸苷激酶基因突变实验综合评价医用羧甲基葡糖胺聚糖凝胶的遗传毒性。其中Ames实验可检测不同类型的基因突变,如TA97、TA98菌株检测移码突变,TA100、TA102菌株检测碱基置换和移码突变,该实验高效、经济且灵敏[12-13];体外染色体畸变实验可检测导致动物细胞染色体异常的种类,包括染色体结构裂隙、断裂、缺失、微小体及着丝粒环等诸多终点改变[14];小鼠淋巴瘤细胞胸苷激酶基因突变实验不仅可检测点突变等小的基因突变,还可检测染色体水平胸苷激酶基因位点的缺失、移位等大的遗传突变[15]。本研究中上述3项实验结果显示,在活化和非活化条件下,阴性对照组和阳性对照组的检测结果均有明显差异,符合实验成立条件;阴性对照组和凝胶浸提液组的检测结果均无明显差异,凝胶浸提液各剂量组的L-MF、S-MF和T-MF均未出现明显升高,故可判定医用羧甲基葡糖胺聚糖凝胶不具有遗传毒性。
细菌内毒素实验和热原实验均能对医疗产品的热原性进行检测。其中细菌内毒素实验是针对脂多糖这一类热原性物质的特异性检测,而热原实验的检测谱广,能检测出包括细菌内毒素在内的多种生物和化学成分的热原物质[16],更适用于本研究中构成较为复杂的医用羧甲基葡糖胺聚糖凝胶产品的热原性检测。
急性全身毒性实验是认识和研究药物对机体毒性反应的第一步。本研究采用了腹腔注射和静脉注射两种给药方式,全面研究了医用羧甲基葡糖胺聚糖凝胶的水溶性和脂溶性浸提物对全身毒性的影响,为进一步设计相关毒性实验提供了依据。
受试物产生溶血的原因包括受试物材料表面机械损伤和材料可溶性残余低分子化学作用两方面。针对医用羧甲基葡糖胺聚糖凝胶构成较复杂的特点,本研究评价了凝胶材料残余单体及低分子物质在体外环境下的急性溶血机能。结果显示,阴、阳性对照均符合要求,样品组溶血率仅为0.1%(溶血率<5%即合格),可认为医用羧甲基葡糖胺聚糖凝胶无体外溶血作用。
本研究将羧甲基葡糖胺聚糖胶体液和戊二醛溶液混合,短时间内凝集后,再进行浸提,评价其生物安全性。该自交联凝胶的3项遗传毒性实验、急性全身毒性实验、热原实验和溶血实验的实验结果均符合医用生物材料的要求,这为该材料的预期临床使用提供了依据,为排除可能的危害提供了科学依据,也为其他成分和反应较复杂的生物材料的安全性评价提供了思路。
利益冲突所有作者均声明不存在利益冲突
