摩腹力学刺激对腹泻型肠易激综合征大鼠肠神经系统的影响
2020-07-29骆雄飞刘斯文李华南张玮王金贵黎波王强松
骆雄飞 刘斯文 李华南 张玮 王金贵 黎波 王强松
天津中医药大学第一附属医院推拿科,国家中医药管理局推拿手法生物效应三级实验室300193;2中国医学科学院生物医学工程研究所,天津 300192
0 引 言
肠易激综合征(irritable bowel syndrome,IBS)是以腹部不适或腹痛伴随排便习惯改变为特征的一种常见的功能性胃肠道疾病。其中腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome,IBS-D)在IBS亚型中发病率较高,呈逐年升高趋势,严重影响了患者的生活质量和心理状态[1]。虽然IBS-D的发病机制尚无定论,但肠神经系统(enteric nervous system,ENS)病变在肠局部调控中的关键效应对于IBS-D的发生发展至关重要。IBS患者多存在免疫异常,其血清抗肠神经元抗体诱发ENS自身免疫反应,继而引起ENS病变,诱导肠胶质细胞表型转化,肥大细胞增多,产生炎症介质,导致腹痛、腹部不适感进行性加重[2-4]。中医摩腹法可通过手法机械力在腹部局部做环形摩动,直接刺激胃肠体表投影的腹部区域,通过胃肠神经丛的局部反射来调节胃肠的运动功能。本研究采用新生期母子分离方法建立IBS-D大鼠模型,通过观察摩腹力学刺激对IBS-D大鼠模型结肠组织肥大细胞数量、肠胶质细胞超显微结构和促炎症因子表达的影响,以探讨IBS-D发病与上述指标的相关性以及摩腹力学刺激调节IBS-D肠神经系统功能的作用机制。
1 材料与方法
1.1 主要材料与仪器
健康无特定病原体级Wistar雌性孕大鼠10只,体质量(200±10)g,购于北京华阜康生物科技股份有限公司,许可证号SCXX(京)2014-0004。动物购入后适应性喂养1周,自由摄食饮水,光照节律为12 h 光照/12 h 黑暗(光照时间 6∶00~18∶00),室温(25±2)℃,相对湿度为60%~70%,保持安静。本研究所有的动物实验均获得天津中医药大学伦理委员会批准。
大鼠白细胞介素-6(interleukelin-6,IL-6)、白细胞介素-1β(interleukelin-1β,IL-1β)酶联免疫吸附测定试剂盒(美国Thermo Fisher Scientific公司)。ZTC-Ⅱ智能推拿手法测定仪(上海中医药大学和复旦大学共同研制),MD1000正置显微镜、RM2235石蜡切片机(德国 Leica Microsystems公司),P2、P10、P20、P100、P200、P1000移液器(美国 Gilson公司),DHG-9023A恒温烘箱(上海恒一科学仪器有限公司),TKD-TSF自动组织脱水机(湖北康强医疗器械有限公司),TB-718D生物组织自动包埋机、TB-718L生物组织自动包埋机(冷台)(湖北泰维科技实业股份有限公司),Hitachi7650透射电子显微镜(日本Hitachi公司)。
1.2 方法
1.2.1 IBS-D大鼠模型的建立
采用新生期母子分离方法建立IBS-D大鼠模型:新生大鼠出生当天记为第1天;于第2~14天将新生大鼠与母鼠每天分离3 h,保持新生大鼠生活环境温度维持在(25±2)℃;分离3 h后将母鼠重新放回原笼中;从第15天起新生大鼠与母鼠共同饲养,不予任何处理,第22天断奶,第30天分笼饲养。
1.2.2 动物分组与干预方法
使用随机平行对照方法,将60只新生Wistar大鼠按随机数字表法分为空白组、模型组和摩腹组,每组20只。摩腹组大鼠造模后进行摩腹力学刺激干预,事先采集天津腹部推拿名家王金贵教授的操作手法信息,其所用力大小和频率均经智能推拿手法测定仪标定,建立手法操作模型;然后将实验大鼠仰卧束缚于实验台上,将智能推拿手法测定仪的按摩头置于大鼠腹部结肠部位进行按法力学刺激,设定压力为10 N,维持压力静待2 min,如此反复操作4次;再进行摩法力学刺激,设定压力为3 N,做顺时针方向节律性的环旋运动,频率20~30 r/min,如此反复操作12 min;每天按上述方法干预1次,连续14 d。模型组大鼠造模后每天被仰卧束缚于实验台上5 min,不予摩腹力学刺激干预,连续14 d。空白组大鼠不造模,不予任何干预。
1.2.3 大鼠肠动力及内脏敏感性的测定
干预后采用体积分数为2%的异氟烷麻醉各组大鼠(麻醉前禁食12 h),取直径为3 mm的玻璃小球沿大鼠肛门放入距肛门3 cm的直肠内。然后将大鼠转移至笼内喂食饮水,笼内垫清洁滤纸。自大鼠苏醒后开始计时,记录大鼠直肠内玻璃小球的排出时间。
干预后采用腹部回缩反射评分为指标观察各组大鼠对直结肠气囊扩张的反应性,评估内脏敏感性,具体操作参见文献[5]。
1.2.4 苏木精-伊红染色观察大鼠结肠组织的病理变化
干预后第2天,采用质量浓度为100 g/L的水合氯醛麻醉各组大鼠,腹主动脉取血,收集、分离血浆;颈椎脱臼处死大鼠,截取结肠,用质量浓度为9 g/L的NaCl溶液冲洗干净,置于质量浓度为40 g/L的甲醛溶液中固定;然后进行石蜡包埋、切片(厚度为5μm)和苏木精-伊红染色,于光学显微镜下观察大鼠结肠组织的病理变化。
1.2.5 甲苯胺蓝染色观察大鼠结肠组织中肥大细胞的形态及数量变化
取1.2.4节制备的结肠组织石蜡切片(每组选4个样本),采用甲苯胺蓝染色,于光学显微镜下(×200)随机选取4个视野,观察大鼠肥大细胞的形态,并连续计数上述4个视野的肥大细胞数,取均值作为肥大细胞密度值。
1.2.6 透射电子显微镜观察大鼠结肠胶质细胞的超显微结构
将1.2.4节中石蜡包埋的结肠组织进行切片(厚度为5μm);然后通过甲苯胺蓝染色找到特定区域;经超薄切片机切片(厚度为50~70 nm)后置于铜网上,用质量浓度为30 g/L的醋酸铀和枸橼酸铅双染;最后于透射电子显微镜下观察结肠胶质细胞的超显微结构。
1.2.7 大鼠血浆中促炎症因子IL-6和IL-1β水平的检测
分别采用IL-6、IL-1β酶联免疫吸附测定试剂盒检测大鼠血浆(1.2.4节分离得到)中的IL-6和IL-1β水平,具体操作按试剂盒说明书进行。
1.3 统计学方法
采用Origin Pro 8.5统计学软件处理数据,符合正态分布的计量资料以均值±标准差(Mean±SD)表示,组间比较使用单因素方差分析(One-Way ANOVA)法,以P<0.05为差异具有统计学意义。
2 结果
2.1 摩腹力学刺激对IBS-D大鼠肠动力及内脏敏感性的影响
本研究采用玻璃小球排出时间评价大鼠的肠动力情况。如图1A所示,与空白组相比,模型组大鼠的玻璃小球排出时间明显缩短,差异具有统计学意义(P<0.01),表明造模后大鼠的结肠转运频率加快;给予摩腹力学刺激干预后,玻璃小球排出时间较模型组延长,差异具有统计学意义(P<0.05),表明摩腹力学刺激干预后IBS-D大鼠的结肠转运功能得以改善。

图1 各组大鼠的玻璃小球排出时间及腹部抬起容量阈值变化
内脏高敏感性是IBS-D的特征生物标志物,如图1B所示,与空白组相比,模型组大鼠的腹部抬起容量阈值明显降低,差异具有统计学意义(P<0.01),表明造模后大鼠的内脏敏感性提高;给予摩腹力学刺激干预后,腹部抬起容量阈值较模型组明显升高,差异具有统计学意义(P<0.05),表明摩腹力学刺激改善了IBS-D大鼠对外部应激的敏感性。
2.2 摩腹力学刺激对IBS-D大鼠结肠组织病理学的影响
各组大鼠结肠组织的苏木精-伊红染色结果如图2所示:空白组大鼠结肠黏膜结构完整,腺体排列整齐,未见炎症细胞浸润和间质水肿;模型组大鼠部分结肠与腹腔组织粘连,腺体排列疏松,黏膜下层有炎症细胞浸润;而摩腹组大鼠腺体排列疏松,黏膜下层可见轻度充血,症状改善明显。
2.3 摩腹力学刺激对IBS-D大鼠结肠组织中肥大细胞形态和数量的影响
对各组大鼠结肠组织进行甲苯胺蓝染色,显微镜下可见肥大细胞分布于黏膜固有层和黏膜下层,细胞核呈蓝色,胞质被染成紫红色;未脱颗粒者细胞完整,胞质均匀,胞膜清晰;脱颗粒者细胞膜破裂,颗粒涌出胞膜,细胞形状不规则(图3)。由图3可知,与空白组相比,模型组大鼠结肠组织中的肥大细胞数量明显增多;给予摩腹力学刺激干预后,肥大细胞数量较模型组明显减少。进一步的细胞计数结果证实,模型组大鼠结肠组织中的肥大细胞数量[(5.61±0.12)个/视野]多于空白组[(0.52±0.02)个/视野]和摩腹组[(2.64±0.22)个/视野],差异均具有统计学意义(均P<0.01)。
2.4 摩腹力学刺激对IBS-D大鼠结肠胶质细胞超显微结构的影响
透射电子显微镜观察结果显示,与空白组相比,模型组大鼠结肠胶质细胞中线粒体数目明显增加,异染色质密度明显降低;给予摩腹力学刺激干预后,线粒体数目较模型组减少,异染色质密度较模型组升高(图4)。
2.5 摩腹力学刺激对IBS-D大鼠促炎症因子IL-6和IL-1β分泌的影响
由图5可知,与空白组相比,模型组大鼠血浆中的IL-6和IL-1β水平明显升高,差异均具有统计学意义(均P<0.01);给予摩腹力学刺激干预后,血浆中的IL-6和IL-1β水平较模型组明显降低,差异均具有统计学意义(均P<0.05)。
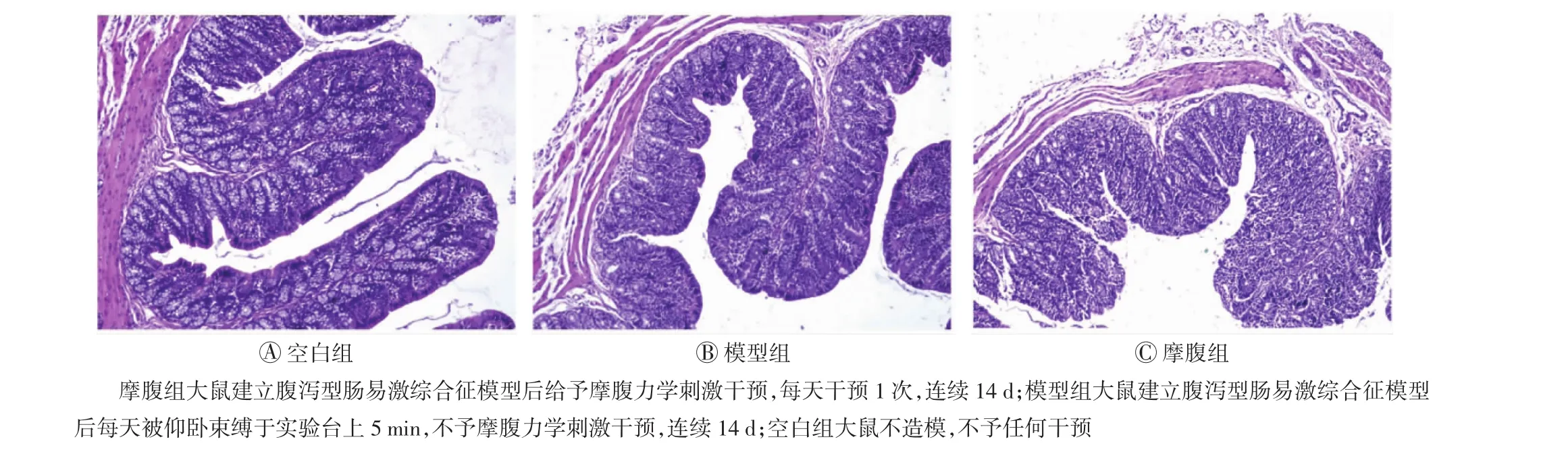
图2 苏木精-伊红染色观察各组大鼠结肠组织的病理变化(×200)

图3 甲苯胺蓝染色观察各组大鼠结肠组织中肥大细胞的形态和数量变化(×100)

图4 透射电子显微镜观察各组大鼠结肠胶质细胞的超显微结构(×700)

图5 酶联免疫吸附测定法检测各组大鼠血浆中促炎症因子IL-6和IL-1β的水平
3 讨论与结论
中医将IBS-D归属于“腹痛”、“泄泻”范畴,认为该病多因脾失健运,运化失常致病理产物累积,阻碍中焦气机,进而导致肠道功能失调,出现腹胀、腹泻等临床症状。腹部居人体之中,为上下联结之枢,与五脏六腑关系密切。胃主受纳水谷,推陈降浊;大肠主传导变化,吸收精微,两者功能协调,才能使气血通和。摩腹法可通过调理胃肠气机,治疗相应脏腑病证,对消化系统疾病具有显著疗效。正如《理瀹骈文》所言:“后天之本在脾,调中者摩腹。”临床研究结果证实,摩腹法可有效治疗IBS-D,改善患者的临床症状[6]。
肠道功能紊乱是IBS-D评价的主要指标之一。本研究中IBS-D大鼠肠道功能紊乱表现为玻璃小球排出时间明显缩短;同时,与正常大鼠相比,IBS-D大鼠的内脏敏感性降低,这与IBS-D患者的临床表现一致[7];而摩腹力学刺激能明显延长IBS-D大鼠的玻璃小球排出时间,提高内脏敏感性。虽然IBS的发病机制尚未清楚,但精神心理因素是影响IBS的主要因素[8]。文献报道,肥大细胞数量与IBS症状严重程度(焦虑、抑郁评分)呈正相关[9]。肥大细胞在IBS的病理过程中发挥着重要作用,其可能是连接肠道组织与神经系统的主要介质[10]。本研究结果显示,摩腹力学刺激能明显减少肥大细胞数量,减缓IBS的症状。
肠胶质细胞具有与脑星形胶质细胞相似的功能,在肠壁中形成广泛的细胞网络[11]。肠胶质细胞网络连接肠上皮和黏膜下层的ENS,在维持肠道功能稳态中发挥着重要作用[12]。前期研究结果发现,IBS患者结肠胶质细胞中的异染色质密度显著降低,线粒体数目增加[13]。本研究通过透射电子显微镜观察大鼠结肠胶质细胞的超显微结构改变,结果表明,摩腹力学刺激能明显升高IBS-D大鼠结肠胶质细胞中的异染色质密度,减少线粒体数目。近年来研究结果发现,肠胶质细胞的功能受多种因素影响,如促炎细胞因子[14]等。本研究采用酶联免疫吸附测定法检测大鼠血浆中促炎症因子IL-6和IL-1β水平的变化,结果显示,与空白组相比,IBS-D大鼠血浆中的IL-6和IL-1β水平明显升高,给予摩腹力学刺激干预后,血浆中的IL-6和IL-1β水平明显降低,表明摩腹力学刺激能减少促炎症因子的分泌,调节结肠胶质细胞的功能。
本研究结果提示摩腹力学刺激可提高IBS-D大鼠的内脏敏感性,减少结肠组织中的肥大细胞数量和结肠胶质细胞中的线粒体数目,升高结肠胶质细胞中的异染色质密度,还可减少促炎症因子IL-6和IL-1β的分泌,从而起到调节ENS的作用,其作用机制可能与肠-脑轴有关。鉴于本研究的样本量较少、研究周期较短等因素,摩腹力学刺激治疗IBS-D的具体起效机制和作用靶点尚未完全清楚,还需进一步的深入研究。
利益冲突所有作者均声明不存在利益冲突
