我国围生儿先天性心脏病发病率的Meta分析
2020-07-29许文婧魏莉莉王莹魏颖王剑毛宝宏陶仲宾杨克虎刘青
许文婧,魏莉莉,王莹,魏颖,王剑,毛宝宏,陶仲宾,杨克虎,刘青
先天性心脏病(congenital heart disease,CHD)是指在胚胎发育过程中的先天性心脏结构和功能上的缺陷,近年位于围生儿出生缺陷的首位[1],同时也是我国5岁以下城市儿童主要的死亡原因[2]。据我国出生缺陷监测结果显示,2000年CHD发生率为1.14‰[3]。自2003年取消婚检后,出生缺陷的第一防线被打破,同时环境、遗传因素等原因使CHD发病率不断上升[4]。而患有CHD的围生儿即便存活也会对其身体健康造成长期的不良影响,同时加重其家庭经济负担。以往文献报道基于人群、社区和医院的围生儿CHD流行病学的调查显示,CHD发病率为1.0‰~1.5‰[5]。不同研究间的差异主要是由于调查方法、样本量规模、产前诊断水平等因素不同造成的。目前针对我国围生儿CHD发病率的Meta分析鲜有报道,本研究拟检索多个中英文数据库,运用Meta分析方法总结分析中国近20年围生儿CHD发病率数据,了解CHD流行病学特征,并按性别、居住地、地区、母亲年龄及调查年份进行亚组分析,对我国围生儿CHD发病情况进行总体评估,以期为我国围生儿CHD的防治提供参考依据。
1 资料与方法
1.1 纳入和排除标准 对来自中国大陆地区关于围生儿的CHD发病率的文献进行统计分析。纳入标准:①孕28周至产后7 d内的围生儿(包括活产、死胎、死产及7 d内死亡的围生儿),或孕28周至产后7 d的围生儿部分数据可以准确提取。②样本量≥1 000例,或质量评价分数≥5分的文献。排除标准:①明显不相关文献;②以儿科、心内科为基础或以残疾儿童、弃婴、福利院救助等特殊人群为调查对象的文献;③重复报告文献;④纳入人群包括孕28周至产后7 d时间以外的儿童,或孕28周至产后7 d的围生儿部分数据无法准确提取,通过电子邮件、电话或其他联系方式与原始研究作者联系仍不能获取相关数据的文献;⑤未报告调查具体时间、地点的文献。
1.2 文献检索策略 2名研究员独立系统地对多个中外文数据库(PubMed、Embase、The Cochrane Library、Web of Science、CNKI、CBM、万方和维普)进行检索,检索关于中国围生儿CHD发病率的相关研究,检索自建库起至2020年1月公开发表的关于中国围生儿CHD的相关文献。检索采用主题词和自由词[6]相结合的方式,中文检索词包括:先天性心脏病、发病率、流行病学。英文检索主题词:“Heart Defects,Congenital”,“Incidence”,“China”;自由词:“Congenital Heart Defect”,“Heart Abnormality”,“Cardiopathy Dysmorphism”,“Incidences”,“People’s Republic of China”,“Mainland China”。并手动检索了纳入文献的参考文献,获取更多相关文献。
1.3 文献筛选及资料提取 2名研究人员独立按照纳入、排除标准进行文献的筛选、提取相关资料[7],随后进行交叉核实,如遇原始数据不完整、存在任何疑问或分歧,将尝试通过电子邮件、电话或其他联系方式与原始研究作者联系力求补充数据,完善结局。对于纳入的原始研究提取信息包括第一作者姓名、文章发表年份、调查地区、调查时间、数据来源、研究设计类型、抽样方式、母亲年龄、诊断标准、CHD类型、调查人数和发病例数。
1.4 纳入研究的偏倚评价 纳入研究的偏倚风险按照美国卫生保健质量和研究机构(Agency for Healthcare Research and Quality,AHRQ)推荐的11条标准进行评价。偏倚风险评价由2名评价员独立完成,意见不统一时,与第3位研究人员共同讨论,直到达成一致意见。
1.5 统计学方法 总体风险评估采用随机效应模型,亚组分析目的是探讨异质性的来源。采用Stata12.0软件进行单个率的Meta分析,计算合并后发病率及相应的95%CI,结合I2和Q检验进行异质性检验[8],I2>50%,表明研究间存在异质性,采用随机效应模型合并统计数据分析进一步探究异质性来源;I2≤50%,通过固定效应模型合并分析。找出异质性的来源通过亚组分析,其分组因素包括患者性别、居住地、地区分布(以秦岭-淮河为界划分南北)、母亲年龄、诊断时间及调查时间(分为3个时间跨度:2006年12月31日以前;2007—2012年;2013—2018年)。纳入研究组间差异采用χ2检验进行发病率的比较。通过Begg’s秩相关检验和Egger回归分析监测文献的发表偏倚。P<0.05为差异有统计学意义。
2 结果
2.1 文献筛选流程及结果 初检出相关文献4 938篇,经逐层筛选后,最终纳入29篇文献[1,4,9-35],共36 756例CHD围生儿,文献筛选流程及结果见图1。

图1 文献筛选流程及结果
2.2 纳入研究的基本特征及偏倚风险评价结果 纳入研究的基本特征及偏倚风险评价结果见表1。
2.3 Meta分析结果
2.3.1 我国围生儿CHD发病率 共纳入29篇研究,调查总样本量为8 327 724例,涉及12省的数据,其中包括CHD围生儿36 756例,各研究报告的CHD发病率在0.50‰~9.41‰,见图2。由于纳入研究的组间异质性较高(I2=100%,P<0.01),采用随机效应模型。本研究结果显示,我国12个省围生期CHD发病率为2.9‰(95%CI:2.2‰~3.8‰)。
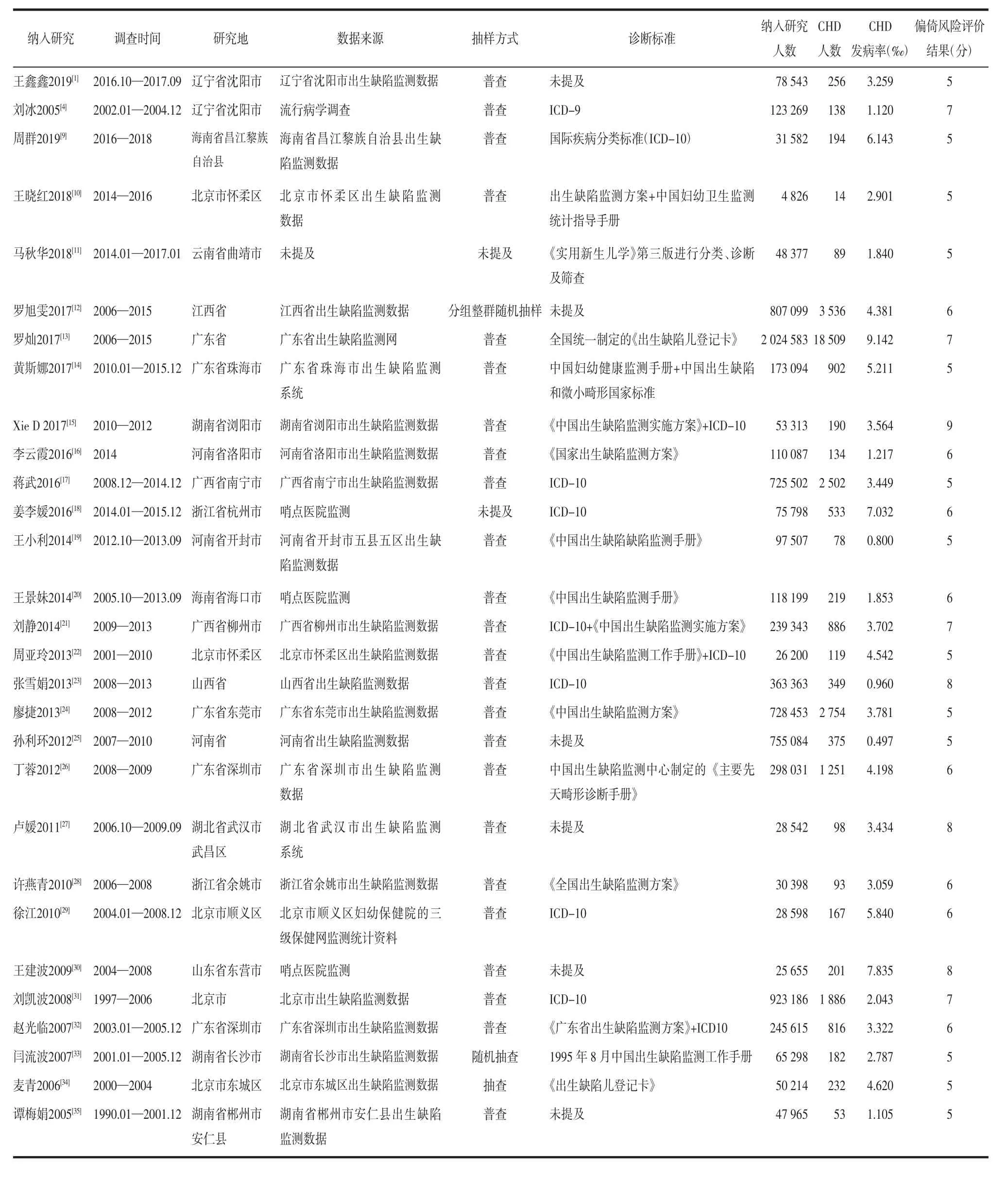
表1 纳入研究的基本特征及偏倚风险评价结果
2.3.2 亚组分析 按照患者不同性别、居住地、地区分布、母亲年龄、调查时间及CHD类型进行亚组分析,但各亚组内不同研究间异质性仍很高,均采用随机效应模型合并效应量。亚组分析结果显示:男性围生儿CHD发病率(2.9‰)高于女性(2.2‰)(OR=1.509,95%CI:1.430~1.592,χ2=227.573,P<0.001);城市围生儿CHD的发病率(2.5‰)高于农村(1.1‰)(OR=3.057,95%CI:2.788 ~3.352,χ2=626.869,P<0.001);南方围生儿CHD发病率(3.5‰)高于北方(2.1‰)(OR=3.759,95%CI:3.637~3.885,χ2=7 117.592,P<0.001);母亲年龄≥35岁围生儿CHD发病率(2.8‰)高于母亲年龄<35岁(2.0‰)(OR=1.336,95%CI:斯1.147~1.555,χ2=14.027,P<0.001);不同调查时间研究的亚组分析结果显示,调查时间在2013—2018年的研究围生儿CHD发病率最高(χ2=452.68,P<0.001);5种主要CHD类型的亚组分析结果显示,室间隔缺损发病率最高(χ2=790.557,P<0.001)。见表2。

图2 我国围生儿CHD发病率的Meta分析结果
2.4 敏感性分析与发表偏倚检测 采用逐个剔除每篇纳入研究的方法,观察单个研究对合并效应值的影响,得到的结果均与总合并估计值无明显差异,提示本研究结果稳定性较好,见图3。总发病率的漏斗图、Bgger′s秩相关检验(Z=0.68,P=0.499)与Egger回归分析(t=2.16,P=0.040)均显示无明显发表偏倚,见图4。
3 讨论
监测出生缺陷的目的主要是通过动态观察出生缺陷发生的消长情况,发现影响出生缺陷的可疑因素,以便为病因学研究提供线索[36]。目前国际出生缺陷情报交换所成员国和地区出生缺陷监测采用2种方案,一种是以人群为基础的监测方案,一种是以医院为基础的监测方案。我国采用的是世界卫生组织推荐给发展中国家使用的以医院为基础的监测方案[37]。而围生期定义我国大多采用胎龄为孕28周至产后7 d[5]。围生期的保健可以对CHD进行早期诊断和干预,也是衡量一个国家和地区医疗水平的一个重要指标[5]。
本研究通过对我国近20年间关于围生儿CHD发病率的29项研究进行分析,累计围生儿CHD 36 756例,CHD总发病率为2.9‰,其中室间隔缺损最常见,其次是动脉导管未闭。本研究室间隔缺损为最常见的CHD亚型,原因可能是因为本研究仅反映围生期(孕满28周至生后7 d)所能监测的CHD发病情况,而一些CHD如动脉导管未闭、小的室间隔缺损可能在1年之内自愈[22]。根据不同调查时间的亚组分析结果显示,2006年12月31日以前的发病率为2.7‰,2007—2012年发病率为2.6‰,2013—2018年发病率为3.7‰,发病率在2007—2012年下降,随后呈上升趋势,其主要原因可能与产前筛查率、产前诊断技术水平的提升、孕期产妇保健意识增强和医疗机构逐渐重视自然流产胚胎等因素有关,由此出生缺陷监测报告的漏报、漏诊率明显下降,使监测的出生缺陷发病率更接近实际水平;也不排除CHD发病率增加与能源消耗的增多、环境污染引起的对孕妇和胎儿不良影响因素增多有关[38]。
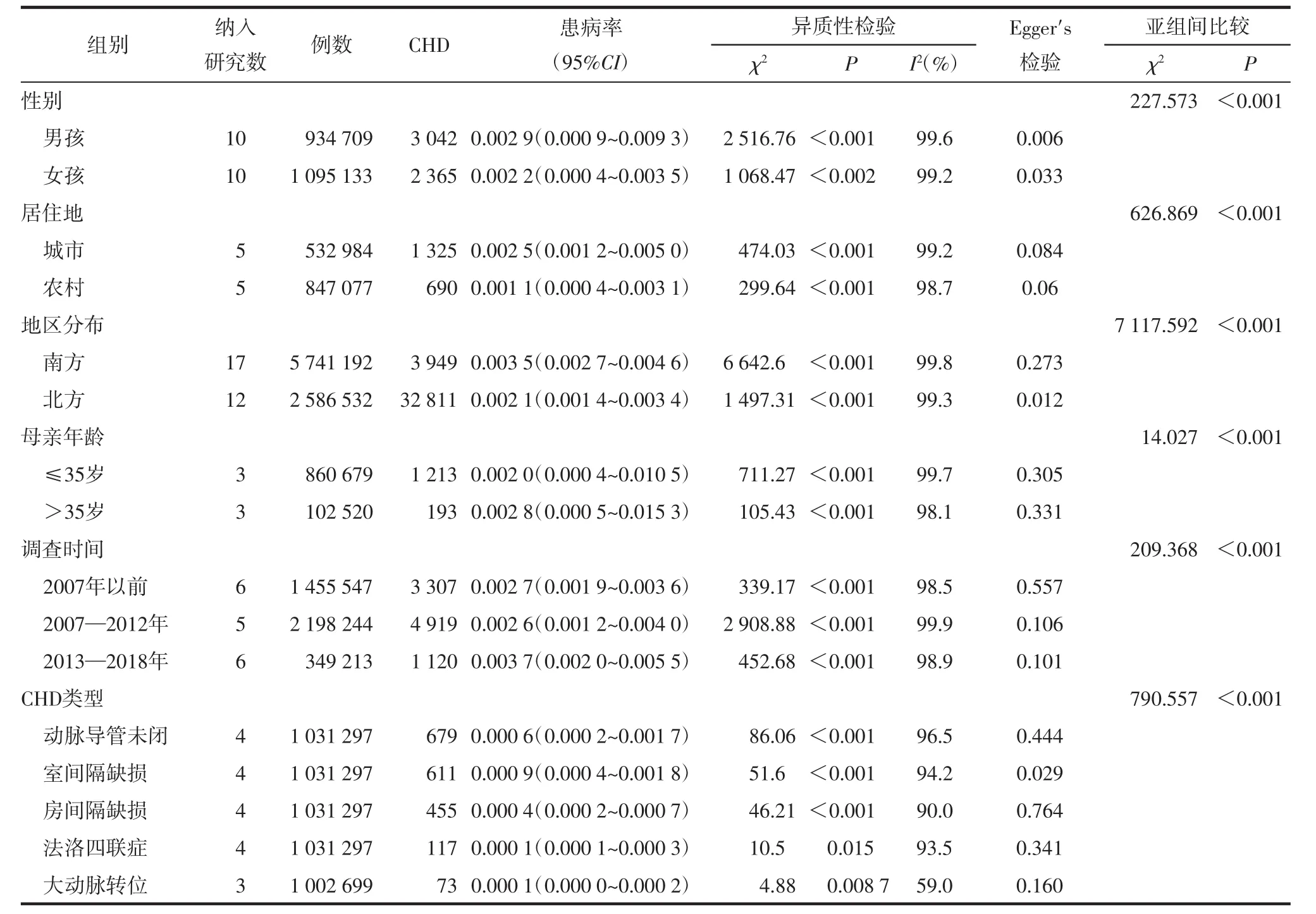
表2 我国围生儿CHD发病率的亚组分析

图3 我国围生儿CHD发病率的敏感性分析

图4 我国围生儿CHD发病率的Begg’s图
通过亚组分析结果显示男性围生儿发病率(2.9‰)高于女性(2.2‰),与多篇文献[1,9,13,24]研究结果一致。其原因可能与男女性别遗传学因素的差异有关,男性性染色体核型为杂合子,而女性性染色体核型为纯合子,当性染色体受损时,男性性染色体无法弥补,而女性的性染色体具有同位基因互补优势[1]。本研究还发现,城市围生儿CHD发病率高于农村,分析可能是因为城市出生缺陷的监测医疗机构产前诊断技术及新生儿早期诊断技术水平均高于农村,且监测网严密、定期核查是否存在漏诊或误诊的情况。同时不排除由于城市环境综合污染指数高和生活压力大等问题,进而形成城市围生儿CHD发病率高于农村的局面。
本研究还发现,南方围生儿CHD发病率高于北方,不同地区报告的CHD发病率差异较大,虽然一定程度反映了真实的地理差异,但不同地区CHD流行现状的差异与地区经济[15]、医疗技术、传统文化、孕期保健、地理位置和环境等因素有关。同时不同地区监测数据是总出生数还是活产数,CHD的发病率也会产生较大差异,如地区基于活产数的CHD发病率通常低于从孕28周开始监测到的CHD发病率。
此外,本研究发现,母亲年龄≥35岁者围生儿CHD发病率高于母亲年龄<35岁,这与既往研究证实高龄受孕是发生CHD的独立高危因素[9,20]的结果一致。其原因可能是高龄孕妇的卵巢功能下降,其卵母细胞病毒感染概率增加,进而导致胎儿畸变率增高[11];同时随着二孩政策的全面放开,高龄产妇所占比例升高。
系统评价和Meta分析在许多学科大发展中都发挥着重要作用[39],且这种方法也越来越多地被应用到非医学研究领域[40-42]。本研究严格按照Cochrane协作网要求规范进行,但也存在一定的局限性:①纳入研究存在明显的异质性,即便严格根据纳入、排除标准进行文献筛选,但结果均无法完全解释异质性的来源。由于单个率Meta分析的纳入研究异质性主要受纳入研究样本量的大小影响,因此可能无法将异质性控制在一定范围内[43]。②有些纳入文献采用中国出生缺陷监测方案、地方出生缺陷监测方案中对CHD的诊断标准,而有些文献诊断标准不明确,一定程度上影响对围生儿CHD检出率。③本研究纳入的29篇文献仅涉及12个省市,并且多篇研究未提供详尽的资料,如对患有CHD的围生儿性别、居住地、母亲年龄等基线特征的报告不完整,导致分组因素所包含的研究数量不均衡,难以进行更细致的亚组分析,影响结果的准确性,可能存在抽样误差及发表偏倚。
综上所述,本研究结果表明我国围生儿CHD的患病率为2.9‰。为更好地关爱围生儿健康,提高人口素质,应重视CHD流行病学及病因学研究,并探究中国地区围生儿CHD相关暴露因素,采取更有目的性和针对性的干预措施,以期降低CHD的发生率。由于纳入研究的数量和质量的限制,本研究结论还需要更高质量的研究来加以验证。
