白酒中有机酸和醛类的偏最小二乘回归法定量分析模型
2020-07-29吉鑫樊双喜李宜聪钟其顶陆玮李安军刘国英黄艳胡心行叶方平
吉鑫,樊双喜,李宜聪,钟其顶*,陆玮,李安军,刘国英,黄艳,胡心行,叶方平
1(中国食品发酵工业研究院有限公司,北京,100015)2(全国食品发酵标准化中心,北京,100015) 3(安徽古井贡酒股份有限公司,安徽 亳州,236800)
白酒作为我国传统的蒸馏酒,其独特的酿造工艺经传承和改良,最终形成以粮谷为主要原料,以大曲、小曲或麸曲及酒母等为糖化发酵剂,经蒸煮、糖化、发酵、蒸馏等工序制成的饮料酒[1]。白酒的主要成分为水和乙醇,作为白酒呈香呈味物质,决定着白酒风格和质量的微量有机组分如有机酸、酯类、醛类和除乙醇外的醇类等仅占总体积的2%左右[2]。2019年10月公布的《产业结构调整指导目录(2019年本)》较先前版本,取消了对白酒生产线的限制,此举将推动白酒行业的高质量发展。随着政策的放开,白酒生产的准入门槛就必然随之提升,对白酒的安全、品质,白酒生产、检测技术以及人员的要求也将更严格。由于缺乏完善的质量安全标准、准确的食品真实性定义、精确高效的检测技术手段、先进的生产设施和完整的质量体系等原因,白酒质量安全控制以及真实性依然存在较大提升空间[3]。
特定特征组分分析技术应用于白酒的掺假检测是我国目前较为常用且发展相对成熟的技术手段,如气相色谱法[4]、气相色谱-质谱分析法[5-6]、近红外光谱法[7]和液相色谱法[8]等,可以对GB/T 10345—2007中所规定的白酒微量物质和一些常见的挥发性香气成分实现定性或精确定量检测。然而上述检测方法都是具有针对性的,如气相色谱法主要用于白酒中挥发性物质的测定,液相色谱法用于不易挥发物质和大分子的测定。在应对当前白酒市场变化多样的掺假物质和造假手段时,传统的分析方法由于无法检测未知掺假物质,存在一定的局限性,无法满足高效、多维度的白酒快速检测要求。
核磁共振波谱(nuclear magnetic resonance,NMR)首次作为定量分析的分析工具是在1963年由JUNGNICKEL等提出[9]。20世纪70年代初期,NMR开始在食品科学领域发挥其优势。相比于其他传统的分析方法,1H NMR技术不仅能够实现白酒样品中所有质子的无偏检测,反映酒体成分的全部特征,而且能够在1次实验中直接分析和检测大量的样品[10]、保持样品的完整性,且操作简单快速,测量精确,重复性高。该技术已成功应用于牛奶[11]、果汁[12]、蜂蜜[13]和葡萄酒[14]的成分分析和掺假鉴别。1H NMR图谱中囊括了大量已知和未知的有机化合物特征信息,通过统计分析手段对白酒1H NMR图谱中的信息进行深入挖掘,抽取有效的数据信息,不仅有利于对于未知化合物的结构解析,而且NMR信号能够提供有机酸、酚类、氨基酸等高通量数据依据。在强波谱重叠的情况下,较为常用的统计学手段是偏最小二乘回归(partial least squares regression,PLSR)分析模型,如NMR技术结合PLSR已成功应用于啤酒中麦汁浓度、乙醇和有机酸的定量分析[10,15]。以上研究为白酒中微量组分的NMR定量研究提供了一定的参考依据。由于白酒基质复杂,采用定量NMR技术直接对白酒样品进行积分定量时,灵敏度不足、信号峰重叠和溶剂峰压制技术造成临近信号被隐藏等问题,导致无法实现白酒中有机酸和醛类的准确定量。基于上述原因,NMR技术在白酒中的应用研究基本上还处于空白阶段。
为突破以上技术难点与不足,本研究拟采用1H NMR技术结合PLSR分析方法从复杂的波谱中提取有效的特征定量信息,建立白酒中有机酸和醛类的PLSR定量分析模型,实现白酒中有机酸和醛类的准确测定,为非目标1H NMR指纹图谱技术应用于食品质量安全与真实性研究奠定良好的基础。
1 材料与方法
1.1 材料与试剂
实验所用白酒样品均由白酒企业提供,共计77个,其中浓香型白酒29个,馥郁香型白酒48个。叠氮化钠(NaN3)(高纯级),北京博奥拓达科技有限公司;3-(trimethylsilyl)-propionate acid-d 4(TSP)标准品,安诺伦(北京)生物科技有限公司;H3PO4、KH2PO4、HCl、NaOH(分析纯),北京化工厂;重水(D2O)(99%)、丙酸、己酸、2-乙基丁酸、乙缩醛标准品,Sigma-Aldrich公司;缓冲液Technical(pH 2.00、4.01、7.00),瑞士Mettler-Toledo公司;无水乙醇(分析纯),天津市大茂化学试剂厂;乙酸标准品,北京百灵威科技有限公司;丁酸标准品,上海安谱实验科技有限公司;戊酸、异戊酸、异戊醛标准品,梯希爱(上海)化成工业发展有限公司;40%乙醛,福晨(天津)化学试剂有限公司。
1.2 仪器与设备
Bruker Avance Ⅲ HD 400 MHz波谱仪、Bruker自动进样器(SampleJet)、Bruker SampleJet 5 mm高通量核磁管,德国Bruker Biospin公司;AB204-N 万分之一天平、S210 pH计、InLab®Science pH电极,瑞士Mettler-Toledo公司;岛津GC 2010气相色谱仪、氢火焰离子化检测器,日本岛津公司。
1.3 实验方法
1.3.1 NMR样品制备
用移液枪准确吸取100 μL样品缓冲溶液[16]于样品管,加入900 μL白酒样品溶液,用1 mol/L NaOH和1 mol/L HCl将样品pH精确调节至4.0(± 0.02 pH单位),混合均匀后吸取600 μL于5 mm NMR管中,用于NMR测定。
1.3.2 基础数据的获得
1.3.2.1 气相色谱法
采用直接进样气相色谱内标法对白酒样品中有机酸和酯类的含量进行测定。色谱柱为聚乙二醇毛细管柱(60 m×0.25 mm,0.15 μm膜厚);升温程序为初温35 ℃,保持1 min,以3.0 ℃/min升到70 ℃,以3.5 ℃/min升到180 ℃,再以15 ℃/min升到210 ℃,保持15 min;检测器温度为300 ℃;进样口温度为280 ℃;载气为He,流速1 mL/min;分流比20∶1;进样量1.0 μL。
1.3.2.2 核磁共振波谱法
实验所采用的1H NMR的共振频率为400.13 MHz,配备5 mm BBI探头;谱宽(SW)为20.552 4;采样点数(TD)为65 536;接收增益(RG)为16;扫描次数(NS)为64,弛豫延迟(D1)为4 s;以3-(三甲基硅基)氘代丙酸钠(TSP,δ=0)作为化学位移的零点。Bruker标准的脉冲序列(NOESYGPPS 1D)用于水(δ=4.8)和乙醇(δ=1.18和δ=3.64)的信号抑制。设定仪器检测温度为300 K,样品检测前需等待5 min以稳定检测温度,调节样品pH=4.0±0.02。
1.3.31H NMR数据质量控制
由于采用标准的脉冲序列(NOESYGPPS 1D)用于水和乙醇的信号压制,白酒中有机酸和醛类成分的信号强度得到了明显的提高。将所有白酒样品的NMR氢谱叠加,进一步检查可能由于水和乙醇信号的抑制不当、pH调节不准确、系统误差或其他原因导致的谱图基线偏移现象[17]。对每个样品重复测定3次,以保证数据质量的可靠性。
1.3.4 核磁共振波谱预处理
采用合适的波谱预处理方法,能够有效地减少1H NMR图谱峰漂移、基线不平、峰形不对称和溶剂峰干扰等引起的数据波动问题。目前造成核磁信号偏移的原因主要包括仪器本身波动、质量浓度、温度以及pH大小等。白酒1H NMR图谱中一些特征信号峰的化学位移出现偏移,将会导致PLSR模型样本错误的分组,因此,采用适当的峰化学位移偏移校正对齐方法对随后的多元变量统计分析相当重要[18]。为了解决上述问题,本研究使用了MestReNova核磁共振数据分析软件(美国 Mestrelab Research SL公司)的分段对齐方法,灵活选择峰化学位移校正对齐的区域。图1-a为分段对齐前,分段对齐后的图谱如图1-b所示。由图1可知,分段对齐方法较好解决了1H NMR图谱峰化学位移的偏移问题。
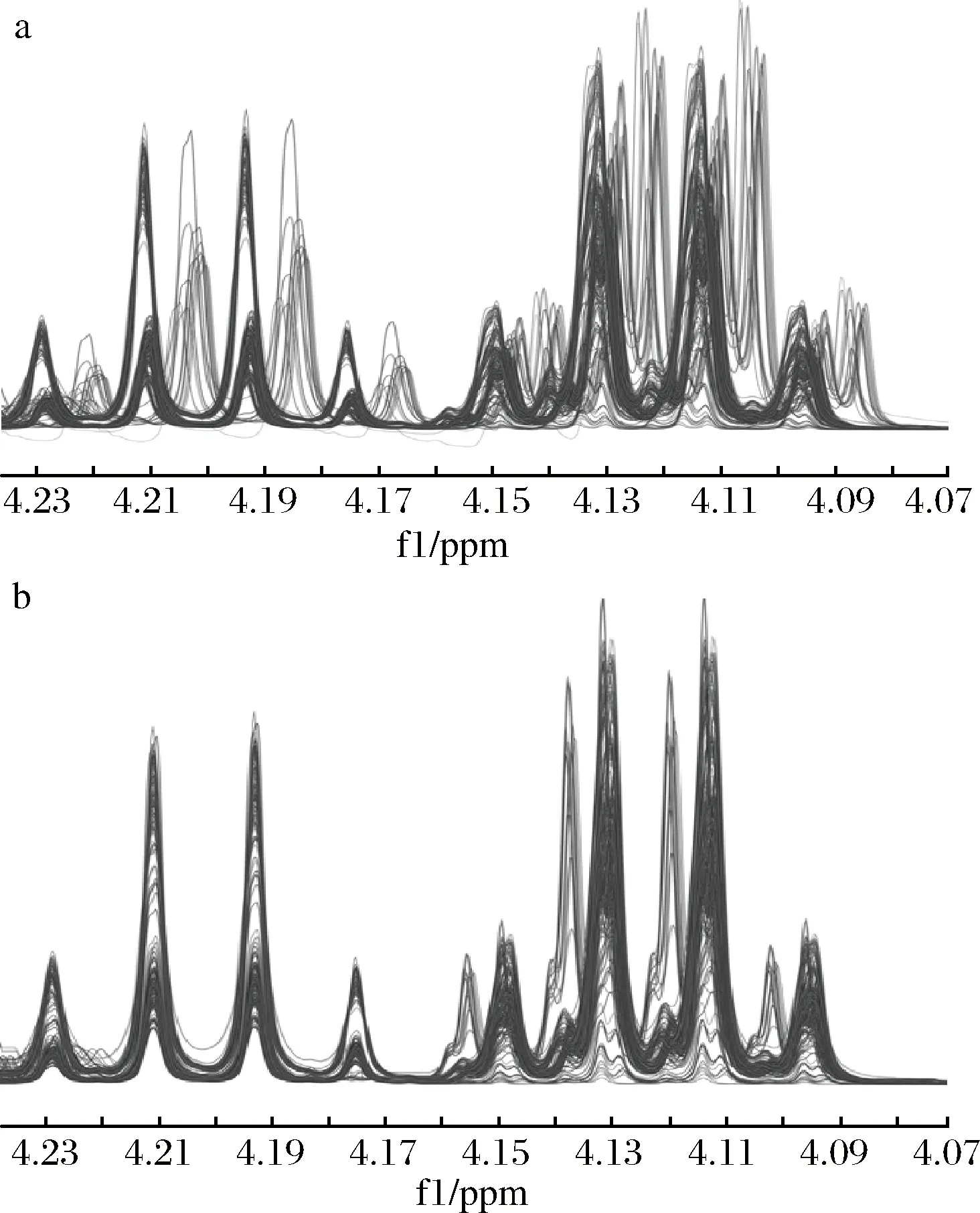
a-分段对齐前;b-分段对齐后图1 白酒1H NMR图谱特征峰化学位移分段对齐校正Fig.1 Alignment correction of chemical shift of characteristic peaks in Baijiu 1H NMR spectrum
TOMASI等[19]提出了一种改进的icoshift算法有效地解决了1H NMR信号波动的问题,能够对微小的信号进行调整。ESSLINGER等[20]认为目前用来减小1H NMR图谱数据波动最有效的手段是Bucket或者Bins,该方法的原理是将1H NMR图谱切割为许多很小的一定区域的盒子(Bucket)。其优点是能够重新产生一个代表原始1H NMR的新图谱,同时该图谱所包含的数据点的数量有所减少,便于后续的统计分析。然而缺点是与原始NMR图谱相比较会造成一定数量有效信息的缺失。
采用MestReNova核磁共振数据分析软件对NMR原始波谱进行定标、相位校正、基线校正、峰化学位移对齐和分段积分处理。分别选取0.01,0.015,0.02,0.025,0.03,0.035 和0.04 ppm作为每个分段积分的区域(Bins)宽度的取值,研究结果表明,0.01 ppm能够保持足够的数据分辨率以及能够最大限度地减少图谱信息的损失。因此,以每0.01 ppm作为区间对白酒1H NMR全谱的有效区域进行划分。去除水信号和乙醇信号残余峰所在区域,分段积分的有效区域为0.8~9.5 ppm,分段积分后大约能够获得700个分段积分值,这些分段积分值随即作为统计分析的输入变量。
1.3.5 偏最小二乘回归分析
PLSR作为一种高效抽提信息的方法,在建模过程中集合了主成分回归、多元线性回归方法的优点,研究多因变量对多自变量的回归建模,尤其是对解决各变量内部高度线性相关、样本个数少于变量个数等问题较为有效,使得到的谱向量与分析物浓度直接相关[21]。
本研究以每0.01 ppm作为区间对白酒1H NMR全谱的有效区域进行划分,并以此作为自变量矩阵,以GC所得白酒中微量组分含量结果为因变量矩阵,分别对矩阵和进行分解,如公式(1)、公式(2)所示:
X=TPT+EX
(1)
Y=UQT+EY
(2)
式中:T和U分别为X和Y的得分矩阵,P和Q分别为X和Y的载荷矩阵,EX和EY分别为X和Y的拟合残差矩阵。
将T和U做线性回归,如公式(3)所示:
U=TB+EU
(3)
式中:B是U与I的线性回归系数,即Y与X得分矩阵间的线性回归系数;EU为误差项。
在预测时,对于未知样品光谱阵Xpred,对应的各成分含量阵Ypred,如公式(4)所示:
Ypred=TpredBQ
(4)
2 结果与分析
2.1 PLSR模型中主成分数的选择
主成分数的选择是PLSR建模的关键,若选取的主成分个数过多,与响应无关的变量产生的背景噪声会导致模型过拟合,影响对统计趋势的认识,降低预测能力;若选取的主成分个数过少,则不能充分反映样品信息,导致模型拟合不充分,预测准确性降低。本研究通过主成分对各变量的累积贡献率和留一交叉验证中各主成分数的校正标准差(the standard deviation of prediction,RMSECV)综合考虑选取建立PLSR的主成分数。以己酸为例,选取若干个主成分分别进行PLSR建模,主成分累积贡献率和RMSECV随主成分个数的变化规律如图2和图3所示。由图2和图3可知,随着主成分个数的增加,RMSECV值逐渐降低,累计解释方差逐渐增加。当主成分个数是12时,RMSECV值相对最小,主成分对自变量和因变量的累积贡献率均大于85%,且自变量X矩阵累计解释的方差基本保持不变。因此,综合考虑主成分累积贡献率和RMSECV,选取最佳主成分个数12进行PLSR建模。

图2 主成分累积贡献率随主成分个数的变化规律Fig.2 Variation of cumulative contribution rate of principal components with the number of principal components

图3 交叉验证的校正标准差随主成分个数的变化规律Fig.3 Variation of RMSECV with the number of principal components
根据上述原理分别对白酒中有机酸(乙酸、丙酸、丁酸、戊酸、己酸和异戊酸)和醛类(乙醛、乙缩醛和异戊醛)的主成分数进行选择,建立PLSR定量分析模型,结果如表1所示。

表1 PLSR定量分析模型主成分数Table 1 The number of principal components of PLSR quantitative analysis model
2.2 白酒中有机酸和醛类的预测模型
在上述实验方法的基础上,分别建立白酒中有机酸和醛类的PLSR预测模型,模型预测效果如图4所示,纵坐标为白酒中各组分含量的预测值,横坐标为气相色谱法所得的白酒中各组分测定值。由图4可知,各组分的测定值与预测值点呈对角线分布,预测值与测定值线性关系良好,表明该模型的拟合效果和预测效果较好。

a-乙酸;b-丙酸;c-丁酸;d-戊酸;e-己酸;f-异戊酸;g-乙醛;h-乙缩醛;i-异戊酸图4 白酒中有机酸和醛类的PLSR定量分析模型预测结果Fig.4 Results of PLSR quantitative analysis model of organic acids and aldehydes in Baijiu
2.3 白酒中有机酸和醛类的预测模型评价
预测模型的质量通常需要通过建立预测值与测定值之间的关系进行评价,常用的模型评价参数为决定系数(R2)、预测标准偏差(RMSEP)和误差范围比(residual predictive deviation,RPD)等,计算公式(5)~公式(7)如下:
(5)
(6)
(7)
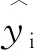
以每0.01 ppm作为区间对白酒1H NMR全谱的有效区域进行划分,并以此作为自变量;以气相色谱法所得白酒中组分浓度测定结果为因变量,建立白酒中有机酸和醛类的PLSR预测模型,模型计算结果如表2所示。由表2可知,白酒中乙酸、丙酸、丁酸、戊酸、己酸、异戊酸、乙醛、乙缩醛和异戊醛的R2分别为0.926 0、 0.985 8、 0.989 9、 0.993 5、 0.982 7、 0.982 5、 0.978 0、 0.994 1和 0.947 5,RMSEP范围为0.128 7~0.633 3(<0.7),RPD 3.7,回归效果较好,预测精度高。
表2 白酒中有机酸和醛类PLSR定量分析模型Table 2 PLSR quantitative analysis model of organic acids and aldehydes in Baijiu
2.4 回归系数显著性检验
由于偏最小二乘法的回归系数方差无法得到准确的无偏估计,故采用Jack-knife方法进行方差估计,通过计算βi对应的t统计量(服从自由度为建模使用的成分个数的t分布),进行均值是否为零的假设检验,Jack-knife方法进行方差估计的表达式如公式(8)所示[23]:
(8)
对回归系数进行相应计算,判断并挑选出对白酒中微量关键有机组分含量预测有显著影响的变量,从而筛选出1H NMR图谱中用于区分各微量组分的特征信号区域。表3总结了PLSR定量分析模型中与白酒中有机酸和醛类含量具有显著相关性的1H NMR信号区域,可以看出除丙酸和己酸,各组分的PLSR最佳预测区间全部位于脂肪族区(0.25~3.00 ppm)和中场区(3.00~6.00 ppm)。结合白酒中有机酸和醛类的信号峰归属,由表4可知,除丙酸、异戊酸和乙醛外,各组分的PLSR最佳预测区间均包含该化合物特征峰的化学位移区段,例如对乙酸含量预测有极显著影响的信号区域包含乙酸的甲基质子信号(δH2.08)区域,而根据白酒酿造过程,对乙酸含量预测有极显著影响的4.11~4.15 ppm区域可能与乙酸乙酯亚甲基质子信号(δH4.12)相关。对丙酸含量预测有极显著影响的信号区域共有12个,根据人类代谢组数据库和丙酸加标实验可知,由于丙酸的甲基质子信号(δH1.16)区域与乙醇甲基质子信号区域重叠,故此区域未计入预测模型。然而,以上12个区域均未包含丙酸的亚甲基质子共振信号,却呈现了最佳的PLSR预测模型。同样,对异戊酸含量预测有极显著影响的5个信号区域不含异戊酸质子信号特征峰化学位移,且其中3.02~3.09 ppm和3.20~3.27 ppm与异戊酸含量呈负相关关系。因此,根据以上结果推断PLSR预测模型不仅仅依赖于分析物本身的结构特征,还可能来源于其他因素,例如,通过多元统计学确定出与分析物含量呈共线关系的其他化合物的化学位移,可能为白酒中分析物形成机理的过渡或补充反应产物的质子信号区域[24]。

表3 回归系数显著性统计表Table 3 Table of significance of regression coefficient

续表3

表4 白酒中有机酸、醛类和酯类的信号峰归属Table 4 Signal peak attribution of organic acids and aldehydes in Baijiu
3 结论
本研究采用1H NMR技术作为检测手段,结合偏最小二乘回归分析方法,建立白酒中6种有机酸(乙酸、丙酸、丁酸、戊酸、己酸和异戊酸)和3种醛类(乙醛、乙缩醛和异戊醛)PLSR定量分析预测模型。有机酸和醛类的PLSR预测模型的R2为0.93~0.99,RMSEP<0.7,RPD 3.7。将NMR PLSR模型预测结果与气相色谱法进行对比分析,以各分析物的气相色谱方法测定结果为横坐标,以NMR PLSR模型预测结果为纵坐标做线性回归,发现各组分的气相色谱方法测定值与NMR PLSR预测值点呈对角线均匀分布,线性关系良好(R2均>0.92),气相色谱法和NMR PLSR预测结果误差在±8%以内,满足方法可行性对比分析验证要求。研究表明NMR PLSR定量预测模型可用于白酒中6种有机酸(乙酸、丙酸、丁酸、戊酸、己酸和异戊酸)和3种醛类(乙醛、乙缩醛和异戊醛)的快速、准确定量分析,模型拟合效果好、预测精度较高,可推广应用于白酒或其他重要食品中微量有机组分(酯类、糖类、氨基酸等)的定量检测,具有广泛的适用性。
PLSR定量分析预测模型的建立解决了当前1H NMR定量分析方法在白酒基质中信号灵敏度不足、信号峰重叠严重等问题,为白酒质量安全控制提供了技术支撑,有利于满足白酒企业对产品质量把控和政府相关部门对市场监管的需要,为开发基于1H NMR指纹图谱的非目标白酒真实性鉴别方法和模型奠定了基础。
