西藏凹乳芹根、叶提取物的急性及亚急性毒性研究
2020-07-29魏荣锐马勤阁何军伟多杰加仁增平措
占 堆,魏荣锐,马勤阁,何军伟,多杰加,仁增平措,色 珍
1西藏藏医药大学,拉萨 850000;2江西中医药大学,南昌 330004
西藏凹乳芹(Vicatiathibeticade Boiss.)在四川、云南、西藏等地有分布[1],其根被称为西归,常作为中药当归的代用品,其性温,味辛、甘、微苦,具有祛风除湿、散寒止痛,民间用于健脾补胃、血虚所致的月经不调、痛经、贫血等症,西藏凹乳芹根的使用有百余年的历史,在炖鸡、炖肉时常被作为滋补蔬菜食用[2]。近年研究表明,西藏凹乳芹根含有伞形花内酯、佛手苷内酯、阿魏酸、芹菜素等化学成分,具有抗疲劳、抗痛经、抗氧化、促智、提高免疫力等药理作用[3-7]。西藏凹乳芹根可做药食两用,又有很多药理作用,具有广阔的开发应用前景,而鲜有对西藏凹乳芹叶的研究报道,也未见对西藏凹乳芹根、叶的相关毒性研究的报道,限制了西藏凹乳芹根及叶的深度开发和利用。因此对西藏凹乳芹根、叶的提取物进行急性毒性和亚急性毒性研究,为西藏凹乳芹根及叶的开发利用及安全性评价提供毒理学依据。
1 材料与方法
1.1 实验药物
西藏凹乳芹根、叶均采集于西藏山南市洛扎县卡曲乡,经西藏藏医药大学藏药专家占堆鉴定为伞形科凹乳芹属植物西藏凹乳芹(V.thibetica)的根及叶(西藏藏医药大学,标本编号:XZARQGY-201810)。
西藏凹乳芹根、叶提取物的制备:取西藏凹乳芹根、叶干品,粉碎后,分别加入3倍量的95%乙醇浸泡后加热回流提取三次,每次3小时,过滤,合并三次药液,旋转蒸发浓缩成稠膏。使用时用蒸馏水配制成最大浓度(能通过12号小鼠灌胃针的最大浓度),浓度以提取物浓度计算,西藏凹乳芹根、叶提取物药液最大浓度分别为1.00和0.85 g/mL,存于4 ℃冰箱备用,后续实验所用的不同浓度的药液,可用此浓度的药液进行稀释。
1.2 实验仪器
粉碎机(浙江红景天工贸有限公司,型号:DE-200g);KQ-5200DB 型超声清洗机(昆山市超声波仪器公司);电子天平(十万分之一,赛多利斯,Sarturious BT 124S型);BUCHI电动旋转蒸发仪(瑞士步琪公司);Millipore-Simplicity 纯水仪。制冰机(中科美菱低温科技有限责任公司,型号:IMS-40);电子秤(上海正光医疗仪器有限公司,型号:YP20002);移液器(RAININ Pipet-lite XLS)。
1.3 实验动物
SPF级昆明种小鼠,雌雄各半,体重(18~22 g)购于江西中医药大学实验动物中心。实验动物许可证编号SCXK(赣)2018-0003。
1.4 实验方法
1.4.1 LD50测定
预实验取预先配制好的最大浓度的西藏凹乳芹根或叶提取物溶液,以小鼠一次给药的较大体积(40 mL/kg)灌胃,给药后严密观察,并每天记录小鼠毛色及外观,活动状态及大小便,死亡以及中毒等情况,如果在给予最大浓度最大体积后,小鼠全部死亡,则进行后续LD50测试。测出引起动物100%死亡的最小给药剂量(Dm)和0%死亡的最大给药剂量(Dn),然后根据预实验得出的Dm和Dn算出LD50测试需要设定的给药组数和组间比值,一般为5~7个剂量组,组间比为1∶0.80~1∶0.95,另外设1个空白组,每组10只,雌雄各半[8-10]。试验前禁食不禁水16 h,根据预试验设计剂量灌胃给药,空白组给予蒸馏水,灌胃给药1次。给药后,连续观察14天,记录小鼠外观,行为活动状态,排泄情况,中毒症状,死亡时间,死亡小鼠主要脏器外观以及死亡数量。最后根据实验结果用改进寇氏法{LD50=lg-1[Xm-i(ΣP-0.5)]}计算LD50和95%可信限。
1.4.2 亚急性毒性试验方法
取50只昆明种小鼠,随机均匀分5组,每组10只,分别为西藏凹乳芹根高、低剂量组、西藏凹乳芹叶高、低剂量组和对照组,高低剂量均为LD50(生药量)的1/20和1/40,灌胃给药,每天1次,连续21天,期间观察小鼠表现及中毒情况,记录大鼠体重及摄食量变化[11],末次给药后24 h称体重,眼眶取血清测定血液生化指标,解剖取各脏器,肉眼观察组织变化,对主要脏器肝、脾、胸腺及肾称重,计算脏器指数。
1.5 数据分析
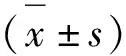
2 结果与分析
2.1 西藏凹乳芹根提取物急性毒性效应
2.1.1 西藏凹乳芹根提取物LD50实验结果
根据预实验得出引起动物100%死亡的最小给药剂量为207.42 g/kg和0%死亡的最大给药剂量为108.28 g/kg,因此选取给生药量108.28~207.42 g/kg之间进行LD50测试,每组剂量以1.00∶0.85递减,按小鼠体重计算用药量。给药组别及剂量如下表。共设计5个给药组,1个空白组,各组剂量设置见表1。

表1 西藏凹乳芹根提取物组剂量表
小鼠灌胃后,空白组小鼠活动正常,毛色光泽,饮食及大小便正常,未见异常状态;各剂量组灌胃后均出现活动减少,眯眼,俯卧不动的情况,其中高剂量组小鼠均出现步履蹒跚、后肢瘫痪、呼吸急促、抽搐,24 h后开始出现死亡,死亡主要集中在3天内;中间剂量组149.86 g/kg灌胃后出现眯眼,精神不振,后肢无力,呼吸急促,其死亡主要集中在2天内;低剂量组(108.28 g/kg)无小鼠死亡,为不引起小鼠死亡的最大剂量,因此MTD为108.28 g/kg。具体小鼠死亡情况见表2。根据小鼠死亡数量,用改进寇氏法计算西藏凹乳芹根提取物的LD50为154.81 g/kg,95%可信限为143.09~167.50 g/kg

表2 各组小鼠死亡情况
2.1.2 小鼠剖检结果
实验期间对死亡小鼠进行解剖发现:胃壁完整,胃肠内容物为药物颜色,心肺正常,未见出血点、坏死灶;肝颜色暗红呈颗粒状,无明显肿胀,肾脏颜色正常,呈颗粒状,其它脏器未见明显异常。实验结束后对小鼠进行解剖发现:胃壁完整,胃内容物和胃壁正常,心肺正常,未见出血点及坏死灶;肝、肾脏颜色正常,但个别小鼠肝、肾可见呈轻微颗粒状,其它脏器未发现异常。
2.1.3 西藏凹乳芹根提取物对小鼠肝肾功能、脏器指数、摄食量曲线和体重变化的影响
与空白组(control)相比,西藏凹乳芹根(VTBR)组(108.28 g/kg)的AST、ALT的血清含量存在上升趋势,但无明显差异,血清肌酐(Cr)含量具有明显升高趋势(图1),而BUN有明显降低趋势,提示108.28 g/kg给药量可能引起小鼠肝肾功能紊乱,此结果与解剖发现的小鼠肝、肾有肉眼可见颗粒状变化结果一致。另外,与空白组相比,西藏凹乳芹根组对脾脏指数,肾脏指数、胸腺指数、肝脏指数无明显影响(图2)。由西藏凹乳芹根组和空白组的体重变化曲线和摄食量变化曲线可知(图3),西藏凹乳芹根组平均体重低于空白组平均体重,但摄食量略高于空白组,可能与西藏凹乳芹根提取物影响机体代谢有关,但具体原因还有待于进一步研究。
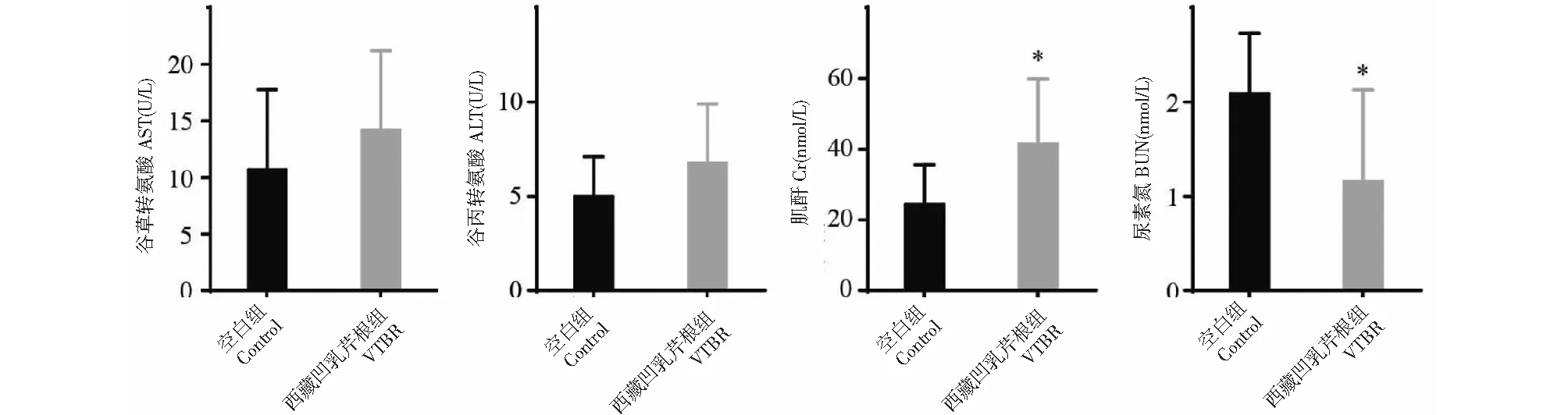
图1 西藏凹乳芹根提取物对小鼠肝肾功能生化指标的影响

图2 西藏凹乳芹根提取物对小鼠各脏器指数的影响
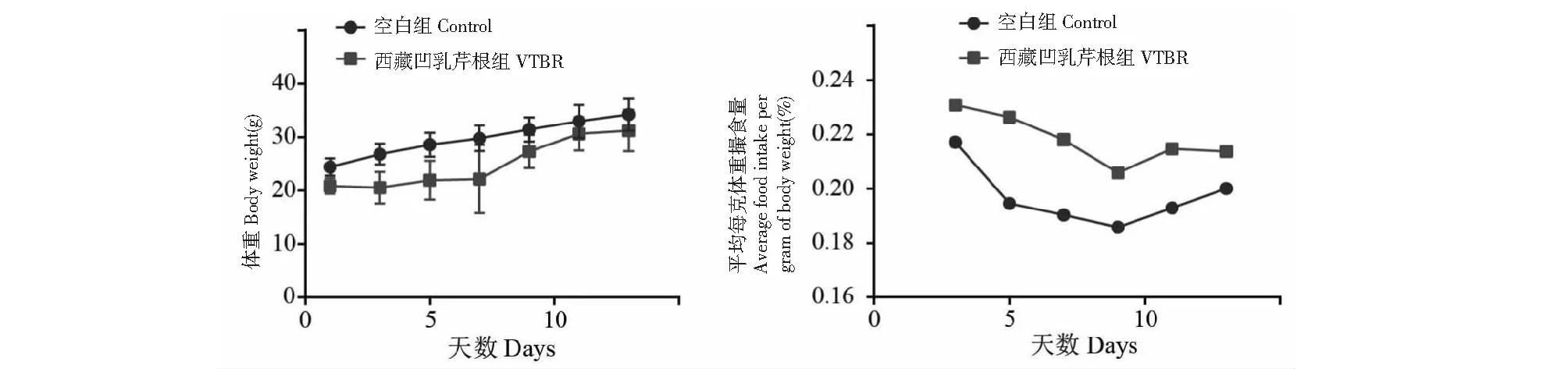
图3 西藏凹乳芹根提取物对小鼠体重及摄食量的影响
2.2 西藏凹乳芹叶提取物急性毒性效应
2.2.1 西藏凹乳芹叶提取物LD50实验结果
根据预实验得出引起动物100%死亡的最小给药剂量为99.55 g/kg和0%死亡的最大给药剂量为32.62 g/kg,因此选取给生药量99.55~32.00 g/kg之间进行LD50测试,每组剂量以1.00:0.80递减,按小鼠体重计算用药量。各组剂量设置如表3,共设计6个给药组,1个空白组。
表3 西藏凹乳芹叶提取物组剂量表
各组灌胃后,空白组小鼠活动正常,毛色光泽,饮食及大小便正常,未见异常状态;各给药组均表现为小鼠行动迟缓,卧伏,双目微闭,自发性活动减少,精神萎靡,30 min后部分小组出现拉稀,口鼻中有分泌物现象,且剂量越大,情况越严重。同时高剂量组30 min后开始出现死亡,并且死亡前抽搐,而其余组小鼠死亡之前表现为四肢无力,瘫卧不动,呼吸急促且微弱,随着药物剂量增大,死亡数量越多,死亡时间越短。其中高剂量组99.55 g/kg灌胃给药后1 h就有小鼠死亡,死亡主要集中在1 h内;中间剂量组50.97和63.71 g/kg死亡主要集中在2 h;低剂量组(32.62 g/kg)无小鼠死亡,为不引起小鼠死亡的最大剂量,因此MTD为32.62 g/kg,具体情况见表4。根据各组小鼠死亡数量用改进寇氏法计算西藏凹乳芹叶提取物的LD50为58.27 g/kg,95%可信限为51.36~66.11 g/kg。
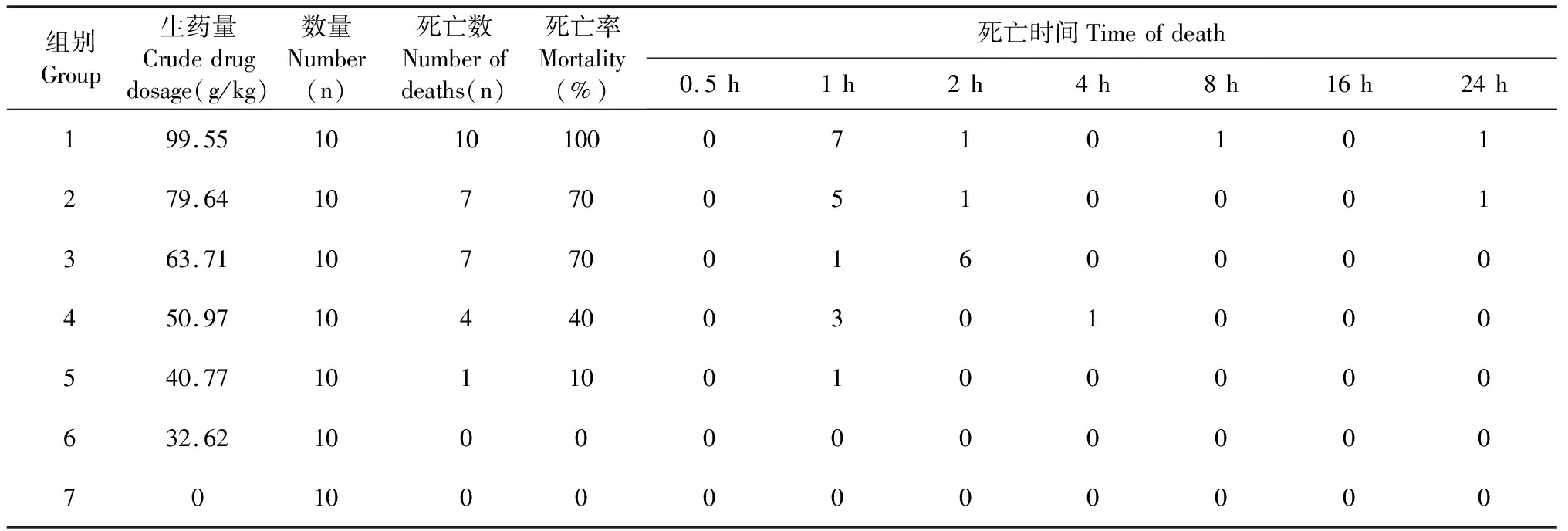
表4 各组小鼠死亡情况
2.2.2 小鼠剖检结果
试验期间对死亡小鼠进行解剖发现:胃壁完整,胃内容物为黑青色(与药液颜色同),心肺正常,未见出血点、坏死灶;肝颜色正常呈颗粒状,无明显肿胀,肾脏颜色正常呈颗粒状、肠内容物呈黑青色,其它脏器未见明显异常,小鼠死亡后解剖情况大致相同。实验结束后对小鼠进行解剖发现:胃壁完整,胃内容物和胃壁正常,心肺正常,未见出血点及坏死灶;肝、肾脏颜色正常,但个别小鼠肝肾有肉眼可见轻微颗粒状,其它脏器未发现异常。
2.2.3 西藏凹乳芹叶提取物对小鼠肝肾功能、脏器指数、摄食量曲线和体重变化的影响
与空白组相比,西藏凹乳芹叶组(西藏凹乳芹叶MTD组)的AST、ALT、Cr及BUN均有升高趋势,其中BUN显著性升高(图4),提示灌胃量32.62 g/kg可能使小鼠肝肾损伤,此结果与解剖发现的小鼠肝肾有肉眼可见颗粒状变化结果一致。另外,与空白组相比,西藏凹乳芹叶组对脾脏指数、肾脏指数、胸腺指数无明显影响,但可明显升高肝脏指数(图5),这也与解剖发现的西藏凹乳芹叶组小鼠肝脏有肉眼可见颗粒状变化一致。由西藏凹乳芹叶组和空白组的体重变化曲线和摄食量变化曲线可知(图6),两组平均体重变化及摄食量趋势基本一致,说明西藏凹乳芹叶提取物在最大耐受剂量32.62 g/kg时不影响小鼠的体重和摄食量。

图4 西藏凹乳芹叶提取物对小鼠肝肾功能生化指标的影响
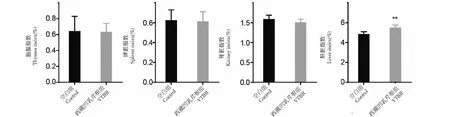
图5 西藏凹乳芹叶提取物对小鼠各脏器指数的影响

图6 西藏凹乳芹叶提取物对小鼠体重及摄食量的影响
2.3 西藏凹乳芹根、叶提取物对小鼠亚急性毒性结果
2.3.1 小鼠一般情况及剖检结果
各组小鼠在试验期间活动正常,毛发光泽、二便无异常。实验结束后,对各组小鼠大体解剖显示:胃壁完整,胃内容物正常,肺未见出血点及坏死灶,心、脑、肝、胸腺、脾、肾等组织未见异常。
2.2.3 西藏凹乳芹根、叶提取物对小鼠肝肾功能、脏器指数、摄食量曲线和体重变化的影响
与空白组相比,西藏凹乳芹根、叶各组的肝肾功能指标(AST、ALT、Cr及BUN)、肝脏指数、脾脏指数、肾脏指数及胸腺指数均无明显差异(P>0.05,图7和8)。另外,由西藏凹乳芹根、叶各组的体重变化曲线和摄食量变化曲线可知,各组平均体重及摄食量变化趋势基本一致(图9),说明西藏凹乳芹根高、低剂量组(7.74和3.87 g/kg)和西藏凹乳芹叶高、低剂量组(2.91和1.45 g/kg)长期给药并不影响小鼠肝肾功能、脏器指数,也不影响体重和摄食量,长期重复服用未出现毒性反应。

图9 西藏凹乳芹根、叶提取物对小鼠体重及摄食量的影响

图7 西藏凹乳芹根、叶提取物对小鼠肝肾功能生化指标的影响
3 讨论
本研究首先对西藏凹乳芹根、叶提取物进行急性毒性实验,根据实验数据,采用改良寇氏法得出西藏凹乳芹根提取物的LD50为154.81 g/kg,95%可信限为143.09~167.50 g/kg;西藏凹乳芹叶提取物的LD50为58.27 g/kg,95%可信限为51.36~66.11 g/kg。目前对中药毒性的分级尚无统一定论,孙文燕[12]在《中药毒性分级概况与研究思路探讨》中的中药急性毒性分级中显示LD50>15 g/kg为无毒物质,西藏凹乳芹根、叶提取物LD50均远远大于15 g/kg,均可判定为无毒物质。在试验过程中,发现西藏凹乳芹根、叶提取物不引起小鼠死亡的最大耐受量MTD分别为108.28 g/kg和32.62 g/kg,在此剂量虽不引起动物死亡,但通过解剖观察肝肾病理变化、生化指标检测、体重及摄食量变化发现西藏凹乳芹根、叶提取物均可引起肝肾功能损伤,另外,西藏凹乳芹叶在MTD时对小鼠体重及摄食量均无影响,而西藏凹乳芹根在MTD时可使小鼠体重降低,摄食量反而增加,这可能与西藏凹乳芹根影响小鼠机体代谢有关,但具体机制还需要进一步研究。

图8 西藏凹乳芹根、叶提取物对小鼠各脏器指数的影响
西藏凹乳芹根、叶在最大耐受量时均引起肝肾功能损伤,为观察其长期食用是否会有毒性反应,进一步做亚急性毒性实验,其结果显示:各组小鼠一般情况及脏器大体解剖未见异常;体重、摄食量、脏器指数与对照组相比差异均无统计学意义;各剂量组肝、肾功能生化指标与对照组相比也无明显差别,未发现西藏凹乳芹根、叶长期服用有毒性反应。因此,本研究未观察到西藏凹乳芹根、叶提取物有明显的急性经口毒性和亚急性毒性,在试验剂量范围内有较高的安全性,为西藏凹乳芹根、叶的开发利用提供毒理学依据。
