赛北紫堇中的酚类成分及其细胞毒活性研究
2020-07-29南泽东韩广田李喜安任华忠王寿峰
南泽东,韩广田,李喜安,任华忠,鱼 江,王寿峰,郭 力
1成都中医药大学药学院 西南道地药材协同创新中心 中药资源系统研究与开发利用国家重点实验室,成都 611137;2乐山职业技术学院,乐山 614000;3四川轻化工大学化工学院,自贡 743000
赛北紫堇Corydalisimpatiens为罂粟科紫堇属植物,彝族药名瓦都,为一年生或两年生草本,全草入药,具有清热解毒、消肿镇痛之功效[1],生长于海拔1 700 m附近的林下、山坡灌丛下、草丛中或地边路旁。主要分布于内蒙古、甘肃、青海、四川及西藏等地[2]。目前,已有多篇文献[3,4]对该属植物的化学成分及其药理活性进行了综述,表明该属植物主要含有生物碱类成分,之外还含有黄酮、甾体、挥发油等成分,具有广泛的药理活性,如抗肿瘤、抗炎镇痛、抗心律失常、保肝等。由于生长环境、产量等原因,对赛北紫堇的现代研究一直滞后,极大地限制了其药用价值的发挥。目前,已有的对赛北紫堇研究的报道,主要集中在质量标准[5]、含量测定[6]、总生物碱药理活性[7]以及化学成分[8]的研究。为进一步阐明该药材的药效物质基础,本实验采用硅胶柱色谱、凝胶Sephadex LH-20色谱、半制备高效液相色谱等分离技术对赛北紫堇成分进行分离,并采用四甲基唑蓝(MTT)法测定化合物对人肝癌HepG2和SMMC-7721细胞的体外抑制活性。
1 仪器与材料
Bruker-600M、Bruker-400M 核磁共振仪(德国Bruker公司);Agilent 6320 型质谱仪(美国Agilent 公司);X-4 型显微熔点测定仪(北京泰克仪器有限公司制造,温度未校正);Hanon P850 全自动型旋光仪(济南海能仪器股份有限公司);LC-3000高效液相色谱仪(北京创新通恒科技有限公司);Agilent Eclipse XDB-C18(10 mm × 250 mm,5 μm)半制备色谱柱;CO2培养箱(日本SANYO公司);荧光倒置显微镜(日本Nikon公司);DNM-9602G型全自动酶标仪(北京普朗新技术有限公司);BD Transwell 小室(美国Corning公司);薄层色谱和柱色谱用硅胶(青岛海洋化工厂),ODS柱色谱材料(德国Merk公司),Sephadex LH-20(瑞士Pharmacia 公司);HPLC试剂(美国MREDA公司),实验过程中所用的乙醇、二氯甲烷、石油醚、乙酸乙酯、丙酮为分析纯(天津大茂化学试剂厂)。DMEM培养基(美国HyClone公司);胎牛血清(上海生工生物工程公司);四甲基唑蓝(美国Sigma公司)。
赛北紫堇药材2016年10月购于西藏拉萨药材市场,由四川省食品药品学校秦运潭副教授鉴定为赛北紫堇Corydalisimpatiens,标本现存于乐山职业技术学院药学系(No.CI201610)。细胞毒活性测试所用的人肝癌HepG2、SMMC-7721细胞由四川大学华西基础医学与法医学院提供。
2 试验方法
2.1 提取分离
干燥赛北紫堇药材15 kg,粉碎后用90%乙醇回流提取3次,每次1 h,合并3次提取液,减压浓缩得浸膏1 kg。取浸膏加适量水混悬,依次用石油醚、乙酸乙酯和正丁醇萃取,回收溶剂后分别得到石油醚部位95 g,乙酸乙酯部位260 g,正丁醇部位320 g。采用酸溶碱沉法对260 g乙酸乙酯部位进行处理,将其分散到2 L蒸馏水中,用1 mol/LHCl调PH至3~4,滤去不溶物得酸性部位160 g,然后用1 mol/LNaOH调PH至9~10,得到碱性部位63 g。
碱性部位(63 g)进行硅胶柱(200~300目,1.2 kg)色谱分离,用二氯甲烷-甲醇(50∶1、20∶1、10∶1、4∶1、2∶1)梯度洗脱,得到10个主要流分B.1~B.10。B.3经硅胶柱色谱,用石油醚-丙酮(3∶1→1∶3)梯度洗脱,得到8个主要流分B.3-1~B.3-8。B.3-2经HPLC(30%乙腈-水)色谱分离,得化合物17(8 mg)。B.3-6反复经Sephadex LH-20凝胶柱(二氯甲烷-甲醇,1∶1)纯化得化合物14(6 mg);B.5经硅胶柱色谱,用石油醚-二氯甲烷-甲醇(10∶10∶1→2∶2∶1)梯度洗脱,得到10个主要流分B.5-1~B.5-10。B.5-8经HPLC(15%乙腈-水)色谱分离,得化合物15(4 mg)和20(5 mg);B.6经HPLC(10%乙腈-水)色谱分离,得化合物13(8 mg)、16(12 mg)和18(20 mg);B.9反复经Sephadex LH-20凝胶柱(二氯甲烷/甲醇,1∶1)色谱分离,得化合物12(11 mg);B.10经硅胶柱色谱,用石油醚-二氯甲烷-甲醇(3∶3∶1)洗脱,得化合物19(4 mg)。
酸性部位(160 g)进行硅胶柱(200~300目,1.2 kg)色谱分离,用二氯甲烷-甲醇(50∶1、20∶1、10∶1、4∶1、2∶1)梯度洗脱,得到12个主要流分Fr.1~Fr.10。Fr.3经Sephadex LH-20凝胶柱(二氯甲烷-甲醇,1∶1)色谱分离,得到2个主要流分Fr.3-1~Fr.3-2。Fr.3-1经HPLC(45%乙腈-水)色谱分离,得化合物10(12 mg);Fr.4经硅胶柱色谱,用石油醚-丙酮(3∶1→1∶3)梯度洗脱,得到4个主要流分Fr.4-1~Fr.4-4。Fr.4-3经HPLC(40%乙腈-水)色谱分离,得化合物1(5 mg)和9(10 mg);Fr.5经ODS色谱分离,用甲醇-水(20%、40%、60%)梯度洗脱,得到3个主要流分Fr.5-1~Fr.5-3。Fr.5-2经HPLC(30%乙腈-水)色谱分离,得化合物7(3 mg)和8(6 mg);Fr.6经ODS色谱分离,用甲醇-水(20%、40%、60%)梯度洗脱,得到4个主要流分Fr.6-1~Fr.6-4。Fr.6-2经HPLC(35%甲醇-水)色谱分离,得化合物11(8 mg)和6(13 mg);Fr.10经硅胶柱色谱分离,用二氯甲烷-甲醇(10∶1、6∶1、4∶1、2∶1)梯度洗脱,得到5个主要流分Fr.10-1~Fr.10-5。Fr.10-3经HPLC(18%乙腈-水)色谱分离,得化合物3(15 mg);Fr.10-4反复经HPLC(15%乙腈-水)色谱分离,得化合物5(20 mg)、2(24 mg)和4(13 mg)。
2.2 活性测试
用MTT法进行测试,将分离得到的20个酚类化合物分别用DMSO溶解后配成10 mmol/L储备液,临用前稀释。将对数生长期人肝癌细胞HepG2、SMMC-7721以2×103个/cm2的密度接种到96孔板中,每孔100 μL,并设空白组、对照组以及给药组,每组设3个平行孔,于5% CO2,37 ℃培养24 h。然后更换为受试化合物分别为2.5、5.0、10、20、40 μmol/L的含药培养基,继续培养48 h后,更换为无血清培养基,避光条件下每孔加入5 mg/mL体积为20 μL的MTT溶液,继续于37 ℃孵化4 h,然后弃去培养液,每孔加入DMSO 150 μL振摇10 min后用酶标仪测量波长在570 nm处的吸光度OD值。按下述公式计算化合物对HepG2、SMMC-7721细胞增殖的抑制率。抑制率=(OD对照-OD加药)/(OD对照-OD空白)×100 %。实验重复3次,取平均值并用SPSS软件计算化合物的半数抑制浓度IC50值。
3 实验结果
3.1 结构鉴定

化合物2为淡黄色无定形粉末,UV254下显暗斑;ESI-MS:m/z409[M+H]+,结合13C NMR数据给出分子式为C22H16O8,不饱和度为15。1H NMR(600 MHz,CD3OD)δ:7.78(1H,d,J=2.4 Hz,H-2′),7.48(1H,dd,J=2.4,8.4 Hz,H-6′),7.10(2H,d,J=8.4 Hz,H-3′′,H-7′′),6.85(1H,d,J=8.4 Hz,H-5′),6.63(2H,d,J=8.4 Hz,H-4′′,6′′),6.28(1H,s,H-6),4.06(2H,s,H-1′′);13C NMR(150 MHz,CD3OD)δ:148.1(C-2),137.0(C-3),177.5(C-4),155.5(C-5),98.8(C-6),160.3(C-7),107.8(C-8),163.0(C-9),104.5(C-10),124.4(C-1′),116.2(C-2′),146.1(C-3′),148.7(C-4′),116.3(C-5′),121.6(C-6′),28.2(C-1′′),133.2(C-2′′),130.2(C-3′′,7′′),116.0(C-4′′,6′′),156.3(C-5′′)。以上数据与文献[10]报道一致,故鉴定该化合物为8-对羟苄基槲皮素。
化合物3为淡黄色无定形粉末,UV254下显暗斑;ESI-MS:m/z393[M+H]+,结合碳谱数据得到其分子式为C22H16O7,不饱和度为15。1H NMR(600 MHz,CD3OD)δ:7.93(2H,d,J=8.4 Hz,H-2′,6′),7.06(2H,d,J=8.4 Hz,H-3′′,H-7′′),6.85(2H,d,J=8.4 Hz,H-3′,5′),6.64(2H,d,J=8.4 Hz,H-4′′,6′′),6.29(1H,s,H-6),4.06(2H,s,H-1′′);13C NMR(150 MHz,CD3OD)δ:148.1(C-2),137.0(C-3),177.6(C-4),155.7(C-5),98.8(C-6),160.4(C-7),107.6(C-8),163.1(C-9),104.6(C-10),123.9(C-1′),130.8(C-2′,6′),116.2(C-3′,5′),160.5(C-4′),28.2(C-1′′),133.1(C-2′′),130.1(C-3′′,7′′),116.0(C-4′′,6′′),156.4(C-5′′)。以上数据与文献[11]报道一致,故鉴定该化合物为8-对羟苄基山奈酚一致。
化合物4为淡黄色无定形粉末,UV254下显暗斑;ESI-MS:m/z409[M+H]+,结合13C NMR 数据给出分子式为C22H16O8,不饱和度为15。1H NMR(600 MHz,CD3OD)δ:7.73(1H,d,J=1.8 Hz,H-2′),7.62(1H,dd,J=1.8,8.4 Hz,H-6′),7.14(2H,d,J=8.4 Hz,H-3′′,H-7′′),6.87(1H,d,J=8.4 Hz,H-5′),6.62(2H,d,J=8.4 Hz,H-4′′,6′′),6.44(1H,s,H-8),3.86(2H,s,H-1′′);13C NMR(150 MHz,CD3OD)δ:147.7(C-2),137.2(C-3),177.3(C-4),159.3(C-5),112.7(C-6),160.5(C-7),93.7(C-8),156.3(C-9),104.4(C-10),124.3(C-1′),116.0(C-2′),146.2(C-3′),148.7(C-4′),116.2(C-5′),121.6(C-6′),27.8(C-1′′),133.6(C-2′′),130.6(C-3′′,7′′),115.7(C-4′′,6′′),156.1(C-5′′)。以上数据与文献[12]报道一致,故鉴定该化合物为6-对羟苄基槲皮素。
化合物5为淡黄色无定形粉末,UV254下显暗斑;ESI-MS:m/z303[M+H]+,结合13C NMR数据给出分子式为C15H10O7,不饱和度为11。1H NMR(600 MHz,DMSO-d6)δ:12.50(1H,s,5-OH),7.69(1H,d,J=2.4 Hz,H-2′),7.55(1H,dd,J=2.4,8.4 Hz,H-6′),6.89(1H,d,J=8.4 Hz,H-5′),6.41(1H,d,J=2.4 Hz,H-8),6.19(1H,d,J=2.4 Hz,H-6);13C NMR(150 MHz,DMSO-d6)δ:146.3(C-2),135.2(C-3),175.3(C-4),155.6(C-5),97.7(C-6),163.4(C-7),92.8(C-8),160.2(C-9),102.5(C-10),121.4(C-1′),114.5(C-2′),144.5(C-3′),147.2(C-4′),115.1(C-5′),119.4(C-6′)。以上数据与文献[13]报道一致,故鉴定该化合物为槲皮素。
化合物6为淡黄色无定形粉末,UV254下显暗斑;ESI-MS:m/z287[M+H]+,结合13C NMR 数据给出分子式为C15H10O6,不饱和度为11。1H NMR(600 MHz,CD3OD)δ:8.07(2H,d,J=8.4 Hz,H-2′,6′),6.89(2H,d,J=8.4 Hz,H-3′,5′),6.37(1H,s,H-8),6.17(1H,s,H-6);13C NMR(150 MHz,CD3OD)δ:148.0(C-2),137.1(C-3),177.3(C-4),162.5(C-5),99.3(C-6),165.6(C-7),94.5(C-8),158.2(C-9),104.5(C-10),123.7(C-1′),130.7(C-2′,6′),116.3(C-3′,5′),160.5(C-4′)。上述数据与文献[14]对照基本一致,故鉴定该化合物为山奈酚。
化合物7为淡黄色无定形粉末,ESI-MS:m/z301[M+H]+,结合13C NMR 数据给出分子式为C16H12O6,不饱和度为11。1H NMR(600 MHz,DMSO-d6)δ:12.97(1H,s,5-OH),7.56(1H,d,J=1.8 Hz,H-2′),7.55(1H,dd,J=1.8,8.4 Hz,H-6′),6.93(1H,d,J=8.4 Hz,H-5′),6.87(1H,s,H-3),6.47(1H,d,J=2.4 Hz,H-8),6.17(1H,d,J=2.4 Hz,H-6),3.89(3H,s,3′-OCH3);13C NMR(150 MHz,DMSO-d6)δ:163.5(C-2),103.1(C-3),181.6(C-4),161.4(C-5),99.0(C-6),164.9(C-7),94.1(C-8),157.4(C-9),103.1(C-10),120.3(C-1′),110.1(C-2′),150.9(C-3′),148.0(C-4′),115.8(C-5′),120.3(C-6′),55.9(3′-OCH3)。上述数据与文献[15]报道基本一致,故鉴定该化合物为金圣草黄素。
化合物8为淡黄色无定形粉末,UV254下显暗斑;ESI-MS:m/z287[M-H]-,结合碳谱数据得出分子式为C15H12O6,不饱和度为10。1H NMR(400 MHz,CDCl3)δ:13.12(1H,s,1-OH),7.37(1H,d,J=9.2 Hz,H-6),7.15(1H,d,J=9.2 Hz,H-5),6.35(1H,d,J=2.4 Hz,H-4),6.32(1H,d,J=2.4 Hz,H-2),5.97(1H,s,7-OH),4.03(3H,s,8-OCH3),3.88(3H,s,3-OCH3);13C NMR(100 MHz,CDCl3)δ:163.6(C-1),97.0(C-2),166.5(C-3),92.1(C-4),157.2(C-4a),113.8(C-5),122.5(C-6),144.3(C-7),150.7(C-8),114.7(C-8a),180.6(C-9),104.0(C-9a),145.5(C-10a),55.8(3-OCH3),62.8(8-OCH3)。以上数据与文献[16]报道基本一致,故鉴定该化合物为1,7-二羟基-3,8-二甲氧基口山酮。
化合物9为淡黄色无定形粉末,ESI-MS:m/z301[M-H]-,结合13C NMR数据给出分子式为C16H14O6,不饱和度为10。1H NMR(400 MHz,CDCl3)δ:12.68(1H,s,1-OH),7.64(1H,dd,J=1.6,8.0 Hz,H-8),7.17(1H,t,J=8.0 Hz,H-7),7.09(1H,dd,J=1.6,8.0 Hz,H-6),6.46(1H,s,H-4),3.93(3H,s,5-OCH3),3.90(3H,s,3-OCH3),3.87(3H,s,2-OCH3);13C NMR(100 MHz,CDCl3)δ:153.8(C-1),131.6(C-2),159.7(C-3),90.7(C-4),152.8(C-4a),148.0(C-5),115.2(C-6),123.3(C-7),116.2(C-8),120.7(C-8a),180.7(C-9),103.9(C-9a),145.9(C-10a),56.1(2-OCH3),56.2(3-OCH3),60.6(8-OCH3)。上述数据与文献[17]报道基本一致,故鉴定该化合物为1-羟基-2,3,5-三甲氧基口山酮。
化合物10为淡黄色无定形粉末,UV254下显暗斑;ESI-MS:m/z331[M-H]-,结合13C NMR数据给出分子式为C17H16O7,不饱和度为10。1H NMR(400 MHz,CDCl3)δ:12.48(1H,s,1-OH),7.63(1H,dd,J=1.6,8.0 Hz,H-7),7.19(1H,d,J=8.0 Hz,H-7),7.13(1H,d,J=1.6 Hz,H-5),4.10(3H,s,3-OCH3),3.96(3H,s,6-OCH3),3.94(3H,s,2-OCH3),3.89(3H,s,4-OCH3);13C NMR(100 MHz,CDCl3)δ:150.2(C-1),132.5(C-2),153.9(C-3),135.2(C-4),145.4(C-4a),115.7(C-5),148.4(C-6),116.1(C-7),123.4(C-8),120.5(C-8a),181.3(C-9),104.7(C-9a),146.0(C-10a),61.6(2-OCH3),61.5(3-OCH3),60.9(4-OCH3),56.2(6-OCH3)。以上波谱数据与文献[18]报道基本一致,故鉴定该化合物为1-羟基-2,3,4,6-四甲氧基口山酮。
化合物11为无色油状物,ESI-MS:m/z287[M+H]+,结合13C NMR数据给出分子式为C16H14O5,不饱和度为10。1H NMR(400 MHz,(CD3)2CO)δ:7.62(1H,d,J=15.6 Hz,H-7),7.61(1H,d,J=2.0 Hz,H-2),7.51(2H,d,J=8.4 Hz,H-2′,H-6′),7.11(1H,dd,J=8.0,2.0 Hz,H-6),6.89(2H,d,J=8.4 Hz,H-3′,5′),6.87(1H,d,J=8.0 Hz,H-5),6.38(1H,d,J=15.6 Hz,H-8),3.90(3H,s,3-OCH3);13C NMR(100 MHz,(CD3)2CO)δ:127.0(C-1),111.3(C-2),148.7(C-3),149.8(C-4),116.2(C-5),123.8(C-6),145.6(C-7),115.9(C-8),169.0(C-9),145.9(C-1′),130.9(C-2′,6′),116.6(C-3′,5′),160.4(C-4′),56.3(3-OCH3)。以上波谱数据与文献[19]报道一致,故鉴定该化合物为p-hydroxyphenylferulate。
化合物12为无色针状晶体(CH3OH),熔点为268~269 ℃;UV254下显亮蓝色荧光;ESI-MS:m/z177[M-H]-,结合碳谱数据得出其分子式为C9H6O4,不饱和度为7。1H NMR(600 MHz,CD3OD)δ:7.77(1H,d,J=9.6 Hz,H-4),6.93(1H,s,H-5),6.75(1H,s,H-8),6.17(1H,d,J=9.6 Hz,H-3);13C NMR(150 MHz,CD3OD)δ:164.3(C-2),112.8(C-3),146.0(C-4),112.5(C-4a),113.0(C-5),144.5(C-6),152.0(C-7),103.6(C-8),150.5(C-8a)。以上波谱数据与文献[20]报道一致,故鉴定该化合物为5,7-二羟基香豆素一致。
化合物13为淡黄色无定形粉末,UV254下显暗斑;ESI-MS:m/z229[M-H]-,结合13C NMR数据给出分子式为C14H14O3,不饱和度为8。1H NMR(600 MHz,CD3OD)δ:7.15(4H,d,J=8.4 Hz,H-2,6,2′,6′),6.75(4H,d,J=8.4 Hz,H-3,5,3′,5′),4.39(4H,s,H-7,7′);13C NMR(150 MHz,CD3OD)δ:130.3(C-1,1′),130.8(C-1,6,2′,6′),116.1(C-3,5,3′,5′),158.3(C-4,4′),72.7(C-7,7′)。以上波谱数据与文献[21]报道一致,故鉴定该化合物为4,4′-二羟基二苄醚。
化合物14为白色无定形粉末,UV254下显暗斑;ESI-MS:m/z167[M-H]-,结合13C NMR数据给出分子式为C9H12O3,不饱和度为4。1H NMR(600 MHz,CD3OD)δ:6.79(1H,d,J=1.8 Hz,H-2),6.70(1H,d,J=7.8 Hz,H-5),6.64(1H,dd,J=1.8,7.8 Hz,H-6),3.83(3H,s,3-OCH3),3.70(2H,t,J=7.2 Hz,H-8),2.73(2H,t,J=7.2 Hz,H-7);13C NMR(150 MHz,CD3OD)δ:131.8(C-1),113.7(C-2),148.8(C-3),145.9(C-4),116.1(C-5),122.4(C-6),39.8(C-7),64.5(C-8),56.3(3-OCH3)。以上波谱数据与文献[22]报道一致,故鉴定该化合物为3-甲氧基-4-羟基苯乙醇。
化合物15白色无定形粉末,ESI-MS:m/z153[M-H]-,结合13C NMR数据给出分子式为C8H10O3,不饱和度为4。1H NMR(600 MHz,CD3OD)δ:6.67(1H,d,J=7.8 Hz,H-5),6.64(1H,d,J=1.8 Hz,H-2),6.52(1H,dd,J=1.8,7.8 Hz,H-6),3.67(2H,t,J=7.2 Hz,H-8),2.66(2H,t,J=7.2 Hz,H-7);13C NMR(150 MHz,CD3OD)δ:131.8(C-1),117.1(C-2),146.1(C-3),144.6(C-4),116.3(C-5),121.2(C-6),39.8(C-7),64.6(C-8)。以上数据与文献[23]报道一致,故鉴定该化合物为3,4-二羟基苯乙醇。
化合物16白色针状晶体(甲醇),熔点为92~94 ℃;UV254下显暗斑;ESI-MS:m/z137[M-H]-,结合13C NMR数据给出分子式为C8H10O2,不饱和度为4。1H NMR(600 MHz,CD3OD)δ:7.03(2H,d,J=8.4 Hz,H-3,5),6.70(2H,d,J=8.4 Hz,H-2,6),3.68(2H,t,J=7.2 Hz,H-8),2.71(2H,t,J=7.2 Hz,H-7);13C NMR(150 MHz,CD3OD)δ:131.0(C-1),130.9(C-2,6),116.1(C-3,5),156.8(C-4),39.4(C-7),64.6(C-8)。上述数据与文献[24]报道基本一致,故鉴定该化合物为对羟基苯乙醇。
化合物17为白色无定形粉末,UV254下显暗斑;ESI-MS:m/z151[M-H]-,结合13C NMR数据给出分子式为C9H12O2,不饱和度为4。1H NMR(600 MHz,CDCl3)δ:7.19(2H,d,J=8.4 Hz,H-3,5),6.77(2H,d,J=8.4 Hz,H-2,6),4.43(2H,s,H-7),3.53(2H,q,J=7.2 Hz,H-1′),1.23(3H,t,J=7.2 Hz,H-2′);13C NMR(150 MHz,CDCl3)δ:130.4(C-1),115.2(C-2,6),129.6(C-3,5),155.3(C-4),72.4(C-7),65.5(C-1′),15.2(C-2′)。以上波谱数据与文献[25]报道一致,故鉴定该化合物为对羟苄基乙基醚。
化合物18白色针状晶体(CH3OH),熔点为114~120 ℃,UV254下显暗斑;ESI-MS:m/z123[M-H]-,结合13C NMR 数据给出分子式为C7H8O2,不饱和度为4。1H NMR(600 MHz,CD3OD)δ:7.16(2H,d,J=8.4 Hz,H-3,5),6.75(2H,d,J=8.4 Hz,H-2,6),4.48(2H,s,H-7);13C NMR(150 MHz,CD3OD)δ:133.5(C-1),116.1(C-2,6),129.8(C-3,5),157.8(C-4),65.1(C-7)。以上数据与文献[26]报道一致,故鉴定该化合物为对羟基苯甲醇。
化合物19为白色针状晶体(CH3OH),熔点为139~141℃,UV254下显暗斑;ESI-MS:m/z125[M-H]-,结合13C NMR数据给出分子式为C6H6O3,不饱和度为4。1H NMR(600 MHz,CD3OD)δ:7.43(1H,d,J=1.8 Hz,H-3),7.40(1H,dd,J=1.8,7.8 Hz,H-5),6.77(1H,d,J=7.8 Hz,H-6);13C NMR(150 MHz,CD3OD)δ:123.6(C-1),145.9(C-2),115.6(C-3,5),150.8(C-4),117.8(C-6)。以上波谱数据与文献[27]报道一致,故鉴定该化合物为1,2,4-苯三酚。
化合物20为白色片状晶体(CH3OH),熔点为102~103 ℃,UV254下显暗斑;ESI-MS:m/z109[M-H]-,结合13C NMR 数据得到分子式为C6H6O2,不饱和度为4。1H NMR(600 MHz,CD3OD)δ:7.87(2H,dd,J=1.8,7.2 Hz,H-3,6),6.80(2H,dd,J=1.8,7.2 Hz,H-4,5);13C NMR(150 MHz,CD3OD)δ:163.1(C-1,2),132.9(C-4,5),116.0(C-3,6)。以上波谱数据与文献[28]报道一致,故鉴定该化合物为邻二苯酚。
3.2 活性测试结果
测试结果(见表1)显示化合物2、3对人肝癌HepG2具有中等抑制活性,IC50值分别为16.8和19.2 μmol/L(阳性对照药顺铂IC50值为4.8 μmol/L);化合物11对人肝癌SMMC-7721具有较弱的抑制活性,IC50值分别为24.6 μmol/L(阳性对照药顺铂IC50值为5.4 μmol/L);其他化合物对人肝癌细胞HepG2、SMMC-7721没有明显的抑制作用(IC50值都大于40 μmol/L)。
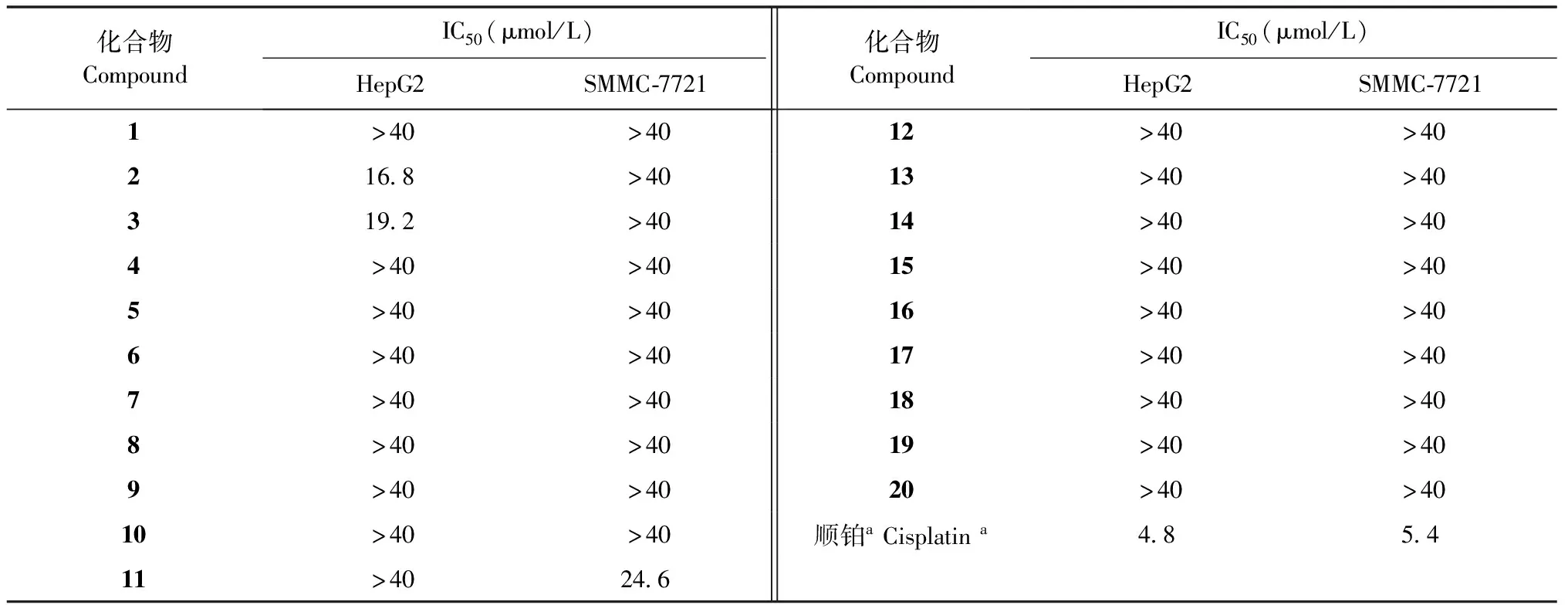
表1 化合物1~20的体外抗肿瘤活性
5 讨论
本课题对赛北紫堇90%乙醇提取物的乙酸乙酯萃取部位化学成分进行系统研究,研究结果表明该植物中主要含有生物碱类成分(另文报道),酚类成分。同时也对所有分离得到的酚类化合物进行了抗人肝癌细胞HepG2和SMMC-7721细胞毒活性测试,结果显示化合物2和3对人肝癌HepG2具有中等抑制活性,化合物11对人肝癌SMMC-7721具有较弱的抑制活性,而其他酚类化合物对上述两种受试癌细胞没有明显的抑制作用。本研究将为该药材的药效物质基础的阐明、进一步的质量控制及其他药理作用的深入研究具有一定的参考价值。
