ISA 61 VG佐剂增强单核细胞增生李斯特氏菌灭活疫苗的保护性免疫应答
2020-07-29朱腾飞孟凡增姚浩王玉婷焦新安殷月兰
朱腾飞,孟凡增,姚浩,王玉婷,焦新安,殷月兰
·医药生物技术·
ISA 61 VG佐剂增强单核细胞增生李斯特氏菌灭活疫苗的保护性免疫应答
朱腾飞*,孟凡增*,姚浩,王玉婷,焦新安,殷月兰
教育部农业和农产品国际合作联合实验室/农业部农产品质量安全生物性危害因子 (动物源) 控制重点实验室/江苏省动物重要疫病和人兽共患病防控协同创新中心/江苏省人兽共患病重点实验室/扬州大学 生物科学与技术学院,江苏 扬州 225009
单核细胞增生李斯特氏菌 (,) 是重要的人兽共患李斯特氏菌病的致病菌,疫苗免疫是预防该病原菌感染的有效手段之一。本研究研制了添加矿物油佐剂MontanideTMISA 61 VG的新型灭活细菌疫苗,并对其安全性和免疫应答特性进行了研究。结果表明,ISA 61 VG佐剂疫苗具有较好的安全性;诱导小鼠产生的抗李斯特氏菌溶血素O抗体滴度以及IgG2a/IgG1比值显著高于无佐剂免疫组;在致死剂量攻毒下,能对小鼠提供100%的免疫保护。因此,ISA 61VG佐剂能显著增强灭活疫苗诱导宿主产生体液免疫和细胞免疫应答的能力,从而提高灭活疫苗的保护性免疫应答作用,是预防人和动物感染的潜在疫苗候选株。
单核细胞增生李斯特氏菌,佐剂,灭活疫苗,安全性,免疫效力
单核细胞增生李斯特氏菌(,) 是一种革兰氏阳性、兼性胞内寄生菌,能通过污染的食物感染人类和动物导致李斯特氏菌病[1-2]。在自然界中广泛分布,能感染40多种动物,是重要的人兽共患致病菌,已经引起多个国家暴发李斯特氏菌病。2017–2018年南非暴发李斯特氏菌病,最终导致216人死亡,总死亡率27%[2];2011–2017年,我国报道了562例李斯特菌病病例,总死亡率约为27.4%[3]。能跨越肠道屏障,感染免疫功能低下人群,引起孕妇流产、败血症、脑膜炎等严重并发症[4],死亡率为25%–30%。为了预防和控制李斯特氏菌病发生,开发一种安全有效的李斯特氏菌疫苗的工作意义重大。
为胞内寄生菌,通过表达的李斯特菌溶血素O、磷脂酶PI-PLC等毒力因子裂解宿主巨噬细胞吞噬泡,进入细胞质中并进行繁殖[5];在其表达的肌动蛋白聚集因子ActA的作用下进行极向运动,从而逃逸至相邻细胞中,在宿主体内进行扩散和传播[6]。针对胞内感染和致病的特性,要求李斯特菌疫苗能够诱导强烈的细胞免疫应答。多年来,许多研究者在减毒活疫苗[7]、灭活但代谢活性(KBMA) 疫苗[8]、亚单位疫苗[9]和纳米疫苗[10]等方面开展了相关研究[11],在预防和治疗李斯特氏菌病方面取得了一定的进展。通过敲除强毒野生型菌株的多个毒力基因,能显著降低的毒力,并能较好地诱导细胞免疫应答[12],但减毒活疫苗具有毒力返祖现象,具有导致免疫低下的个体患李斯氏特菌病的风险[13-14]。灭活但有代谢活性(KBMA) 疫苗中的具有代谢能力,不能在宿主体内存活和复制,有一定的安全性[8],能诱导宿主体液免疫同时诱导保护性细胞免疫[7,15];目前KBMA疫苗研究仅局限于小鼠实验,尚未进入临床试验[16]。亚单位疫苗缺乏稳定性且免疫原性较弱,不能有效刺激免疫系统[9]。此外,新型纳米疫苗是一个可探索的研究方向,其稳定性和免疫保护作用有待于深入开展研究[17]。灭活疫苗问世相当长时间,经大量临床使用证实灭活疫苗有良好的免疫刺激效应,同时病原体不能在宿主体内复制传播从而具有良好的安全性[18]。考虑到李斯特氏菌病的易感人群是免疫系统功能低下的人群,因此具有较高安全性的灭活疫苗是预防感染的理想候选疫苗。
灭活疫苗是将病原微生物通过加热或甲醛等理化方法进行灭活,使其丧失感染性和毒性后仍保持良好的免疫原性,但是刺激宿主免疫应答的能力降低。因此,灭活细菌疫苗中必须加入佐剂,包裹灭活疫苗的抗原,使其长时间刺激抗原提呈细胞[19],从而增强灭活疫苗的免疫效力以及免疫保护作用[20]。疫苗佐剂主要分为凝胶佐剂、矿物油佐剂、乳胶佐剂和脂质体佐剂几大类[21]。疫苗佐剂的作用机制是“抗原库”效应,可在注射部位储存免疫原,可长时间刺激免疫系统产生免疫应答[22]。铝佐剂疫苗是最早应用于人体的疫苗,但铝佐剂疫苗具有激发抗体的时间较短、需多次免疫以及不能有效诱导细胞免疫应答等不足[23-24]。矿物油佐剂和抗原乳化联合使用,在制备成灭活疫苗后,可增强疫苗本身的免疫原性,促进抗原刺激宿主免疫系统产生特异性免疫应答[25-26]。MontanideTMISA 61 VG油包水(W/O) 矿物油佐剂混合疫苗乳化,能够有效增强小鼠的免疫保护水平,具有替代氢氧化铝凝胶佐剂的潜力[27-28]。
本研究采用油包水佐剂ISA 61 VG混合灭活乳化制备灭活疫苗的方案,研制了混合佐剂灭活李斯特氏菌疫苗,通过对小鼠进行安全性、体液免疫与细胞免疫以及保护性免疫应答等的测定,初步探究了ISA 61 VG作为李斯特氏菌疫苗佐剂的有效性以及安全性。
1 材料与方法
1.1 菌株与实验动物
LM4是一株从绵羊中分离得到的血清型为1/2a的单核细胞增生李斯特氏菌,由扬州大学江苏省人兽共患病学重点实验室保存。动物实验使用体重13–15 g的雌性6周龄BALB/c小鼠,购自北京维通利华实验动物技术有限公司。所有实验程序均经扬州大学比较医学中心批准,符合小鼠福利和伦理道德的要求。
1.2 仪器与试剂
脑心浸液培养基Brain Heart Infusion (BHI,Becton Dickinson and Company,US);磷酸盐缓冲盐水(PBS);40%甲醛(中国医药集团公司,中国上海);MontanideTMISA 61 VG (赛彼科特殊化学品(上海) 有限公司赠送);羊抗鼠酶标二抗(Goat Anti-mouse IgG,IgG1-HRP,IgG2a-HRP,Southern Biotech Inc. US);酶标仪(Bio Tek Instruments,US)。
1.3 甲醛灭活细菌的制备
将LM4菌株接种于BHI液体培养基,在37 ℃摇床培养箱内180 r/min振摇培养过夜。用磷酸盐缓冲盐水(PBS) 洗涤培养物3次,并用PBS重悬菌体,调整菌液光密度浊度600 nm (600) 为0.8,计算细菌数量(CFU),再次离心后,终浓度0.4%甲醛溶液重悬细菌,浓度为1×109CFU/mL,在37 ℃灭活24 h。分别用BHI平板以及5%色氨酸血平板在37 ℃下孵育5 d,对制备的灭活疫苗进行无菌检查。将灭活疫苗在20 ℃保存以待进一步使用。
1.4 佐剂混合疫苗的制备
将LM4在BHI液体培养基中培养至对数生长期,收获培养物并用PBS洗3遍,再使用分光光度计将菌液调整至一定浓度,使用油包水矿物油佐剂MontanideTMISA 61 VG制备灭活疫苗。将灭活细菌抗原悬液与ISA 61 VG佐剂按35︰65体积比混合,用1 mL玻璃注射器反复抽打乳化,利用佐剂快速通过针筒将佐剂与细菌进行乳化,细菌乳化后终浓度为6.66×109CFU/mL,即109CFU/只。
1.5 疫苗动物实验
将18只6周龄健康雌性13–15 g BALB/c小鼠随机分为3组,每组6只,饲养于25 ℃环境。在第0天皮下免疫疫苗,疫苗分组以及疫苗剂量见表1。持续对小鼠接种疫苗后的精神、活动、食欲和体重的变化以及小鼠接种部位有无异常病变观察2周。

表1 小鼠分组及免疫和攻毒剂量
Mice were divided into three groups; each group was immunized by the number of bacteria used in the vaccine and the number of immune doses used in the challenge. A: ISA 61 VG + PBS; B: ISA 61 VG + Inactivated LM4; C: Inactivate LM4.
1.6 间接ELISA检测法测定抗LLO抗体以及抗体分型
分别在免疫后7 d、21 d、28 d采集小鼠血样,并制备血清,采用间接ELISA检测稀释后血清中的抗体。酶标板中使用李斯特氏菌溶血素(LLO) 蛋白质(由扬州大学江苏省人畜共患病重点实验室制备和保存),使用碳酸盐缓冲液(CBS) 稀释至0.64 μg/孔封闭;一抗血清从1︰400倍比稀释至1︰102 400,使用加入0.05%吐温的PBS配制TPBS溶解牛血清白蛋白 (BSA) 的溶液稀释血清,BSA的终浓度为1%,每孔100 μL,同时分别使用1︰10 000倍稀释的IgG1与IgG2a酶标二抗测定小鼠血清中IgG1与IgG2a抗体亚型的滴度,计算二者比值;显色液TMB 37 ℃孵育显色10 min后,用450酶标仪检测吸光值,同时设定阴性血清对照孔,读数值/阴性值≥2.1判定为阳性孔。
1.7 攻毒试验
各实验组小鼠第0 天皮下免疫,第14 天加强免疫。在第35天即第二次免疫后的第3周,通过腹腔注射10×LD50野生株LM4攻毒小鼠,攻毒细菌剂量为2.5×106CFU/只。隔离饲养观察小鼠14 d,记录临床症状及死亡情况。
1.8 数据分析
试验结果数据使用GraphPad Prism5软件对免疫组小鼠血清中抗体滴度的差异进行统计学分析,<0.05即认为用于比较的两组存在显著性差异,<0.01判断为非常显著差异,<0.001判断为极显著差异。IgG、IgG1、IgG2a的滴度表示为Log10 (平均值)±标准差(SEM)。
2 结果与分析
2.1 疫苗制备
24 h后观察无菌检验BHI琼脂固体培养基,培养基表面未见微生物生长。ISA 61 VG佐剂与灭活细菌乳化制成的疫苗形成油包水乳化微滴包裹抗原,在水表面并未稀散,与理论上油包水佐剂效果相符。取内口直径为1.2 mm的滴管,室温下吸满1 mL疫苗乳剂,垂直放出0.4 mL所需时间为6 s。疫苗于37 ℃贮存21 d未破乳,表明该疫苗物理性状良好。
2.2 实验动物观察
在整个试验过程中,各组小鼠均处于正常体温范围内(37.5–39.5 ℃),皮毛颜色正常,精神状态良好,能够在健康的状态下生存。与对照组相比,免疫组注射部位仅轻微发红,无脓液及结痂痕,说明疫苗较为安全。增重实验结果(图1A、1B) 免疫后4周,免疫组与空白健康对照组体重无显著差异。在攻毒后2周,ISA 61 VG混合灭活LM4组的体重显著高于灭活LM4组,而空白对照组的体重显著低于灭活LM4组。
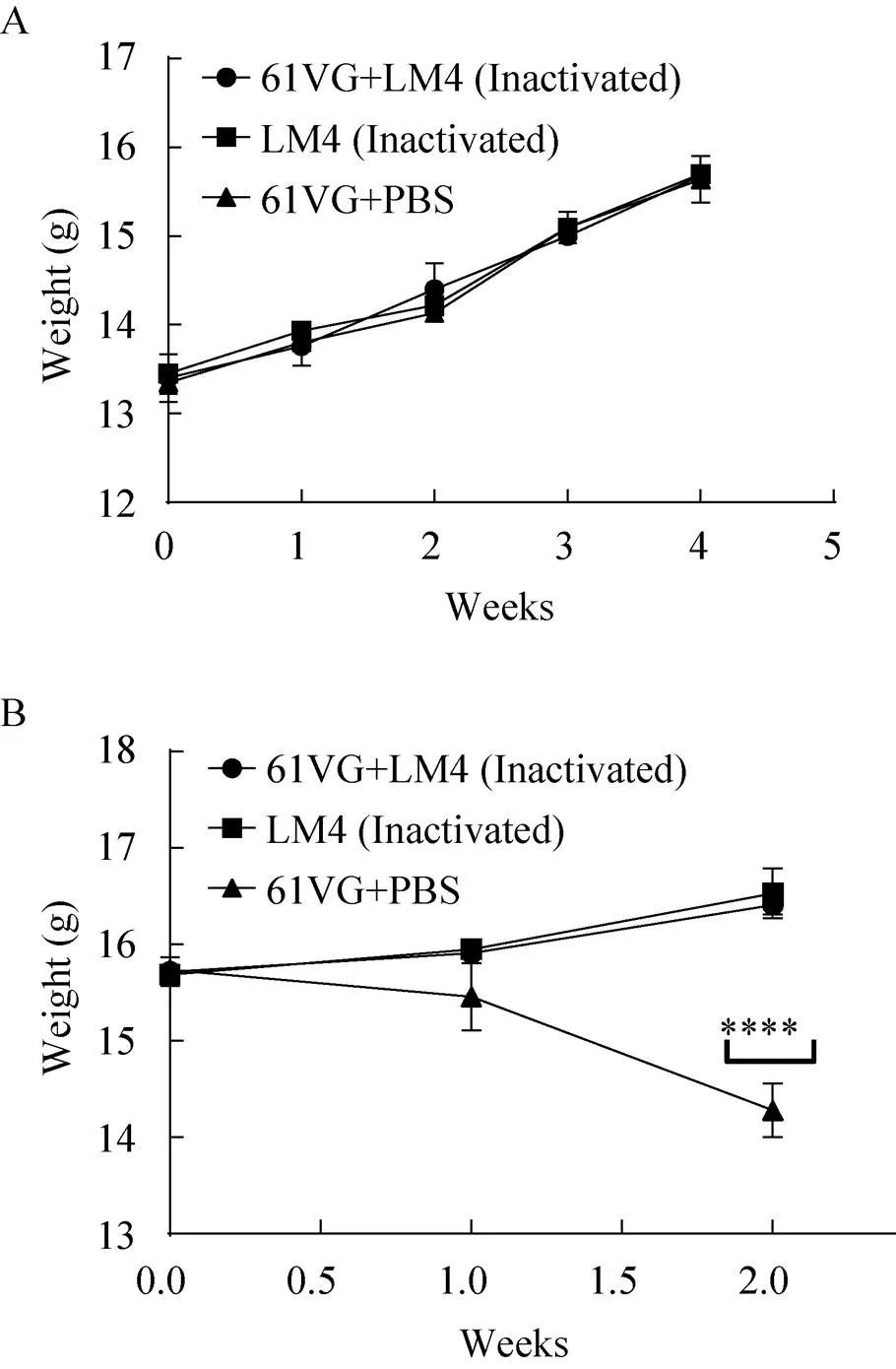
图1 疫苗免疫(A) 和LM4攻毒(B) 后的小鼠体重变化
2.3 血清中抗LLO IgG与亚型抗体
小鼠接种疫苗后血清中LLO IgG抗体水平的变化情况如图2A所示。第一次免疫一周后,所有小鼠血清中均检测到李斯特氏菌溶血素(LLO)特异性抗体。在接下来的试验阶段,各实验组血清抗体滴度均有明显的上升趋势,每组的抗体滴度在21 d达到最高水平,并维持一定的时间,各组抗体滴度随着时间的延长而逐渐降低,符合抗体消长规律,各疫苗组小鼠抗体的动态趋势基本相同。在免疫后的7 d、14 d和21 d,ISA 61 VG混合灭活LM4组诱导的抗体水平均显著高于灭活LM4组。
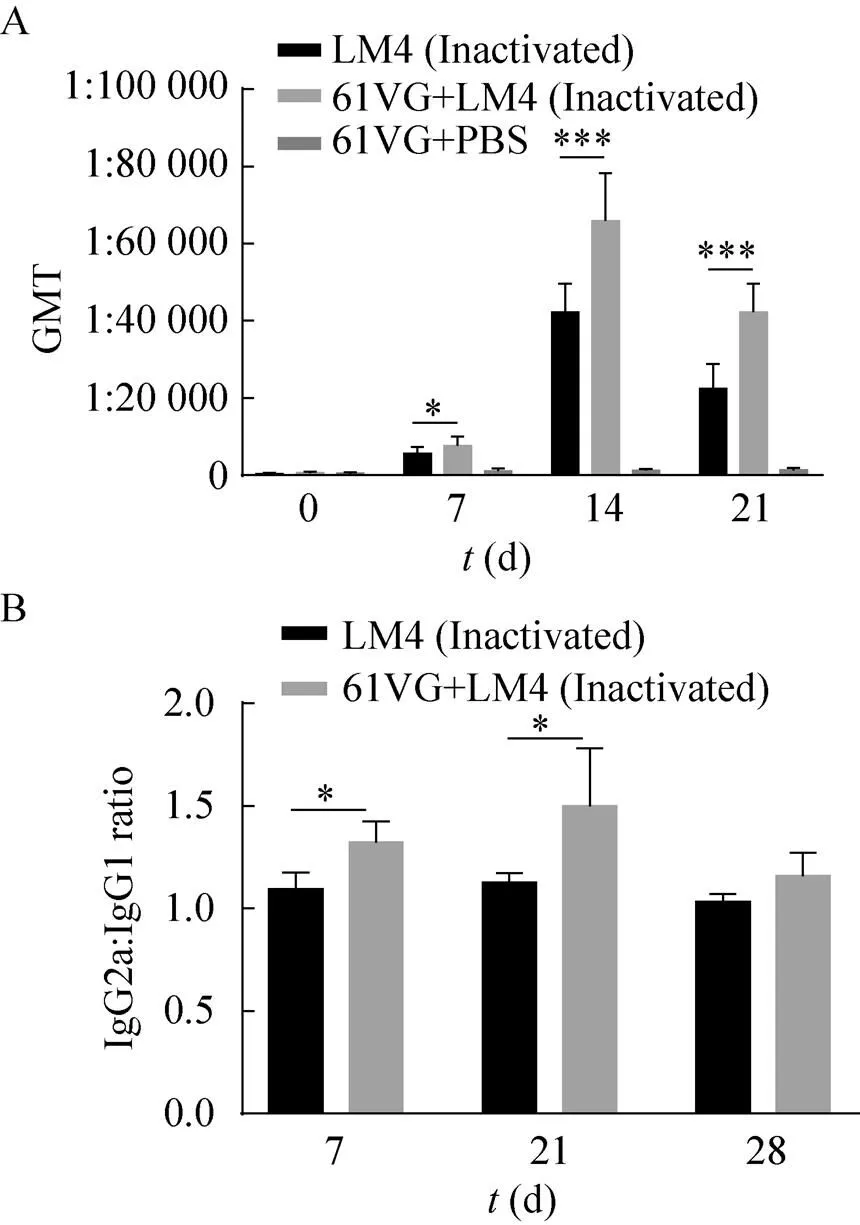
图2 小鼠血清抗体检测。(A) 小鼠血清中LLO抗体的动态测定和(B) 免疫组血清抗体亚型测定
为了探究新型灭活疫苗对小鼠血清中Th1和Th2细胞因子介导的免疫应答的促进或抑制作用,我们测定了免疫期间各组小鼠血清IgG1/IgG2a的比值(图2B)。新型佐剂灭活疫苗可诱导不同IgG亚型(IgG1、IgG2a) 抗体的产生,在第7、21、28天明显高于无佐剂灭活疫苗免疫组。结果表明,新型灭活疫苗抗原可持续刺激宿主产生偏向性Th1细胞毒免疫反应,有效消除细胞内病原菌感染。
2.4 免疫保护实验
野生株LM4腹腔注射2.5×106CFU/150 μL每只小鼠。图3实验结果表明,PBS混合甲醛以及ISA 61 VG组小鼠免疫保护率为0%,ISA 61 VG混合灭活LM4组小鼠免疫保护率为100%,灭活LM4组小鼠免疫保护率仅为17%。免疫保护试验结果表明,佐剂为ISA 61 VG的灭活疫苗免疫保护效果较好,具有潜在的应用前景。
3 讨论
单核细胞增生李斯特氏菌() 是人兽共患李斯特氏菌病的病原菌,近几年在全世界多个国家暴发李斯特氏菌病[2-3,29]。我国每年都有多例李斯特氏菌病的发生,因此迫切需要开发一种可以有效预防和治疗李斯特氏菌病的疫苗。研究表明,虽然福尔马林灭活疫苗可以诱导产生一定的免疫应答,预防细菌感染[30-31],但单独的灭活疫苗不能刺激免疫系统产生较强的免疫应答,往往需要添加佐剂以增强疫苗的免疫原性[32]。MontanideTMISA佐剂可诱导小鼠产生持久的体液免疫和细胞免疫[33]。我们研发的疫苗使用的ISA 61 VG佐剂是一种弗氏不完全佐剂(IFA)[34],该佐剂疫苗进入临床Ⅱ期试验[35]。本研究使用经过福尔马林灭活的LM4作为疫苗免疫原,加入油包水佐剂ISA 61 VG混合乳化后制成灭活疫苗,并在动物实验中检测该灭活疫苗的安全性以及免疫保护作用。实验中未观察到小鼠接种疫苗后的不良反应。单核细胞增生李斯特氏菌是胞内寄生菌,单纯的无佐剂灭活细菌无法对清除胞内寄生菌起到显著作用,攻毒使用的LM4毒性较强,且达到10 LD50的致死剂量,免疫组佐剂疫苗组对致死剂量野生株的攻毒保护率高达100%,而无佐剂灭活疫苗的攻毒保护率只有17%,初步证实该灭活疫苗具有良好的安全性与免疫保护效果。

图3 不同实验组小鼠攻毒后生存曲线(%)
宿主免疫系统产生特异性IgG抗体能够有效抵御感染,抗李斯特氏菌溶血素(LLO) 抗体可中和毒素并保护宿主免受感染[36],同时针对其他蛋白产生的抗体对宿主同样具有保护作用[37]。有实验表明灭活的全菌疫苗可以诱导体液免疫应答[38],加入ISA 61 VG佐剂能显著提高抗体效价从而增强体液免疫效应[27]。在本研究中,ISA 61 VG混合疫苗组在免疫21 d后达到峰值,LLO免疫原抗体水平明显高于无佐剂组,证明佐剂疫苗能够刺激产生较强的体液免疫。实验结果显示,混合ISA 61 VG佐剂乳化疫苗诱导的抗体水平显著升高,对降低感染者的细菌载量发挥重要作用。
能够侵袭巨噬细胞及多种非吞噬细胞,逃避宿主的体液免疫应答[39],因此清除需要T淋巴细胞介导的细胞免疫应答参与。辅助T淋巴细胞是一种细胞免疫中重要的淋巴细胞,主要有Th1与Th2两种类型[40]。Th1细胞激活巨噬细胞,促进B细胞分泌针对细胞内感染细菌的IgG2a抗体,而Th2细胞通过刺激产生针对细胞外感染的IgG1,辅助体液免疫反应。通常IgG2a/IgG1的比值可以反映免疫应答的类型[41],动物血清中相同抗原特异性抗体IgG2a/IgG1的比值大于1,则相应的疫苗抗原诱导Th1型免疫应答[42]。本研究中ISA 61 VG佐剂疫苗免疫组IgG2a/IgG1显著高于无佐剂免疫组,且诱导产生了Th1型倾向性的免疫应答。因此,ISA 61 VG佐剂灭活李斯特氏菌疫苗在诱导体液免疫应答的同时诱导产生较强的细胞免疫应答,作为消除细胞内病原菌的单核细胞增生李斯特氏菌的先决条件,为李斯特氏菌病的预防和控制提供了实验基础。
综上所述,我们采用混合乳化灭活与ISA 61 VG佐剂的方法制备灭活疫苗,评价了疫苗的安全性和保护性免疫应答特性。研究结果表明,ISA 61 VG对灭活疫苗刺激宿主产生细胞和体液免疫应答具有显著的增强作用,提示该灭活疫苗是一种安全有效的预防感染的疫苗,为预防动物和人的李斯特氏菌病奠定了基础。
[1] Winter P, Schilcher F, Bagò Z, et al. Clinical and histopathological aspects of naturally occurring mastitis caused byin cattle and ewes. J Vet Med B, 2004, 51(4): 176–179.
[2] Smith AM, Tau NP, Smouse SL, et al. Outbreak ofin South Africa, 2017–2018: Laboratory activities and experiences associated with whole-genome sequencing analysis of isolates. Foodborne Pathog Dis, 2019, 16(7): 524–530.
[3] Fan ZL, Xie J, Li Y, et al. Listeriosis in mainland China: A systematic review. Int J Infect Dis, 2019, 81: 17–24.
[4] Lamont RF, Sobel J, Mazaki-Tovi S, et al. Listeriosis in human pregnancy: a systematic review. J Perinat Med, 2011, 39(3): 227–236.
[5] Jia YY, Yin YL, Tan WJ, et al. Construction and characterization of an attenuated recombinantvector vaccine delivering HPV16 E7. Chin J Biotech, 2016, 32(5): 683–692 (in Chinese)贾艳艳, 殷月兰, 谈卫军, 等. 减毒李斯特菌载体运送 HPV16 E7 基因重组疫苗的构建及其生物学特性. 生物工程学报, 2016, 32(5): 683–692.
[6] Pizarro-Cerdá J, Kühbacher A, Cossart P. Entry ofin mammalian epithelial cells: an updated view. Cold Spring Harb Perspect Med, 2012, 2(11): 705–709.
[7] Lauer P, Hanson B, Lemmens EE, et al. Constitutive activation of the PrfA regulon enhances the potency of vaccines based on live-attenuated and killed but metabolically activestrains. Infect Immun, 2008, 76(8): 3742–3753.
[8] Brockstedt DG, Bahjat KS, Giedlin MA, et al. Killed but metabolically active microbes: a new vaccine paradigm for eliciting effector T-cell responses and protective immunity. Nat Med, 2005, 11(8): 853–860.
[9] Ansari MA, Zubair S, Tufail S, et al. Ether lipid vesicle-based antigens impart protection against experimental listeriosis. Int J Nanomedicine, 2012, 7: 2433–2447.
[10] Calderon-Gonzalez R, Marradi M, Garcia I, et al. Novel nanoparticle vaccines for listeriosis. Hum Vaccin Immunother, 2015, 11(10): 2501–2503.
[11] Ansari MA, Zia Q, Kazmi S, et al. Efficacy of cell wall-deficientagainst experimental murine listeriosis. Scand J Immunol, 2015, 82(1): 10–24.
[12] Darji A, Mohamed W, Domann E, et al. Induction of immune responses by attenuated isogenic mutant strains of. Vaccine, 2003, 21(S2): S102–S109.
[13] Sacco JJ, Evans M, Harrington KJ, et al. Systemic listeriosis following vaccination with the attenuatedtherapeutic vaccine, ADXS11-001. Hum Vaccin Immunother, 2015, 12(4): 1085–1086.
[14] Fares E, McCloskey CB, Gutierrez A, et al. Vaccine strainbacteremia occurring 31 months after immunization. Infection, 2018, 47(3): 489–492.
[15] Dubensky TW, Skoble J, Lauer P, et al. Killed but metabolically active vaccines. Curr Opin Biotechnol, 2012, 23(6): 917–923.
[16] Flickinger JC Jr, Rodeck U, Snook AE.as a vector for cancer immunotherapy: Current understanding and progress. Vaccines (Basel), 2018, 6(3): 48.
[17] Skwarczynski M, Toth I. Recent advances in peptide-based subunit nanovaccines. Nanomedicine (Lond), 2014, 9(17): 2657–2669.
[18] Delany I, Rappuoli R, de Gregorio E. Vaccines for the 21st century. EMBO Mol Med, 2014, 6(6): 708–720.
[19] Heegaard PM, Fang YX, Jungersen G. Novel adjuvants and immunomodulators for veterinary vaccines. Methods Mol Biol, 2016, 1349: 63–82.
[20] Dong H, Jiao XA, Pan ZM, et al. Immunogenicity comparision ofinactivated by gamma-irradiation or traditional treatments. Acta Microbiol Sin, 2009, 49(2): 269–273 (in Chinese). 董慧, 焦新安, 潘志明, 等. γ-辐射与常规方法灭活产单核细胞李斯特菌对小鼠免疫原性的比较. 微生物学报, 2009, 49(2): 269–273.
[21] Burakova Y, Madera R, McVey S, et al. Adjuvants for animal vaccines. Viral Immunol, 2017, 31(1): 11–22.
[22] Hem SL, Hogenesch H. Relationship between physical and chemical properties of aluminum-containing adjuvants and immunopotentiation. Expert Rev Vaccines, 2007, 6(5): 685–698.
[23] Goloś A, Lutyńska A. Aluminium-adjuvanted vaccines--A review of the current state of knowledge. Prz Epidemiol, 2015, 69(4): 731–734, 871–874.
[24] Carroll EC, Jin L, Mori A, et al. The vaccine adjuvant chitosan promotes cellular immunity via DNA sensor cGAS-STING-dependent induction of type I interferons. Immunity, 2016, 44(3): 597–608.
[25] Doel TR. Natural and vaccine-induced immunity to foot and mouth disease: the prospects for improved vaccines. Rev Sci Tech, 1996, 15(3): 883–911.
[26] Zhang JQ, Miao JF, Han XG, et al. Development of a novel oil-in-water emulsion and evaluation of its potential adjuvant function in a swine influenza vaccine in mice. BMC Vet Res, 2018, 14: 415.
[27] Khorasani A, Madadgar O, Soleimanjahi H, et al. Evaluation of the efficacy of a new oil-based adjuvant ISA 61 VG FMD vaccine as a potential vaccine for cattle. Iran J Vet Res, 2016, 17(1): 8–12.
[28] Aguilar FF, Barranco JJ, Fuentes EB, et al. Very small size proteoliposomes (VSSP) and Montanide combination enhance the humoral immuno response in a GnRH based vaccine directed to prostate cancer. Vaccine, 2012, 30(46): 6595–6599.
[29] Self JL, Conrad A, Stroika S, et al. Multistate outbreak of listeriosis associated with packaged leafy green salads, United States and Canada, 2015–2016. Emerg Infect Dis, 2019, 25(8): 1461–1468.
[30] Mckenzie R, Walker RI, Nabors GS, et al. Safety and immunogenicity of an oral, inactivated, whole-cell vaccine for: preclinical studies and a Phase I trial. Vaccine, 2006, 24(18): 3735–3745.
[31] McConnell MJ, Pachón J. Active and passive immunization againstusing an inactivated whole cell vaccine. Vaccine, 2010, 29(1): 1–5.
[32] Petrovsky N, Aguilar JC. Vaccine adjuvants: current state and future trends. Immunol Cell Biol, 2004, 82(5): 488–496.
[33] Subharat S, Shu DR, Zheng T, et al. Vaccination of sheep with a methanogen protein provides insight into levels of antibody in saliva needed to target ruminal methanogens. PLoS ONE, 2016, 11(7): e0159861.
[34] Qin SX, Sun T. Evaluation of novel adjuvant for swine foot-and-mouth disease type O synthetic peptide vaccine (polypeptide 2600+2700+2800). Abstract Anim Husbandry Vet Med Sin, 2018, 34(2): 65–66 (in Chinese)秦守贤, 孙涛. 猪口蹄疫O型合成肽疫苗(多肽2600+2700+2800)新佐剂评估试验. 中国畜牧兽医文摘, 2018, 34(2): 65–66.
[35] Thakur A, Andrea A, Mikkelsen H, et al. Targeting the Mincle and TLR3 receptor using the dual agonist cationic adjuvant formulation 9 (CAF09) induces humoral and polyfunctional memory T cell responses in calves. PLoS ONE, 2018, 13(7): e0201253.
[36] Edelson BT, Unanue ER. Intracellular antibody neutralizesgrowth. Immunity, 2001, 14(5): 503–512.
[37] Asano K, Sashinami H, Osanai A, et al. Passive immunization with anti-ActA and anti-listeriolysin O antibodies protects againstinfection in mice. Sci Rep, 2016, 6: 39628.
[38] Takahashi K, Hanamura Y, Tokunoh N, et al. Protective effects of oral immunization with formalin-inactivated whole-celloninfection in mice. J Microbiol Methods, 2019, 159: 62–68.
[39] Tilney LG, Portnoy DA. Actin filaments and the growth, movement, and spread of the intracellular bacterial parasite,. J Cell Biol, 1989, 109(4): 1597–1608.
[40] Atkins H, Davies BR, Kirby JA, et al. Polarisation of a T-helper cell immune response by activation of dendritic cells with CpG-containing oligonucleotides: a potential therapeutic regime for bladder cancer immunotherapy. Br J Cancer, 2003, 89(12): 2312–2319.
[41] Agrewala JN, Wilkinson RJ. Differential regulation of Th1 and Th2 cells by p91–110 and p21–40 peptides of the 16-kD alpha-crystallin antigen of. Clin Exp Immunol, 1998, 114(3): 392–397.
[42] Mcguirk P, Mills KHG. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol, 2002, 23(9): 450–455.
ISA61 VG adjuvant enhances protective immune response ofinactivated vaccine
Tengfei Zhu*, Fanzeng Meng*, Hao Yao, Yuting Wang, Xin’an Jiao, and Yuelan Yin
Yangzhou University, College of Bioscience and Biotechnology/Jiangsu Key Laboratory of Zoonosis/Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses/Key Laboratory of Prevention and Control of Biological Hazard Factors (Animal Origin) for Agrifood Safety and Quality, Ministry of Agriculture of China/Joint International Research Laboratory of Agriculture and Agri-product Safety of the Ministry of Education, Yangzhou 225009, Jiangsu, China
() is zoonotic pathogen that can cause listeriosis, and vaccine is one of the effective methods to prevent this pathogen infection. In this study, we developed a novel vaccine that is a mixture of inactivated bacteria and MontanideTMISA 61 VG, a mineral oil adjuvant, and evaluated the safety and immune response characteristics of this vaccine. The mice immunized with the ISA 61 VG adjuvant had high safety, and it could induce significantly higher titer of anti-listeriolysin O (LLO) antibody and higher value of IgG2a/IgG1 ratio compared with the group without the adjuvant. In particular, it could provide 100% immune protection against lethal doses ofchallenge in mice. In summary, ISA 61VG adjuvant significantly enhanced the ability of inactivated listeria vaccine to induce humoral and cellular immune responses, thereby enhanced the protective immune response in the host, and it is a potential vaccine candidate for the prevention ofinfection in humans and animals.
, adjuvant, inactivated vaccine, safety, vaccine potency
10.13345/j.cjb.190487
October 10, 2019;
April 20, 2020
Supported by: National Key R&D Program of China (No. 2017YFC1601201), National Natural Science Foundation of China (No. 31472193), Key Research and Development Program (Modern Agriculture) Project of Jiangsu Province (No. BE2017341).
Yuelan Yin. Tel: +86-514-87971136; Fax: +86-514-87971547; E-mail: yylan@yzu.edu.cn
*These authors contributed equally to this study.
国家重点研发计划项目 (No. 2017YFC1601201),国家自然科学基金 (No. 31472193),江苏省重点研发计划 (现代农业) 项目 (No. BE2017341)资助。
朱腾飞, 孟凡增, 姚浩, 等. ISA 61 VG佐剂增强单核细胞增生李斯特氏菌灭活疫苗的保护性免疫应答. 生物工程学报, 2020, 36(7): 1378–1385.
Zhu TF, Meng FZ, Yao H, et al. ISA61 VG adjuvant enhances protective immune response ofinactivated vaccine. Chin J Biotech, 2020, 36(7): 1378–1385.
(本文责编 陈宏宇)
