甲状腺乳头状癌石蜡标本BRAF V600E基因突变检测方法的比较研究*
2020-07-28易清清梁冬雨史俊峰
易清清,梁冬雨,史俊峰,沙 爽,杨 荣,常 庆△
(1.上海健康医学院附属嘉定区中心医院中心实验室,上海 201800; 2.上海健康医学院分子影像中心,上海 201318;3.上海健康医学院附属嘉定区中心医院病理科,上海 201800)
甲状腺癌是人类常见的内分泌系统恶性肿瘤,近年来世界范围内其发病率上升趋势明显[1]。在我国,甲状腺癌的发病率同样处于上升趋势,部分地区近十年增长了近10倍,是目前发病率上升最快的实体恶性肿瘤之一[2]。甲状腺癌的病理分型包括甲状腺乳头状癌(PTC)、甲状腺滤泡状腺癌(FTC)、甲状腺未分化癌(ATC)及甲状腺髓样癌(MTC)。PTC和FTC属于分化的甲状腺癌,占全部甲状腺癌的90%。BARF基因位于7q34,其最常见的突变位点为第15号外显子的密码子600,在胸腺嘧啶转化为腺苷酸过程中,该突变基因在氨基酸水平上由缬氨酸取代谷氨酸,该位点突变被定义为BRAF V600E[3-5]。BRAF存在30个以上不同的基因突变,但V600E约占90%。研究发现,BRAF V600E基因突变是PTC最常见的基因突变,突变阳性率为29%~83%,平均为45%,与经典型 PTC(乳头结构和核型改变,核分裂象罕见,沙砾样钙化常见)的预后差直接相关[6-7]。因此,该突变可作为诊断和判断预后的分子生物学标志及治疗PTC的靶基因。BRAF V600E基因突变与甲状腺癌的关系已成为目前研究的热点[8-9]。
目前BRAF V600E基因突变检测的方法有很多,且各有优缺点。本文采用聚合酶链反应(PCR)-荧光探针法、微滴式数字聚合酶链反应(ddPCR)法、MassARRAY核酸质谱法和Sanger测序法,分析2013年收集的35例PTC患者石蜡标本(已知新鲜组织2013年用PCR-荧光探针法检测BRAF V600E基因突变全阳性)BRAF V600E基因突变检测结果,为医院针对既往保存的石蜡标本中BRAF V600E基因突变选择合适的检测方法提供参考和依据。
1 资料与方法
1.1标本来源 35例PTC石蜡包埋组织标本取自上海健康医学院附属嘉定区中心医院病理科,患者于2013年在该院确诊并手术取出PTC组织后包埋成蜡块存档。35例PTC患者的新鲜组织于2013年进行PCR-荧光探针法检测BRAF V600E基因突变,突变阳性率为100%(35/35)。35例标本依次编号为1~35,所有标本均经10%甲醛溶液固定,常规石蜡包埋,组织切片后经病理医师复阅切片明确诊断,并评估肿瘤细胞含量。
1.2方法
1.2.1DNA提取 常规消毒所用物品,20 μm连续切片4~6张,参照35例PTC石蜡包埋组织标本的HE染色切片,分别选择肿瘤细胞丰富的区域进行刮取,尽量避开非肿瘤区、坏死区。使用QIAGEN DNA FFPE Tissue Kit,按照说明书步骤提取基因组DNA,经Thermo Fisher®NanoDrop2000超微量分光光度计测定DNA纯度及水平,其中A260/A280要求在1.8~2.1。
1.2.2PCR-荧光探针法 使用武汉友芝友公司生产的人类BRAF V600E基因突变检测试剂盒,于Roche®LightCycler480实时荧光定量PCR仪上检测BRAF V600E的突变情况,具体操作步骤按试剂盒说明书进行。最后根据扩增曲线划定合适的荧光阈值,得到组织标本的Ct值并计算相关ΔCt值。突变检测Ct值≥38或无Ct值,则该标本为突变阴性;突变检测Ct值<38,ΔCt值<9,则该标本为突变阳性;突变检测Ct值<38,ΔCt值≥9,则该标本为突变阴性。
1.2.3ddPCR法 使用PrimePCRTMddPCRTMBRAF V600E突变检测试剂盒于QX®200 Bio-Rad微滴式数字PCR仪上检测PTC石蜡标本BRAF V600E基因突变情况,具体操作步骤按试剂盒说明书进行。最后由Quanta Soft完成对数据的自动处理,获得靶序列在PCR反应体系中的拷贝数水平(单位:copy/μL),通过野生型拷贝数和突变型拷贝数计算突变比例。突变比例>0为突变阳性。
1.2.4MassARRAY核酸质谱法 整个检测过程分为两个阶段进行。首先设计PCR扩增引物,V600E-F:5′-ACG TTG GAT GTT CAA ACT GAT GGG ACC CAC-3′;V600E-R:5′-ACG TTG GAT GTC TTC ATG AAG ACC TCA CAG-3′,富集含BRAF基因15号外显子的PCR片段。然后针对突变位点设计特异的探针引物,Unextension primer(UEP):5′-GAT TTT GGT CTA GCT ACA G-3′,于Agena®MALDI-TOF MassARRAY质谱仪上通过单碱基延伸试验获得突变/野生型位点基因片段混合产物,最后通过质谱分离这些差异片段,实现BRAF V600E基因突变检测。质谱图中有突变峰为突变阳性。
1.2.5Sanger测序法 使用下列引物扩增BRAF基因第15号外显子。V600P5:5′-AGC ATC TCA CCT CAT CCT AAC ACA-3′;V600P3:5′-CTA GTA ACT CAG CAG CAT CTC AGG-3′。PCR反应体系为30.0 μL:模板DNA 2.0 μL,引物P5/P3(10 μmol/L)各0.5 μL,双蒸水27.0 μL。PCR反应条件:95 ℃预变性3 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环,最后72 ℃延伸10 min。利用核酸外切酶和热敏磷酸酶纯化PCR产物,将纯化的PCR产物进行测序反应,测序产物经纯化后在ABI 3500XL基因分析仪上进行基因测序。
1.3统计学处理 使用GraphPad Prism v5.0软件和SPSS20.0软件进行统计处理和分析,计数资料以率或例数表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1石蜡标本提取DNA的纯度与水平检测结果 35例PTC石蜡标本提取基因组DNA,其纯度和水平检测结果见图1。其中标本7、8的A260/A280分别为2.45和2.14,纯度不符合要求。其余标本的A260/A280为1.8~2.1,水平均大于10 ng/μL,符合后续试验要求。

注:A为提取的基因组DNA纯度,n=35;B为提取的基因组DNA水平,n=35。图1 石蜡标本提取的基因组DNA的纯度与水平
2.2PCR-荧光探针法检测结果 35例PTC石蜡标本中,PCR-荧光探针法检测BRAF V600E基因突变阳性率为80.0%(28/35)。其中标本7、20、23、24、30无扩增曲线,没有Ct值,检测突变结果为阴性;标本6、8的Ct值<38,ΔCt值≥9,检测突变结果为阴性;其余标本的Ct值<38,ΔCt值<9,检测突变结果为阳性。见图2。

注:结果为根据扩增曲线和荧光阈值计算得到的各标本ΔCt值。图2 PCR-荧光探针法检测BRAF V600E基因突变结果
2.3ddPCR法检测结果 35例PTC石蜡标本中,ddPCR法检测BRAF V600E基因突变阳性率为94.3%(33/35)。其中标本7、8的突变比例为0,检测突变结果为阴性;其余标本的突变比例为0.014%~38.00%,突变结果检测均为阳性。ddPCR法检测BRAF V600E基因突变比例见图3。
2.4MassARRAY核酸质谱法检测结果 35例PTC石蜡标本中,MassARRAY核酸质谱法检测BRAF V600E基因突变阳性率为74.3%(26/35)。检测结果中,标本6、7、8、9、11、18、26、30、35的质谱图中无突变峰,为突变检测阴性;其余标本的质谱图中有突变峰,为突变检测阳性。见图4。
2.5Sanger测序法检测结果 35例PTC石蜡标本中,Sanger测序法检测BRAF V600E基因突变阳性率为60.0%(21/35)。其中标本1、2、7、8、9、11、14、23、24、26、30、31、34、35的测序结果呈阴性,其余标本的测序结果呈阳性。见图5。

注:根据BRAF V600E基因突变图谱计算得到的各标本的突变比例。图3 ddPCR法检测BRAF V600E基因突变结果

注:A提示质谱图中Mass 6 100处有突变峰(用箭头标出),显示BRAF V600E密码子突变阳性;B提示质谱图中Mass 6 100处无突变峰,显示BRAF V600E密码子突变阴性。图4 MassARRAY核酸质谱法检测BRAF V600E基因突变
2.6BRAF V600E基因突变检测方法的比较 通过试验发现,在4种检测方法中,ddPCR法检测既往收集的PTC石蜡标本BRAF V600E基因突变的灵敏度最佳。将其与另外3种检测方法比较,差异均有统计学意义(P分别为0.047、0.031、0.015)。
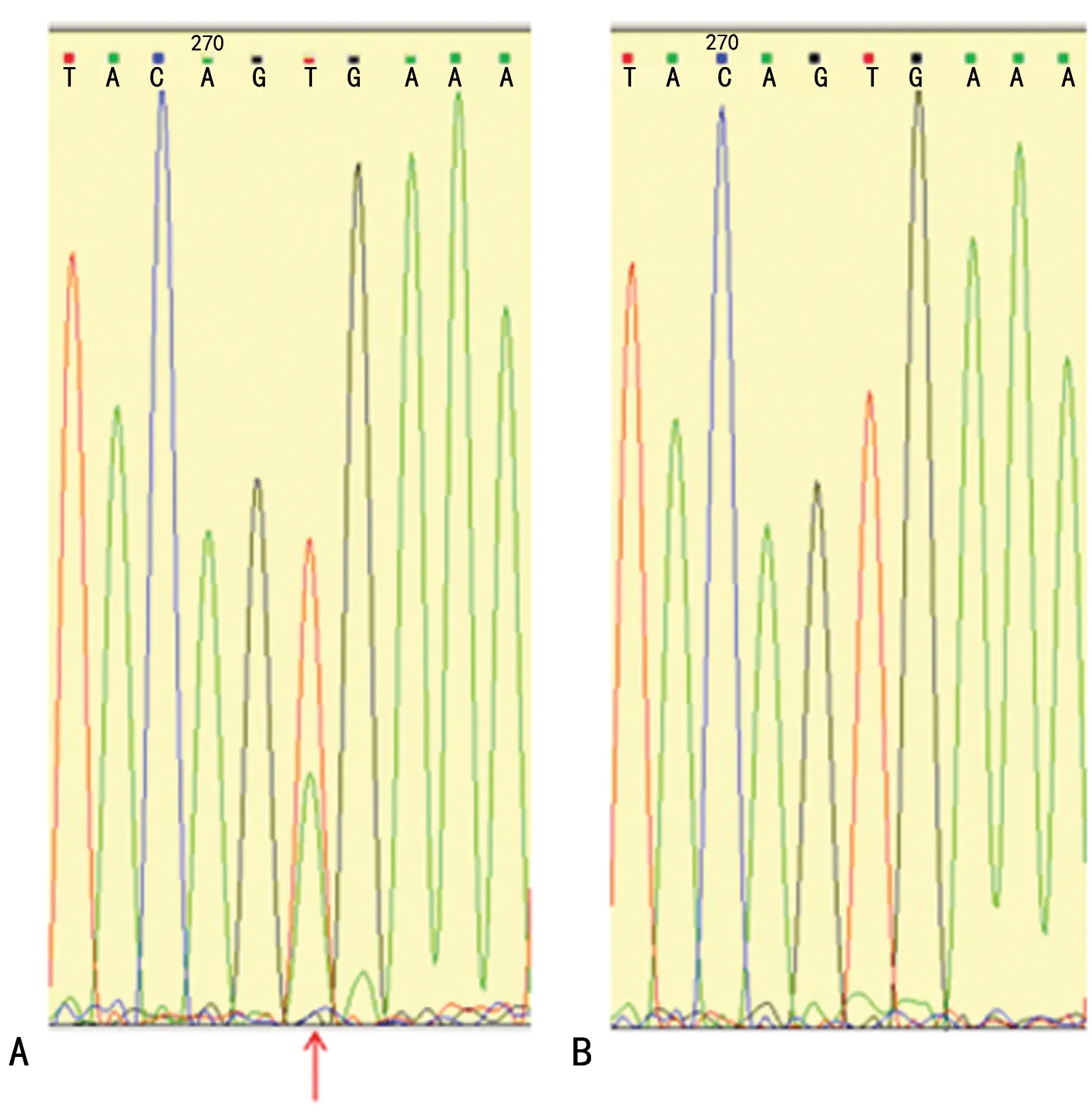
注:A提示测序图谱中密码子600的T处有突变峰(用箭头标出),显示BRAF V600E密码子突变阳性;B提示测序图谱中密码子600的T处无突变峰,显示BRAF V600E密码子突变阴性。图5 Sanger测序法检测BRAF基因第15号外显子突变
3 讨 论
各医院病理科保存有大量患者肿瘤组织的石蜡标本。石蜡标本经过固定剂、脱水剂、包埋剂等有机溶剂作用后,其基因组DNA受到一定程度的破坏,发生降解,使得DNA的纯度与水平均降低[10]。因此,与新鲜组织相比,检测PTC石蜡标本中的BRAF V600E基因突变的难度增大,本研究即证实了这一观点(与新鲜组织相比,各检测方法的突变阳性率均未达100%)。故需要寻找灵敏度更高的方法用于PTC石蜡标本中BRAF V600E基因突变的检测。
以往研究中对BRAF基因突变的检测方法主要有免疫组织化学法、限制性片段长度-多态性聚合酶链反应技术(PCR-RFLP)、高分辨率熔解曲线法、测序技术以及实时荧光定量PCR技术(qPCR)等[11]。由于检测方法不同,PTC组织中BRAF V600E基因突变阳性率存在较大差异。国内甲状腺癌BRAF V600E基因突变检测方法较多,检测的标本类型众多,检测的灵敏度、特异度差异较大,因而检测结果相距甚远。因此,通过试验选出灵敏度高的检测方法,可以为医院后期临床检测项目的选择提供理论依据,为患者用药提供指导。
Sanger测序法作为“金标准”,可得到序列的直接信息,对未知突变的检出具有优势,是直接、有效的检测基因突变的方法,但该法检测基因突变的灵敏度较低,试验操作时间长、步骤复杂、易产生污染[12]。MassARRAY核酸质谱法具有较高的特异度和灵敏度,可以在一个平台上实现SNP基因分型、基因表达检测、基因甲基化分析、病原体分型和进行产前诊断的研究。但对于检测一个位点的突变,其需要设计两次引物进行扩增,步骤较为烦琐[13]。以PCR-荧光探针法为平台的突变检测技术,均需根据已知的突变类型设计引物、探针,因此无法检测出所有可能的突变,但灵敏度较Sanger测序法高,操作简单,无须对PCR产物进行操作,在很大程度上避免了扩增产物的污染[14]。ddPCR法作为核酸定量的新技术,与此前的核酸定量方法相比,该方法的灵敏度、准确度更高。其与qPCR最主要的区别在于计算核酸拷贝数方法不同,ddPCR法采用了新的定量策略和试验思路,可以对核酸的拷贝数进行绝对定量,相对于qPCR,不需要建立标准曲线,具有更广阔的应用前景[15]。
本试验采用Sanger测序法检测BRAF基因第15号外显子突变,检测到的突变类型均为V600E突变型,未见其他少见的突变类型。本试验中采用灵敏度最高的ddPCR法检测35例2013年收集的PTC石蜡标本BRAF V600E基因突变(已知新鲜组织2013年用PCR-荧光探针法检测BRAF V600E基因突变全阳性),突变阳性率为94.3%(33/35)。其中标本7、8用4种方法检测均呈阴性,可能与其纯度不高有关。ddPCR法无须检测者分析结果,其结果直接由检测系统显示,从而大大降低了人为因素对结果的影响。
4 结 论
综上所述,ddPCR法检测灵敏度较高,对标本中DNA的纯度和水平要求较低,适用于储存年份较久的PTC石蜡标本BRAF V600E基因突变检测,可为PTC的诊断及预后判断提供依据。
