抗骨增生胶囊调控去卵巢骨质疏松症大鼠骨代谢及氧化应激指标研究※
2020-07-28曹舒兴宋永周
曹舒兴 宋永周 李 明 马 维 周 楠
(河北医科大学第二医院骨科,河北 石家庄 050000)
女性绝经后由于卵巢功能衰退,雌激素分泌减少,从而使骨吸收大于骨形成,最终导致绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)[1-2]。随着对PMOP发病机制研究的不断深入,氧化应激被认为是PMOP发生的最重要的始动因素之一[3-4]。中医学认为,肾主骨生髓,肾精充足则骨髓充养,肾精亏则骨髓失养,骨骼无力,易致骨质疏松症。中医学对骨质疏松症特别是PMOP的治疗多以补肾为原则,获得较好疗效[5-6]。本研究通过摘除双侧卵巢建立PMOP模型,观察抗骨增生胶囊对骨组织代谢、氧化应激等相关指标的影响,探讨其防治PMOP的可能机制,为PMOP提供新的防治思路。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 SPF级SD雌性大鼠40只,6月龄,体质量(320±20)g,由河北医科大学实验动物中心提供[动物许可证号:SCXK(冀)2013-1-003],实验大鼠自由摄食、饮水,房间保持恒定温度(25 ℃)和湿度(40%)。
1.1.2 药品 抗骨增生胶囊(江苏康缘药业股份有限公司,国药准字Z10980006);雌二醇(美国Sigma公司);注射用青霉素(华北制药股份有限公司,国药准字H13020657)。
1.1.3 试剂 苏木精-伊红(HE)染色试剂盒(上海歌凡生物科技有限公司)、骨保护素(OPG)试剂盒、血清Ⅰ型前胶原N端前肽(PⅠNP)试剂盒、核转录因子κB受体活化因子配体(RANKL)试剂盒、骨钙素(BGP)试剂盒(赛默飞世尔科技有限公司);过氧化氢酶(CAT)试剂盒、丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所);兔抗鼠多克隆抗体血红素加氧酶-1(HO-1)、辣根过氧化物酶(HRP)标记的山羊抗兔二抗(美国Bioworld公司);HO-1免疫组化试剂盒[生工生物工程(上海)股份有限公司]。
1.1.4 仪器 DEXA双能X线骨密度测定仪(美国GE公司)、Bond-Max全自动免疫组化染色机(德国Leica公司)、DM750显微镜(德国Leica公司)、SIGMA300扫描电镜(德国蔡司公司)、TDL-50B低速台式离心机(上海安亭科学仪器厂)、DNM-9602全自动酶标仪(北京普朗新技术有限公司)、EXAKT 300CP微距切片机(德国Exakt公司)、Image-Pro Plus(MEDIA CYBERNETICS图像技术公司)。
1.2 分组、造模及给药
1.2.1 分级及造模 将40只大鼠按照随机数字表法分为空白对照组、模型组、雌激素组、抗骨增生胶囊组,每组10只。各组大鼠分别以10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,除空白对照组外均施行双侧卵巢摘除法[8];空白对照组不切除卵巢,仅切除卵巢周围等量的脂肪组织。术后各组常规肌肉注射青霉素5万U/d,持续抗感染治疗3 d。
1.2.2 给药 术后7 d对大鼠进行灌胃。给药剂量按人与大鼠体表面积比值计算[7-8],抗骨增生胶囊组将抗骨增生胶囊药粉0.48 g/kg溶于0.9%氯化钠注射液1 mL制成悬浊液灌胃;雌激素组予雌二醇10 μg/kg溶于0.9%氯化钠注射液1 mL灌胃;空白对照组、模型组均予等容积0.9%氯化钠注射液灌胃。各组大鼠每周称体质量调整用药剂量。灌胃均每日1次,持续12周。
1.3 观察指标
1.3.1 骨密度(BMD) 灌胃结束后当日,各组大鼠予10%水合氯醛0.3 mL/100 g腹腔注射麻醉,仰卧位,采用DEXA双能X线骨密度仪,测量腰椎及双侧股骨BMD,测量3次取平均值。
1.3.2 血清学检测 灌胃结束后第2 d,各组禁食水8 h,腹主动脉取血8 mL,3 000 r/min离心10 min分离血清,-20 ℃保存。采用酶联免疫吸附法检测血清骨代谢指标,包括BGP、PⅠNP、OPG、RANKL,比色法检测氧化应激指标,包括MDA、CAT、SOD。
1.3.3 骨组织形态学观察 采血后以颈椎脱臼法处死大鼠,处死后取各组左侧股骨中段1 cm,4%多聚甲醛固定、脱蜡、包埋,沿股骨长轴切片,HE染色后,40倍光镜下观察骨组织形态变化。
1.3.4 免疫组化法检测HO-1蛋白表达 取左侧股骨标本,常规脱蜡至水,经抗原修复,消除内源性过氧化物酶活性后,滴加HO-1抗体,湿箱内4 ℃过夜。滴加二抗,DAB显色后复染,中性树胶封片,显微镜下观察。以细胞浆有棕褐色颗粒沉着为阳性,采用图像分析系统检测平均光密度值(MOD)。

2 结 果
2.1 各组大鼠腰椎、股骨BMD比较 见表1。
表1 各组大鼠腰椎、股骨BMD比较

表1 各组大鼠腰椎、股骨BMD比较
组 别n腰椎股骨空白对照组100.191 1±0.003 20.215 2±0.005 8模型组100.160 4±0.005 8*0.180 3±0.004 9*雌激素组100.188 9±0.005 6△0.208 0±0.007 0△抗骨增生胶囊组100.180 1±0.004 7△0.201 0±0.003 4*△
与空白对照组比较,*P<0.05;与模型组比较,△P<0.05
由表1可见,与空白对照组比较,模型组腰椎、股骨BMD均降低(P<0.05),抗骨增生胶囊组股骨BMD降低(P<0.05);与模型组比较,雌激素组、抗骨增生胶囊组腰椎、股骨BMD均升高(P<0.05);抗骨增生胶囊组、雌激素组腰椎、股骨BMD组间比较差异无统计学意义(P>0.05)。
2.2 骨形态学观察 光镜下观察,空白对照组骨小梁丰富密集,排列规则;模型组骨小梁数目减少,排列稀疏,宽度变窄,骨髓腔增大,脂肪细胞增多,部分骨小梁断裂,说明造模成功;与模型组相比,雌激素组和抗骨增生胶囊组骨组织形态明显改善,骨小梁数目增多,宽度增大。见封2,图1。
2.3 各组大鼠骨代谢指标比较 见表2。
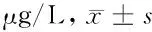
表2 各组大鼠骨代谢指标比较
由表2可见,与空白对照组比较,模型组血清BGP、PⅠNP均升高(P<0.05),OPG降低(P<0.05);与模型组比较,雌激素组、抗骨增生胶囊组BGP、PⅠNP均降低(P<0.05),OPG升高(P<0.05);抗骨增生胶囊组、雌激素组BGP、PⅠNP、OPG组间比较差异无统计学意义(P>0.05)。各组RANKL组间比较差异无统计学意义(P>0.05)。
2.4 各组大鼠氧化应激指标比较 见表3。
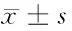
表3 各组大鼠氧化应激指标比较
由表3可见,与空白对照组比较,模型组CAT降低(P<0.05),MDA升高(P<0.05);与模型组比较,雌激素组、抗骨增生胶囊组CAT升高(P<0.05),MDA降低(P<0.05);抗骨增生胶囊组、雌激素组CAT、MDA组间比较差异无统计学意义(P>0.05)。各组SOD组间比较差异无统计学意义(P>0.05)。
2.5 各组大鼠HO-1表达及HO-1 MOD比较 见表4,图2。
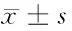
表4 各组大鼠HO-1 MOD比较
由表4可见,与空白对照组比较,模型组HO-1 MOD升高(P<0.05);与模型组比较,雌激素组、抗骨增生胶囊组HO-1 MOD均降低(P<0.05);雌激素组、抗骨增生胶囊组HO-1 MOD组间比较差异无统计学意义(P>0.05)。
HO-1蛋白主要表达于骨小梁周边的成骨细胞、软骨细胞和骨髓。与空白对照组相比,模型组可见大量HO-1蛋白表达,雌激素组和抗骨增生胶囊组仅可见少量的HO-1蛋白表达(见封2,图2)。
3 讨 论
PMOP是指妇女绝经后因雌激素水平下降、卵巢功能逐渐衰退而导致人体内骨的吸收大于骨的形成,进而出现以骨显微结构破坏和全身骨量减少为基本特征的一种代谢性疾病。雌激素缺乏一直被认为是PMOP的核心机制,但最近的研究表明,氧化应激才是最根本机制[9]。氧化应激可抑制成骨细胞分化,诱导成骨细胞凋亡,刺激破骨细胞生长分化和骨吸收,从而导致骨质疏松症,临床主要表现为骨痛和骨折率增加。本课题组前期研究结果显示,抗骨增生胶囊含药血清可促进大鼠成骨细胞和骨髓间充质干细胞的增殖和成骨分化[10]。本研究旨在通过活体实验观察抗骨增生胶囊对去卵巢骨质疏松症大鼠的治疗作用,并探究其中可能涉及的机制。
PMOP属中医学“骨痿”范畴。肾藏精、主骨,绝经后女性“天癸竭,地道不通”,肾阴精亏虚,日久迁延则耗损精髓,髓海空虚,故足不任身,发为骨痿。年老体弱,体虚气弱,气机不利,日久气虚无力推动血行脉中,必致血瘀;肾之阳气不足,则血行无力,血脉不温,脉寒流缓也可成瘀;肾之阴精不足,则精津亏少,血少而稠,血流黏滞而瘀。故PMOP病机多为肾虚血瘀,肾虚为本,血瘀为标。治宜补肾填精,兼活血化瘀。抗骨增生胶囊中熟地黄补血养阴,益精填髓;女贞予补益肝肾,清虚热;肉苁蓉补肾阳,益精血;狗脊补肝肾,强腰膝,祛风湿;骨碎补补肾强骨,续伤止痛;淫羊藿补肾阳,强筋骨,祛风湿;鸡血藤、牛膝活血通络止痛;莱菔子行气消胀,补而不滞。诸药合用,共奏补腰肾、强筋骨、活血止痛之功。
双侧性腺(卵巢)摘除来建立PMOP大鼠模型是世界卫生组织(WHO)和美国食品与药物管理局(FDA)推荐的最佳模型。本研究选取6月龄大鼠建立模型,观察各组大鼠腰椎、股骨BMD和骨组织形态,BMD表示骨强度,可用于诊断骨质疏松、评价药物疗效[11],而观察骨组织微形态可以直观评价骨质的疏松状况[12]。与空白对照组比较,模型组腰椎、股骨BMD明显降低(P<0.05),骨组织稀疏,骨小梁数量减少,提示本研究造模成功。与模型组比较,雌激素组、抗骨增生胶囊组BMD明显增高(P<0.05),骨组织形态明显改善,骨小梁数目增多,宽度增大,说明抗骨增生胶囊可增加骨量和骨密度,改善大鼠骨质疏松;雌激素组、抗骨增生胶囊组BMD组间比较差异无统计学意义(P>0.05),说明抗骨增生胶囊效果与雌激素相似。
骨代谢指标可反映骨的转换状况。BGP特异反映成骨细胞活动度[13],研究发现PMOP患者体内BGP明显升高[14]。PⅠNP是反映骨形成的指标之一,其升高表示Ⅰ型胶原合成速率增快,代表骨转换活跃,研究发现PMOP女性PⅠNP水平明显升高[15]。RANKL是由破骨细胞产生,与核转录因子κB受体活化因子(RANK)结合而增加骨质吸收,OPG是RANKL的抑制剂,由雌激素刺激生成,故OPG/RANK/RANKL通路是雌激素参与调节骨生成和骨吸收的途径之一,也是绝经后女性发生骨质疏松症的机制之一[16]。绝经后女性OPG水平下降,提示骨吸收增加而骨形成减少。本研究结果显示,与空白对照组比较,模型组血清BGP、PⅠNP升高(P<0.05),OPG降低(P<0.05),提示骨代谢呈现高转换水平;与模型组比较,雌激素组、抗骨增生胶囊组BGP、PⅠNP均降低(P<0.05),OPG升高(P<0.05),说明抗骨增生胶囊可显著提高OPG水平,促进骨形成,减少骨吸收,拮抗骨质疏松。雌激素组、抗骨增生胶囊组BGP、PⅠNP、OPG组间比较差异无统计学意义(P>0.05),可见抗骨增生胶囊与雌激素疗效相当。
MDA是氧化应激后脂质过氧化损伤的标志物,而SOD、CAT是体内重要的抗氧化酶,是评估氧化应激状态的可靠指标。PMOP女性体内性激素水平变化会改变大部分代谢活动,抗氧化应激水平显著下降,氧自由基水平升高[17]。本研究结果显示,与空白对照组相比,模型组CAT降低(P<0.05),MDA升高(P<0.05),说明氧化应激可能在PMOP的发病中起着重要作用。而抗骨增生胶囊组和雌激素组血清CAT较模型组升高(P<0.05),MDA降低(P<0.05),且2组组间比较差异无统计学意义(P>0.05)。说明抗骨增生胶囊改善了去卵巢大鼠氧化应激损伤。
HO-1是一种细胞诱导型Ⅱ型酶,也是血红素分解代谢过程中的限速酶,能够促进一氧化碳、铁和胆红素的释放,其反应产物涉及各种氧化诱导剂的防御,包括脂多糖、过氧化氢、缺氧等,其表达在铁稳态、抗氧化、骨吸收反应中起着重要的作用,是目前发现的最易被诱导的抗氧化应激的酶[18]。HO-1在正常状态下呈低水平表达,而当某些刺激出现如细胞氧化还原状态失衡,会诱使其表达上升,发挥其抗氧化应激能力,所以HO-1可反映氧化应激水平强弱。本研究结果表明,与空白对照组比较,模型组可见大量HO-1蛋白表达,HO-1 MOD升高(P<0.05);与模型组比较,雌激素组、抗骨增生胶囊HO-1 MOD均降低(P<0.05),仅可见少量的HO-1蛋白表达,且2组HO-1 MOD值比较差异无统计学意义(P>0.05)。这说明抗骨增生胶囊和雌激素效果相同,可以改善去卵巢大鼠氧化应激损伤状态。
综上,本研究通过观察抗骨增生胶囊对去卵巢骨质疏松大鼠一系列指标的改善,证实其能显著增加去卵巢骨质疏松大鼠的骨密度,修复骨结构,降低骨组织的高转换水平代谢,增加骨形成,减少骨吸收,从而改善骨质疏松。其可能有与雌激素相似的机制,包括降低破骨细胞活性,拮抗氧化应激,改善氧化应激损伤,抑制破骨细胞分化并促进成骨细胞分化。但究其更细化的机制,如究竟涉及何种具体信号通路而改善抗氧化因子的表达尚不清楚,本课题组将针对抗骨增生胶囊对深层具体通路的影响机制进一步探讨。
