超高效液相色谱—串联质谱法测定鱼、虾中4种抗病毒药物的残留
2020-07-28张玉昆刘振先郑晓莹刘锦信缪小群
张玉昆,刘振先,徐 歌,郑晓莹,刘锦信,缪小群
( 佛山科学技术学院,广东 佛山 528000 )
抗病毒药物作为人类治疗病毒性疾病的专用药,移作兽用缺乏科学依据[1]。2005年,美国食品药物管理局已经下令禁止把人类抗病毒药物滥用于畜禽中[2],与此同时我国农业部第560号公告也曾明令禁止抗病毒药物作为兽药使用[3]。虽然抗病毒药属动物禁用药物,但其在动物养殖中依然使用广泛。金刚烷胺、金刚乙胺有致畸性,会损害人体的生殖系统, 可导致精神病患者精神分裂症状加重,并出现难治性双下肢水肿[4]。若饲养者不科学、不合理地使用该药物,易导致药物在畜禽机体内残留与富集,不仅会造成畜禽中毒,也会引起病毒耐药毒株的出现使抗病毒药物有效性降低,其耐药性也有转移扩散到人体的风险[5],对消费者的健康存在很大的隐患。
国内外主要采用酶联免疫法[6]、气相色谱法[7]、液相色谱法[8]、液相色谱—质谱法[9-15]等检测动物组织中的金刚烷胺、金刚乙胺、美金刚和吗啉胍。目前,我国对于水产品中抗病毒药物药物残留检测的研究还比较少, 尚未制定相关国家标准检测方法。笔者在查阅大量文献基础上对仪器参数和样品前处理条件进行优化,建立的分散固相萃取—超高效液相色谱—串联质谱法,能够同时测定水产品中的金刚烷胺、金刚乙胺、美金刚和吗啉胍,方法简单,操作方便,为批量检测样品中金刚烷胺、金刚乙胺、美金刚和吗啉胍等违禁药物的残留量提供技术支持。
1 材料与方法
1.1 材料与试剂
样品包括凡纳滨对虾(Litopenaeusvannamei)、鲤鱼(Cyprinuscarpio)、草鱼(Ctenopharyngodonidellus)、新对虾(Metapenaeussp.)等,均为市售样品。
试剂:甲醇、乙腈(色谱纯,德国SccBayer公司);甲酸、乙酸(分析纯,天津科密欧化学试剂厂);三氯乙酸(分析纯,天津市大茂化学试剂厂);C18(粒径40 μm);PSA(美国Agilen公司)。
标准品:金刚烷胺(纯度98%,中国食品药品鉴定研究所);美金刚(纯度99.2%,美国Sigma公司);金刚乙胺(纯度99%,美国Sigma公司);吗啉胍(纯度98.3%,日本TCI公司);金刚烷胺-d15(纯度99.3%,加拿大Toronto Research Chemicals公司)。
1.2 仪设备器
API4000超高效液相色谱—串联质谱仪(美国AB公司);lHSC-24B氮吹浓缩仪(天津恒奥科技);JW-3021HK低温超高速离心机(安徽嘉文);MTV-100涡旋混合器(德国IKA公司);高速分散均质机(上海本昂)。
1.3 标准溶液配制
1.3.1 抗病毒药物标准储备溶液配制
准确称取金刚烷胺、金刚乙胺、美金刚、吗啉胍10 mg(按实际含量折算,精确至0.0001),分别置100 mL容量瓶中使用甲醇溶解并稀释,配成0.1 mg/mL外标储备溶液,-18 ℃下保存。甲醇稀释备用。
1.3.2 抗病毒药物混合中间液的配制
取适量配制好的抗病毒药物标准储备液,甲醇定容,配制成1.0 μg/mL的混标储备液,-18 ℃下保存。甲醇稀释备用。
1.4 仪器条件
1.4.1 色谱条件
色谱柱:Shim-pack GIST C18-AQ HP(3 μm,2.1 mm×100 mm);流动相:A(0.1%甲酸水),B(甲醇);柱温:35 ℃;进样量:10 μL。梯度洗脱程序见表1。
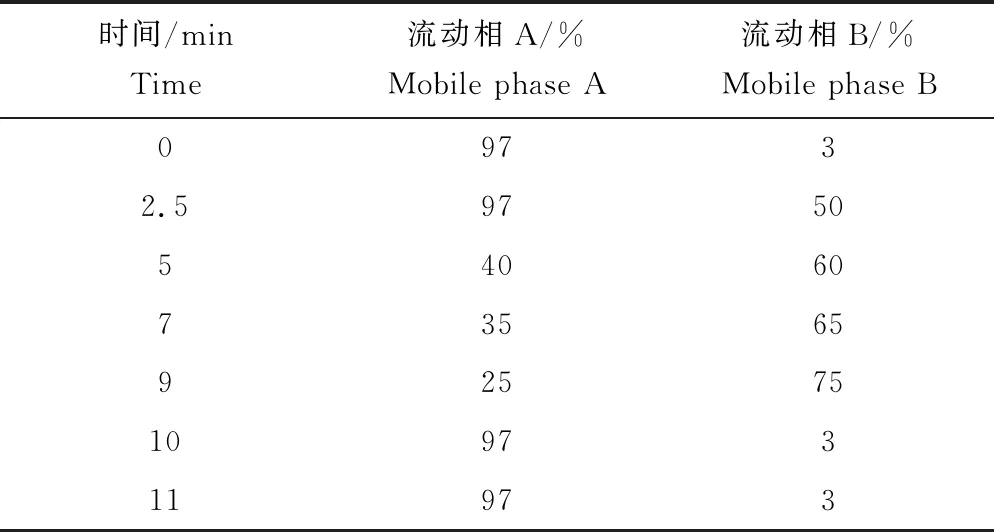
表1 梯度洗脱程序
1.4.2 质谱条件
离子源:电喷雾离子源(ESI+);扫描方式:正离子扫描;气帘气压力:25 psi(1 psi=6.8948 kPa);离子源喷雾电压:5500 V;碰撞气压力:5 psi; 离子源温:550 ℃;喷雾气压力:60 psi;加热辅助雾化气压力:55 psi;柱温35 ℃;检测方式:多反应监测(MRM)。监测离子对、锥孔电压和碰撞能量等见表2。

表2 目标化合物的多反应监测质谱参数
1.5 样品前处理方法
称取2 g处理好的样(精确至0.01 g),于50 mL聚丙烯具塞离心管中,加入40 μL金刚烷胺-d15内标标准工作液,加入1%三氯乙酸和1%乙酸乙腈(1∶9,体积比)10 mL提取,涡旋振荡5 min,超声15 min后用冷冻高速离心机9000 r/min,4 ℃离心5 min取上清液于另一支50 mL离心管中。在残渣中加入5 mL提取剂重复上述操作,合并上清液,于45 ℃水浴氮吹至近干。用初始流动相复溶并定容1 mL,将复溶后的液体全部转移到装有30 mg PSA、30 mg C18、50 mg中性氧化铝的2 mL的离心管中,涡旋振荡5 min,9000 r/min,4 ℃,离心5 min。将上述离心后的净化液过0.22 μm滤膜待上机测定。
2 结果与分析
2.1 方法线性范围及检出限结果
4种抗病毒类药物的质量浓度为1~100 μg/L,采用内标法,以待测物的质量浓度作为横坐标,以待测物定量离子的峰面积与内标定量离子的峰面积之比作为纵坐标,绘制标准曲线;此外,在空白鲤鱼肉、草鱼肉、凡纳滨对虾样品中加入4种抗病毒类药物的标准溶液,经过提取和净化后,进行仪器检测,以3倍信噪比为检出限,以10倍信噪比为定量限。4种化合物的线性方程、相关系数及检出限、定量限见表3。

表3 线性方程与检出限
2.2 方法的回收率和精密度结果
以空白鲤鱼、草鱼、凡纳滨对虾作为样品基质,在 1、10、50 μg/kg含量水平上(表4)添加4种抗病毒药物混合标准溶液,按上述方法测定并计算回收率,每个添加水平测定6个平行样品,进行回收率试验。结果显示,在空白鲤鱼、草鱼、凡纳滨对虾样品中4种抗病毒药物的回收率为86.0%~98.5%,相对标准偏差小于8%,本试验所建立方法的精密度与回收率均能达到残留检测标准的要求。各特征离子质量色谱图见图1~2。
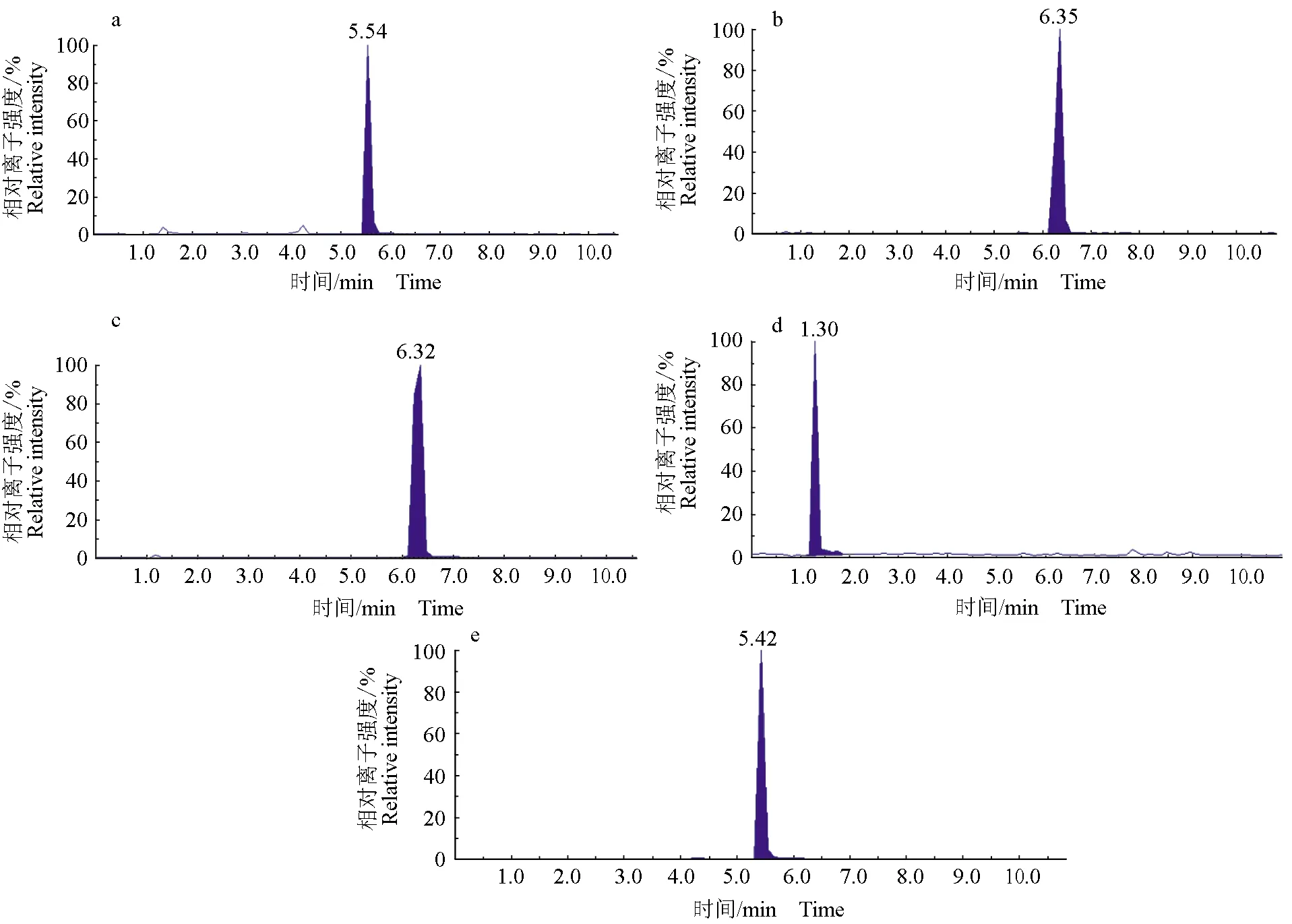
图1 10 μg/kg混合标准溶液MRM色谱图

表4 空白鲤鱼、草鱼、凡纳滨对虾中4种抗病毒药添加回收率和精密度(n=6)
2.3 实际样品检测
将建立的方法应用于实验室留样的20个鱼、虾样品进行检测,有一份新对虾样品中检测出金刚烷胺含量为4.7 μg/kg。
3 讨 论
3.1 仪器条件选择
4种抗病毒药物均含有胺基基团易结合H+,带正电荷,因此,在进行质谱扫描过程中采用正离子扫描模式。通过优化离子源参数,确认母离子峰,并进行二级质谱分析,确保每个母离子均有3个子离子,同时监测多个子离子能够减少基质造成的干扰,避免假阳性结果的发生,确保结果的准确性。在液相色谱流动相中加入少量的甲酸会增强待测化合物的响应强度,这主要是由于酸提供了更多的H+。因此笔者选用0.1%甲酸溶液与甲醇为流动相,对梯度洗脱程序进行优化,从而保证各个化合物有良好的峰形、分离度及响应强度。
3.2 提取溶剂的选择
金刚烷胺、金刚乙胺、美金刚、吗啉胍均属极性化合物,根据相似相溶原理此4种抗病毒药物质更易溶于极性有机试剂中,因此本试验考察了乙腈与甲醇的提取效果,相比甲醇而言,乙腈沉淀蛋白脂肪的效果更强,离心后的溶液更为干净,这为后续净化步骤提供了便利;此外,化合物中所含的胺基基团,在酸性条件下带正电荷易溶于水,因此本试验分别考察了三氯乙酸、甲酸、盐酸及其与不同比例的乙腈的提取效果。通过比较试验,发现1%三氯乙酸和1%乙酸乙腈作为提取溶剂时基质干扰较小且回收率高。
3.3 基质净化方式
鱼、虾中含有大量的脂肪、蛋白质和碳水化合物等干扰物[16],如果不将其净化而直接用于测定,就会产生较大的基质抑制效应[17],影响检测的灵敏度。考虑到C18可有效去除脂类、糖类等亲脂性杂质,PSA粉可去除基质中的脂肪酸和甾醇类干扰物,中性氧化铝通过路易斯酸碱作用、极性相互作用和离子交换作用能有效的吸附基质中脂肪类杂质。本试验对C18粉、PSA粉及中性氧化铝的净化效果进行了考察。结果表明,这3种净化剂单独使用时或两种一起使用时净化效果均不理想。本试验考察了20~100 mg C18粉、20~100 mg PSA粉、30~100 mg中性氧化铝不同组合对样品的净化效果。结果发现,当30 mg C18粉、30 mg PSA粉与50 mg中性氧化铝混合使用时能有效的降低基质效应,回收率均为86.0%~98.5%。

图2 空白鲤鱼肉中添加10 μg/kg混合标准溶液及空白基质MRM色谱图
目前,我国行业标准SN/T 4253—2015中对抗病毒类药物的检测低限为1.0 μg/kg[18]。本试验通过对仪器参数和样品前处理条件的优化,建立了超高液相色谱—串联质谱法同时测定鱼、虾中金刚烷胺、金刚乙胺、美金刚、吗啉胍的分析方法,该方法获得了较为满意的分离效果,其准确度、精密度和检出限均满足国内相关法规的要求。本研究采用30 mg C18、30 mg PSA、50 mg中性氧化铝净化的方式结合Shim-pack GIST C18-AQ柱分离,有效解决了金刚烷胺、金刚乙胺、美金刚、吗啉胍同时检测干扰多、回收率低的难题,节约了试验成本,提高了工作效率;同时,通过同位素内标法定量,进一步减小基质效应带来的误差,使试验结果更加准确可靠,特别适用于实际样品的批量检测。
