精养草鱼池塘底泥微生物群落结构分析
2020-07-28章海鑫付辉云张燕萍张爱芳陶志英余智杰
章海鑫,付辉云,张燕萍,张爱芳,陶志英,王 生,余智杰
( 江西省水产科学研究所,江西 南昌 330039 )
目前,草鱼(Ctenopharyngodonidellus)精养池塘水体一般为封闭或半封闭,养殖密度高、投喂量大,水体营养盐的利用率不高,仅有少量饵料能被草鱼吸收利用,残饵、排泄物与残骸等则通过物理、化学和生物作用逐渐沉降到水底淤泥中[1]。养殖水体与外界交换很少,沉积的营养盐主要靠自身消解,此能力直接决定了沉积营养盐的存在形式及其对养殖草鱼和环境的影响程度[2]。参与底泥沉积营养盐作用的底泥微生态系统扮演着重要的角色,不仅参与养殖系统中有机质、无机盐等物质的循环代谢及能量代谢,也影响养殖动物消化系统微生物菌群结构[3]。底泥微生态系统的演替一直贯穿于整个群落发展的始终。微生物具有较短的代时且对环境变化较为敏感,所以在池塘养殖过程中,底泥微生物群落结构的变化能够及时反映环境的变化,并且影响水产品的质量[4]。因此,可以通过探明微生物群落之间的演替关系来评估和判断养殖环境的变化。
草鱼养殖池塘底泥微生物群落的研究已有很多,如程莹寅等[3]用16S rDNA克隆文库的方法分析主养草鱼池塘底泥微生物群落结构,Han等[5]使
用同样的方法分析混养有草鱼、异育银鲫(Carassiusauratusgibelio)和团头鲂(Megalobramaamblycephala)的池塘底泥中微生物的主要群落结构和优势种群。以上两种养殖模式下,池塘底泥微生物主要是变形菌门、厚壁菌门和分类地位未定的种类。此外,唐凌等[4]分析了不同年份草鱼池塘底泥群落结构,也从养殖模式上分析了成都平原主养草鱼并搭配鲫鱼(Carassiusauratus)池塘底泥中细菌的群落结构[6];张植强等[7]则使用PCR-DGGE技术分析了草鱼和乌鳢(Channaargus)养殖围隔中沉积物的微生物群落结构。以上这些研究均使用16S rDNA克隆文库和PCR-DGGE技术分析底泥群落结构,而且均为一次性的分析底泥微生物群落结构,并未分析底泥微生物群落在时间维度上的变化。但在草鱼养殖周期中,环境会发生一定的变化,影响底泥的微生物群落结构。因此,分析草鱼养殖池塘底泥微生物群落结构随养殖时间的变化情况对指导草鱼养殖和分析微生态系统的生态作用有重要的意义。笔者利用MiSeq测序技术逐月分析草鱼养殖池塘底泥微生物群落结构,以期查明草鱼养殖过程中底泥微生物群落的变化情况和池
塘底泥生态的变化。
1 材料与方法
1.1 样品采集
1.1.1 池塘养殖信息
样品采集池塘为南昌市南昌县蒋巷镇同一养殖户、同样养殖模式[套养彭泽鲫(C.auratus)、鲢鱼(Hypophthalmichthysmolitrix)、鳙鱼(Aristichthysnobilis)]的3口草鱼精养池塘,均投喂全价配合饲料(表1)。

表1 池塘养殖情况
1.1.2 样品采集
2018年4—11月,每月采集样品。表层底泥样品(约200 g)用彼得森采泥器采集,暂时保存在干冰采样箱中,24 h内带回实验室,于冰箱-80 ℃保存。
1.2 DNA提取、扩增和测序
分别称取每月平行的3口池塘的底泥0.5 g,用土壤DNA提取试剂盒(OMEGA Soil DNA Kit,D5625)提取,提取后混合为1个样。16S rRNA基因V3~V4区扩增引物为:341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)。PCR产物用2%的琼脂糖凝胶检测后,利用胶回收试剂盒(QIAGEN)回收目的条带。然后使用TruSeq©DNA PCR-Free Sample Preparation Kit建库试剂盒(Illumina)进行文库构建,构建好的文库经过Qubit和Q-PCR定量, 用HiSeq2500(北京诺禾致源公司)测序。
1.3 数据处理与分析
1.3.1 序列处理
参照文献[8]的方法,采用Illumina HiSeq测序平台得到原始数据,然后进行拼接和质控,得到有效数据,再进行嵌合体过滤,得到可用于后续分析的有效数据。然后基于有效数据进行运算分类单元(OTUs)聚类。
1.3.2 统计分析
利用Uparse软件对所有样品的全部有效数据进行聚类,以97%的一致性将序列聚类成运算分类单元。根据运算分类单元聚类结果对每个运算分类单元的代表序列做物种注释,得到对应的物种信息。根据物种注释结果,选取每个样品在门和种2个分类级别上最大丰度前10的物种,生成物种相对丰度柱形累加图。对所有样品的运算分类单元进行丰度分析、Alpha多样性分析等,以得到样品内物种丰富度和均匀度信息等。使用QIIME软件(Version 1.7.0)计算Alpha多样性指数,包括ACE 指数、Chao1指数等丰富度指数。选用ANOSIM统计分析方法检验分组样品的物种组成和群落结果的差异显著性。
2 结果与分析
2.1 测序结果与多样性分析
样品原始序列为53 276~71 351条,得到最终的有效数据序列为47 743~65 233条,可归纳为14 027~21 098个运算分类单元(表2)。
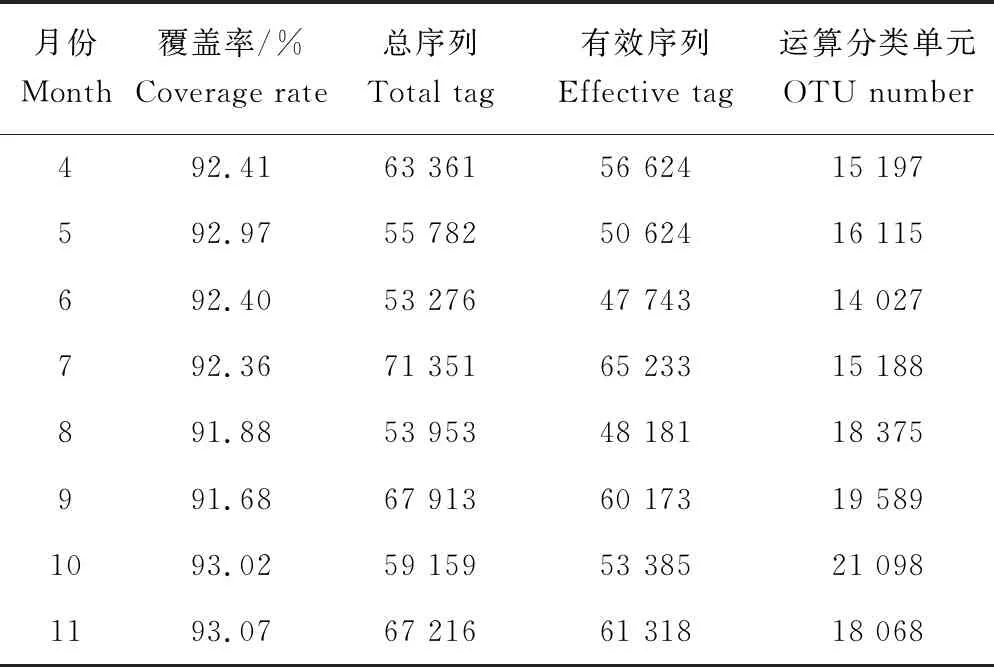
表2 数据和运算分类单元数目统计
样品序列多样性分析结果见表3。物种丰富度指数ACE和chao1指数分别为8602.39~18 313.78和8471.27~17 863.10,5月最高,11月其次,10月和9月最低,其余月差别不大。物种数高峰出现在5月和11月,物种数低峰出现在10月和9月。10月和9月Shannon指数最低,5月最高,其次分别为4、6、7、11、8月等。综上,4、5、6月多样性高于其余月份。
2.2 菌群结构分析
8个月的样品中检测到的微生物归属见表4。5月细菌总数最丰富,归属于60个门、148个纲、293个目、390个科、551个属。10月细菌总数最少,归属于54个门、124个纲、251个目、328个科、398个属。其余月介于两者之间。
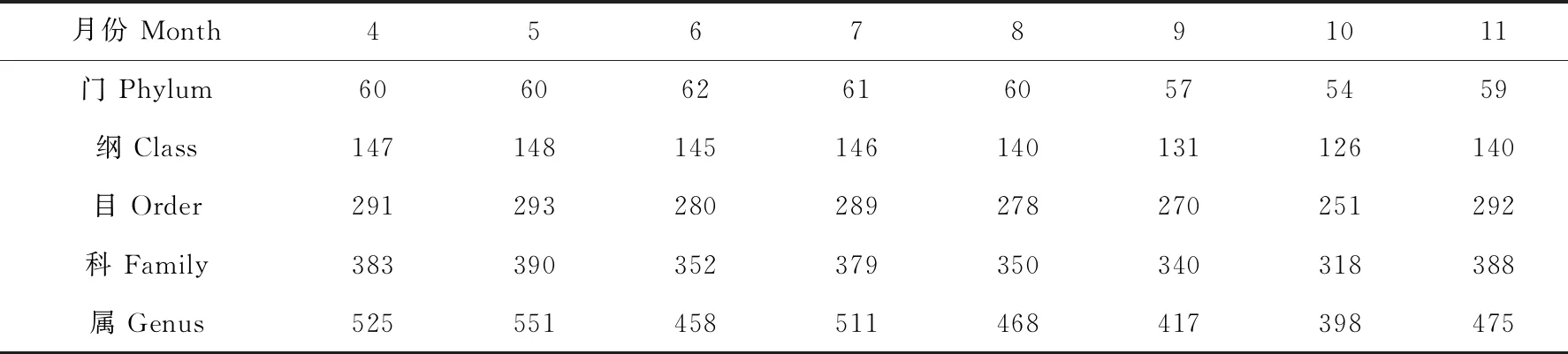
表4 4—11月样品中检测到门、纲、目、科、属的种类数
主要门为变形菌门、拟杆菌门、绿弯菌门、酸杆菌门、放线菌门、Nitrospinae、蓝细菌门、螺旋体门、厚壁菌门、硝化螺旋菌门、疣微菌门、广古菌门12门类,在4—11月的样品检测量均超过1%,5、7、9月还有Patescibacteria,检测量超过1%,10月和11月蓝细菌门检测量不超过1%,但10月梭杆菌门超过1%,而11月Latescibacteria超过1%。其余未超过1%的门主要是棒状杆菌门、迷踪菌门、Calditrichaeota、芽单胞菌门、纤维杆菌门、紫细菌门和Dependentiae等。在优势门(丰度超过10%)中,变形菌门是所有样品中最大的优势菌群,丰度均超过了35%。绿弯菌门和拟杆菌门是4、7月的优势菌群,拟杆菌门和酸杆菌门是5月的优势菌群,拟杆菌门、绿弯菌门和酸杆菌门是6月的优势菌群,酸杆菌门是8月的优势菌群,绿弯菌门和酸杆菌门是9—11月的优势菌群。其他是未能确定门的和门分类比例较少的门(图1)。ANOSIM检验结果表明,底泥月间差异不显著(P>0.05),微生物群落结构组成大体相同,只有少量细菌在数量上存在较小差别。月份间菌群在种类和数量方面存在一定差异,但整体结构差异不显著。

图1 样品中基于门水平的菌群相对丰度分析
2.3 微生物种结构组成
样品中丰度最高的10个运算分类单元代表了主要微生物类型。4—11月样品中10个最高运算分类单元代表的种(属)见表5。地杆菌(Geobacter)、Desulfatiglans、Candidatuscompetibacter和厌氧粘细菌(Anaeromyxobacter)在4—11月的样品中均有存在,且丰度大。除10月外,脱氯单胞菌(Dechloromonas)、螺旋体(Spirochaeta-2)和Crenothrix在其他月样品中丰度均在前10。其中地杆菌在4、5、6、7月的样品中丰度均最大,8、9、10、11月丰度波动变化。Desulfatiglans在4—9月是一个丰度逐渐上升的过程,8、9月丰度最大,后开始下降,11月又最大。10月丰度前10菌种组成与其他月的差别较大,丰度最大的是C.competibacter。脱氯单胞菌、螺旋体在其他月中有,但在10月丰度未超过10%。

表5 4—11月样品丰度最高的10个运算分类单元
3 讨 论
3.1 池塘底泥菌群结构月度变化
虽然ANOSIM检验得出底泥月间微生物群落结构差异不显著(P>0.05),而且张植强等[7]在草鱼围隔沉积物中也得到菌落结构变化不显著的结果;同样Zhou等[9]认为,池塘底泥微生物群落结构稳定的原因是有机物的沉积量超过了池塘的净化能力。但本研究发现,ACE和Chao1指数月度差异较大,Shannon指数也有一定的差异,这与史丽娜等[10,12]的结果类似,苟小兰等[11]同样得到异育银鲫养殖池塘多样性存在月度变化的情况,说明草鱼池塘底泥微生物群落处于动态演替过程。唐凌等[4]发现,池塘经养殖4年后微生物菌群结构发生了演替,而本研究未发现群落结构月度间的显著性差异,可能是演化的时间不长。同样,由本研究各月样品优势门组成的变化也可以看到微生物群落的缓慢演替现象;虽然各月最大优势类群与程莹寅等[3,13]报导的一致,均为变形菌门,但本研究中各月除了变形菌门外,其他优势门的构成存在差异。苟小兰等[11-12]的试验得到了底泥丰富度指数和多样性指数会随着时间的推移而降低的结论,而本试验中所得结果是丰富度指数和多样性指数存在波动变化的趋势,并在10月降至最低,11月有升高。原因可能除分析方法差异外,养殖过程中饲料投喂的增加—降低过程,也会导致对菌群结构定向驯化由弱到强再变弱的过程。

(续表5)
3.2 菌属对草鱼底泥生态的影响
丰富度最高的10个运算分类单元有助于了解样品中所含的主要微生物类型。一般认为,在有机物含量丰富的水体中,变形菌门,特别是δ-变形菌类群的数量增多[14],而本研究中丰富度最高的10个运算分类单元均来源于变形菌门,这可能是大多高密度养殖池塘底泥微生物优势种均为变形菌门的原因。4—7月地杆菌丰度最高,8—11月则是脱硫酸盐橡菌丰度最高。地杆菌属于δ-变形杆菌纲,是最早发现的可以完全氧化有机物并获得能量用于生长的异化铁还原菌之一,广泛存在于各种厌氧环境中,可以利用Fe(Ⅲ)和乙酸作为电子供体[15-16]。Moon等[17]认为,有机物的积累能刺激地杆菌大量富集。说明残饵、排泄等使得池塘底泥有机物在4—7月持续递增,而且池塘底部存在溶解氧缺少的问题。8月以后地杆菌丰度出现波动的原因之一可能是生物(草鱼等)扰动使Fe(Ⅲ)反复活化[15]。同时也发现有另一种呼吸性铁还原菌——厌氧粘细菌[18]在所有样品中均有出现,它与地杆菌对氧化铁的利用具有差别,其能够偶联乙酸盐氧化,进行还原铁矿的呼吸代谢。地杆菌和厌氧粘细菌均能够在厌氧条件下抑制甲烷产生[15-18],这也可以解释许多草鱼养殖池塘在缺氧时,底部时常产生气泡,但慢慢气泡会减少的现象。随着养殖残饵和排泄物等有机物的大量增加,底泥硫化物的含量也增加,所以8—11月样品中Desulfatiglans丰度高于地杆菌。Desulfatiglans是Suzuki[19]于2014年分离的一种与脱硫小杆菌(Desulfobacterium)紧密联系,但又与脱硫小杆菌属中其他种明显不同的新种,其主要功能是通过硫酸盐还原的方式脱除硫酸盐[20]。自8月开始,Desulfatiglans的丰度超过地杆菌,一度丰度最高,说明硫化物的累积量达到高峰,这也间接解释了许多养殖池塘在养殖中后期容易出现硫化氢的现象。在4—9月丰度较高的脱氯单胞菌和Crenothrix在10月样品中丰度未进前10,而10月丰度最高的是C.competibacter。脱氯单胞菌属于兼性反硝化细菌,可以在有氧和无氧条件下矿化各种单环芳香化合物,将苯转化成二氧化碳[21],还具有反硝化除磷的功能[22-24];Crenothrix则是2017年[25]新分离的一种能够氧化甲烷的细菌,属于兼性细菌,可以在有氧和无氧条件下将甲烷氧化成二氧化碳,也具有减少硝酸盐向亚硝酸盐转化的功能。由此可知,10月草鱼养殖池底泥中芳香族化合物及甲烷的产生得到一定的控制或者减少。而此时磷的含量累计到最高,所以C.competibacter处于领先优势,因其属于聚糖菌,主要使用碳源除磷,在厌氧条件下将挥发性脂肪酸转化成聚羟基脂肪酸,在有氧条件下可以将聚羟基脂肪酸氧化成二氧化碳或转化成糖原[26]。
