日粮铜水平对大鼠肠道和肝脏组织形态、铜离子代谢及氧化还原平衡的影响
2020-07-28张峰郑卫江姚文
张峰,郑卫江,姚文
(南京农业大学动物科技学院,江苏 南京 210095)
铜元素是能量产生、血管生成、铁的吸收以及其他细胞过程中必需的微量元素[1],参与畜禽正常心脏功能,结缔组织发育,髓鞘形成,角质化和组织色素沉着,是动物细胞中某些主要的氧化酶类的辅因子[2]。铜在机体组织中储量从高到低依次为肝脏、脑、肾脏、心脏,其低储量、均衡分布和高排泄,避免了组织中由于过量铜积累而产生毒性作用[3]。小肠上皮细胞是铜吸收的第一道屏障(对铜的吸收能力依次是十二指肠、空肠、回肠)[4]。肠道上皮细胞吸收的铜通过门静脉转移到肝脏,过量的铜通过胆汁重新进入肠腔,随粪便排泄或重吸收。到达肝脏的铜,通过铜转运蛋白(CTR1)进入肝细胞[5],与细胞质中铜转运伴侣蛋白,如铜伴侣蛋白(CCS)、细胞色素c装配蛋白(COX17)、铜分泌伴侣蛋白(ATOX1)等螯合以被特定功能的蛋白利用[6]。CCS将铜运送并插入铜锌-过氧化物歧化酶(CuZn-SOD)以激活其伴侣蛋白(SOD1)产生抗氧化作用。肝脏内铜过量时,P型ATP酶(ATP7B)将铜跨膜转运至铜蓝蛋白(CP),CP是肝细胞产生的多铜氧化酶,主要分泌至循环系统[7],也可分泌入胆汁,以维持肝脏铜状态平衡和稳定[8]。饲喂不同铜水平(5~6 mg·kg-1和225 mg·kg-1)日粮断奶仔猪肝脏Ctr1、Atp7a、Ccs及Sod1基因表达水平无显著差异,但饲喂高铜(225 mg·kg-1)日粮断奶仔猪肝脏中Atp7b和Atox1基因表达水平显著上调,Cox17基因以及十二指肠组织中Atox1基因显著下调[9-10]。而日粮以及饮水中铜水平对啮齿动物肝脏中Cp基因表达水平无显著影响[11]。
动物对高铜的耐受性与物种密切相关。单胃动物体内存在的一套健全的铜稳态调节机制,引起铜中毒的铜剂量至少需超过需要量的25倍[12],如猪可耐受50倍需要量的铜,约250 mg·kg-1铜。过量的铜摄入可能会诱导机体氧化应激和细胞损伤[13]。大鼠持续4周饮用100 mg·kg-1铜水平水,其血浆和肝脏组织中丙二醛(MDA)水平未见显著变化[14],但当水中铜水平上升至1 000 mg·kg-1时,大鼠脑组织中MDA水平显著升高[15]。大鼠饮用90 d不同铜水平(100和200 mg·kg-1)的水,其脑、肝脏和肾脏组织中MDA水平均显著高于对照组(生理盐水),且肝脏MDA水平最高[13]。而225 mg·kg-1日粮铜(CuSO4)显著提高断奶仔猪十二指肠中MDA水平(相对于6 mg·kg-1)[10]。
本试验选择大鼠作为试验动物,因为大鼠与猪类似,对铜的耐受能力很强,可作为研究日粮高铜影响猪健康的一种比较好的模型[16]。研究日粮铜水平对大鼠血清生化、肠道和肝脏组织形态及氧化还原平衡、肝脏铜代谢的影响,为后续仔猪生产中高铜饲料的评价研究奠定基础。
1 材料与方法
1.1 试验动物和日粮
动物饲养试验在南京农业大学动物科技学院动物房进行。试验选择21日龄、平均体质量71.29 g的雄性SD大鼠60只,全部饲养在可控环境的条件下,室温(25±2)℃,湿度50%~60%,12 h光照和12 h黑暗循环,自由采食和饮用去离子水。试验使用的基础日粮根据美国营养学会标准AIN-93G配制[18]。日粮中除改变铜元素的水平外,其他日粮成分完全一致。根据NRC(2012)[17]推荐仔猪饲粮中铜用量(6 mg·kg-1)、2017年11月我国农业部修订的《饲料添加剂安全使用规范》中仔猪标准饲粮中最高铜的添加量(125 mg·kg-1)及仔猪对铜的最大耐受添加量(250 mg·kg-1),按照大鼠纯化日粮标准(AIN-93G[18]推荐铜水平为5~6 mg·kg-1)设置与仔猪饲粮相似的试验日粮铜水平:6 mg·kg-1铜(对照组,C),120 mg·kg-1铜(处理组1,T1)和240 mg·kg-1铜(处理组2,T2)。大鼠试验基础日粮组成见表1。
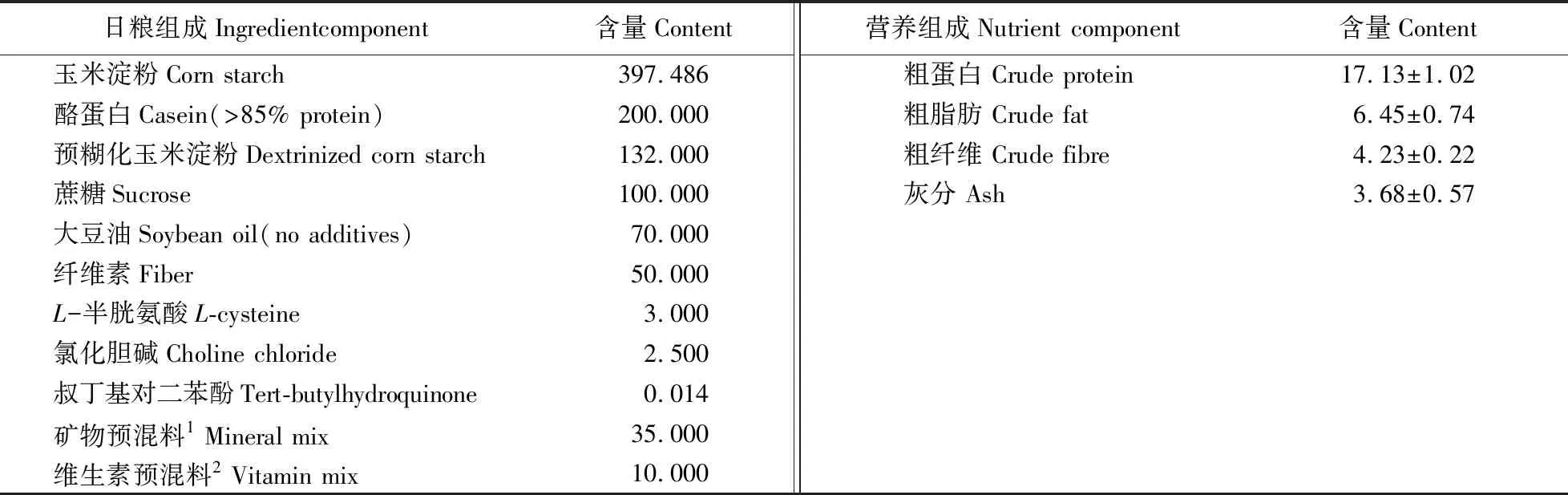
表1 大鼠试验基础日粮组成Table 1 Composition of the experimental diets of SD rats g·kg-1
1.2 试验设计
本试验采用单因素试验设计,将60只雄性、21日龄、体质量相近的SD大鼠随机分成3个处理组,每个处理组5个重复,每个重复4只大鼠。预试期7 d,预试期饲喂基础日粮的铜元素水平为6 mg·kg-1;正式试验期56 d。试验期日粮中铜以CuCO3形式添加,实测铜水平分别为7.37、134.35和253.96 mg·kg-1。
1.3 样品采集及处理
分组饲喂8周后,于大鼠85日龄时,每个处理组中随机选择10只大鼠(每个重复2只),深度麻醉后采集所需样品。全部大鼠采血前禁饲10 h,采取摘除眼球处死法,并采集血液。大鼠采集的血液装于促凝采血管中,先置于4 ℃静止,待血液凝固后,使用小型高速离心机(Thermo fisher scientific,美国)3 500 r·min-1离心10 min,分离血清,分装,保存于-80 ℃冰箱备用。采集大鼠回肠及结肠食糜样品,-20 ℃保存备用。采集全部大鼠的十二指肠、空肠、回肠和肝脏组织,部分固定于4%多聚甲醛,剩余保存于-80 ℃冰箱备用。
1.4 指标测定及方法
1.4.1 血清中相关指标测定取保存于-80 ℃冰箱中的血清,测定血清转铁蛋白、白蛋白、铜蓝蛋白、金属硫蛋白、胰岛素、胰高血糖素、瘦素、胃饥饿素、皮质酮、促肾上腺皮质激素、肿瘤坏死因子α、白细胞介素1β、白细胞介素6和白细胞介素8。所有指标试剂盒均购自南京建成生物工程研究所。计算胰岛素抵抗指数(insulin resist index,IRI):IRI=(血清胰岛素浓度×血清葡萄糖浓度)/22.5。
1.4.2 日粮、组织及食糜铜含量测定血清、肝脏组织、回肠和结肠食糜以及大鼠日粮中铜含量测定利用原子吸收分光光度法(FAAS)(Z-2 000,Hitachi,日本)。先用浓硝酸(优级纯)和高氯酸(优级纯)按体积比3∶1比例混合后配制混酸,然后取血清样品1 mL,65 ℃烘干并研磨成粉状的肝脏0.3 g,食糜0.5 g,饲料0.5 g,加入装有10 mL混酸的消解管中,过夜。次日用电热消解炉加热,温度从100 ℃升至240 ℃,加热约3 h。完全消解后,将消解液按照所需浓度用超纯水稀释[19]。精确吸取铜标准液(0.5或1 mL),用0.5 mol·L-1HNO3定容至100 mL容量瓶,充分混匀,此时标准中间液中铜含量为5或10 μg·mL-1。精确吸取5 μg·mL-1的铜标准中间液(1、2、4和8 mL),用0.5 mol·L-1HNO3定容至10 mL容量瓶,吸取10 μg·mL-1的铜标准中间液(6 mL),用0.5 mol·L-1HNO3定容至10 mL容量瓶,分别配制成0.5、1、2、4和6 μg·mL-1的铜测定标准溶液。根据仪器软件设置,设定元素的测定条件,将铜测定标准溶液依次导入原子吸收分光光度计,测定每个标准系列溶液的吸光值,每个样品重复测定3次,获得元素的标准曲线,随后将稀释后的样品消解液导入原子吸收分光光度计,根据元素的标准曲线换算样品中铜元素的含量。
1.4.3 肠道及肝脏组织形态及氧化还原指标测定取4%多聚甲醛固定24 h的大鼠十二指肠、空肠、回肠和肝脏组织,每个组织用取材刀修剪成小段,装入包埋框中,按照流程进行脱水、透明、浸蜡、包埋、切片和苏木素-伊红(HE)染色。试剂盒购于南京建成生物工程研究所,将染色完成的切片在Nikon 80i倒置显微镜下用NIS-Elements AR软件测量肠道绒毛高度和隐窝深度,计算绒毛高度/隐窝深度比。每个组织选取6张切片,每个切片选择2~3个典型视野观察。每个指标取平均值,用于统计分析。取大鼠空肠、回肠和肝脏样品,称取0.1~0.2 g,按照质量体积比1∶9加入预冷的PBS(pH7.2)缓冲液匀浆,制备成10%的组织匀浆液,9 000 r·min-1离心15 min,吸取上清液,保存于-20 ℃,用于测定组织内酶活性。分别测定各组织匀浆液中抑制羟自由基能力、蛋白质羰基、一氧化氮、丙二醛、8-羟基脱氧鸟苷水平和过氧化物酶、超氧化物歧化酶、谷胱甘肽、谷胱甘肽过氧化物酶、谷胱甘肽还原酶和氧化型谷胱甘肽活性。所有指标试剂盒购于南京建成生物工程研究所,在本实验室完成测定和各指标水平计算。
1.4.4 肝脏中铜转运相关蛋白基因mRNA表达水平测定取保存于-80 ℃冰箱中的肝脏样品0.1 g,用RNA提取试剂盒(MP Biomedicals,FastRNA®Pro Green Kit,美国)提取RNA样品,再用Nano-Drop 2 000(Nano-Drop Technologies,美国)测定RNA浓度。将已知浓度的RNA样品稀释至终浓度500 μg·μL-1,保存备用。cDNA反转录分2步进行,先去除RNA基因组的DNA,再反转录成cDNA。反应体系20 μL,试剂盒使用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)。反转后的cDNA产物于-20 ℃保存备用。实时荧光定量PCR选择SYBR®PremixExTaq(TaKaRa)采用QuantStudio 5 Real-Time PCR System(qPCR)PCR仪(Thermo Fisher,美国)。用内参基因Gapdh校正起始组织量,分别对大鼠肝脏中Ctr1、Atp7b、Ccs、Sod1、Mt1a和Cp基因mRNA表达水平进行相对定量测定。qPCR反应程序:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30~34 s,40个循环。qPCR引物序列如表2,引物序列由上海Invitrogen生物技术有限公司合成。

表2 本试验荧光定量PCR引物序列Table 2 Primer sequences for quantitative real-time PCR
1.5 数据统计与分析
2 结果与分析
2.1 日粮铜水平对大鼠血清相关指标的影响
如表3所示:日粮铜水平对大鼠血清中铜转运相关蛋白及应激相关激素水平均无显著影响(P>0.05)。与对照组(6 mg·kg-1Cu)相比,T2组(240 mg·kg-1Cu)大鼠血清中胰岛素、胃饥饿素、TNF-α水平显著升高(P<0.05)。与T1组(120 mg·kg-1Cu)相比,T2组大鼠血清中IL-6水平显著升高(P<0.05)。综上,日粮240 mg·kg-1铜影响大鼠机体糖代谢,提高血清胃饥饿素水平且促进炎症反应。
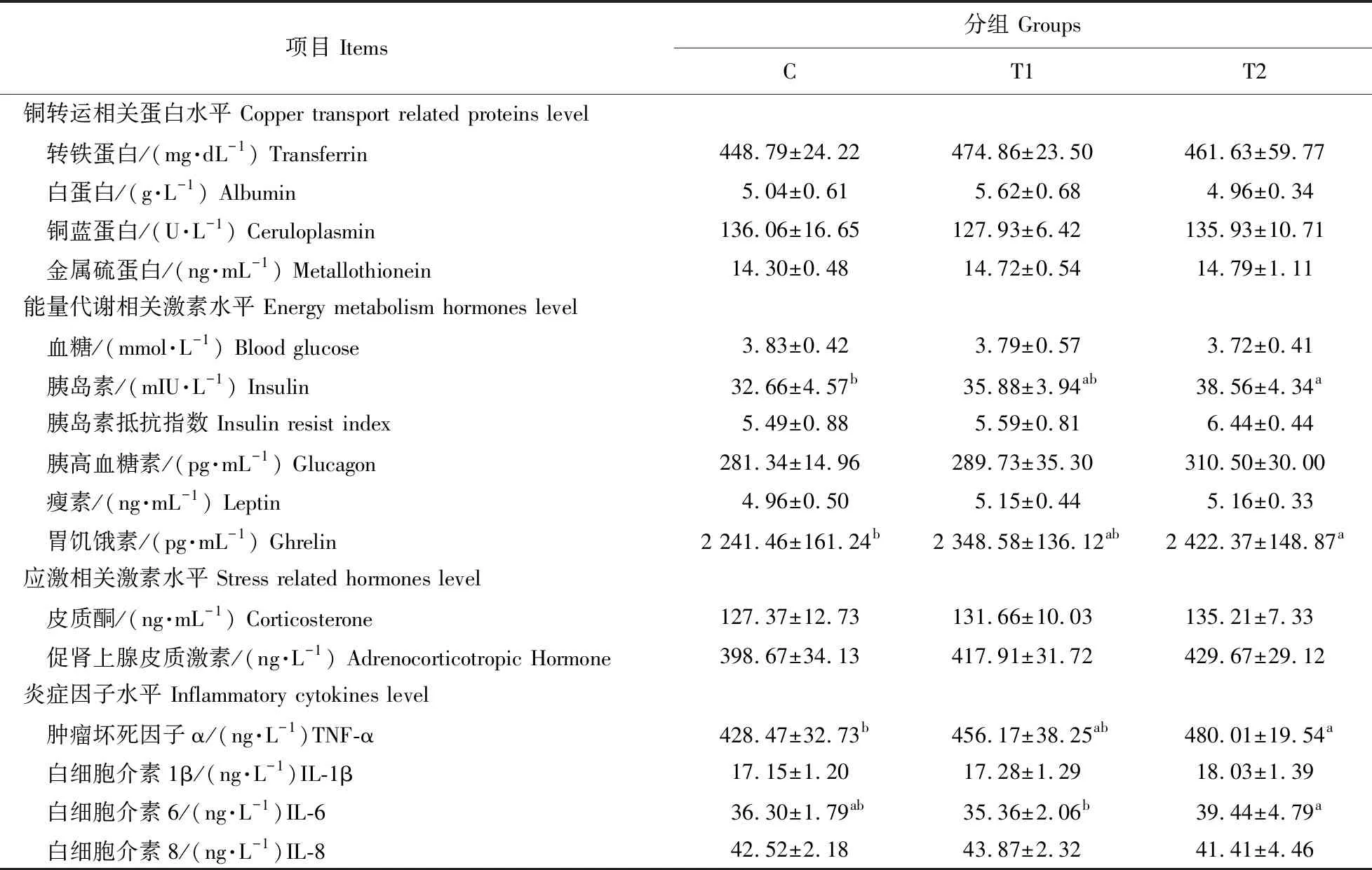
表3 日粮铜水平对大鼠血清生理生化及铜转运相关蛋白等指标的影响Table 3 Effect of dietary copper levels on serum biochemical parameters and copper transport-related proteins of SD rats
2.2 日粮铜水平对大鼠血清、肝脏和肠道食糜铜含量的影响
如表4所示:与对照组相比,T1及T2组大鼠回肠和结肠食糜中铜含量极显著提高(P<0.01)。但日粮铜水平对大鼠血清及肝脏组织中铜含量无显著影响(P>0.05)。综上,采食高铜日粮的大鼠血清及肝脏中铜含量保持稳定,但回肠和结肠食糜中的铜显著积累。
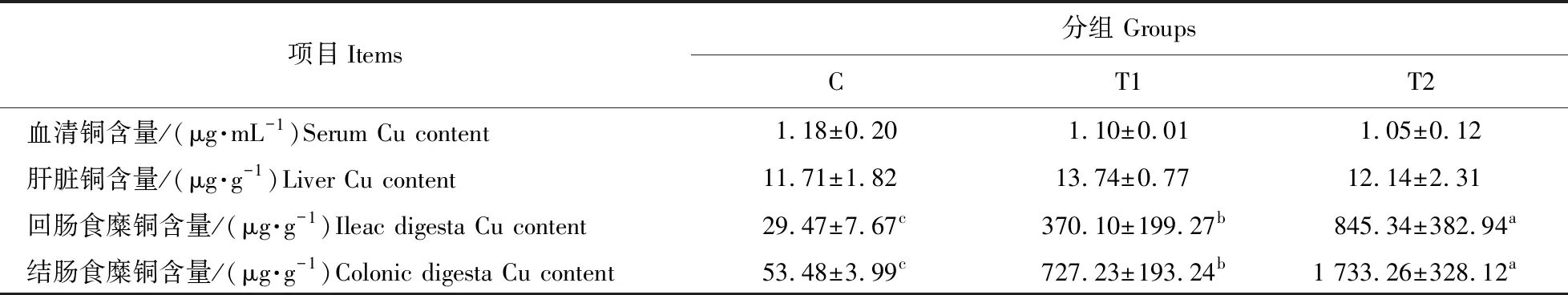
表4 日粮铜水平对大鼠血清、肝脏及肠道食糜铜含量的影响Table 4 Effects of dietary copper levels on the copper content of serum,liver and intestinal digesta in rats
2.3 日粮铜水平对大鼠小肠及肝脏形态的影响
如图1所示:相对于对照组,T1和T2组大鼠回肠绒毛高度显著降低(P<0.05),日粮铜水平对十二指肠和空肠绒毛高度无显著影响(P>0.05)。与对照组和T2组相比,T1组大鼠十二指肠隐窝深度存在降低趋势(P=0.09),T2组大鼠回肠隐窝深度相对于对照和T1组极显著降低(P<0.01),日粮铜水平对空肠隐窝深度无显著影响(P>0.05)。与对照和T2组相比,T1组大鼠十二指肠绒隐比呈现升高趋势(P=0.06),回肠的绒隐比值显著降低(P<0.05),日粮铜水平对大鼠空肠绒隐比无显著影响(P>0.05)。综上,日粮中120和240 mg·kg-1铜均引起了大鼠回肠组织的损伤。
如图2所示:对照组大鼠肝脏细胞结构完整,轮廓清晰,细胞核大且呈圆形。T1组大鼠肝脏细胞结构轻度破坏,细胞间隙变大。T2组大鼠肝脏细胞排列不规则,细胞浆浑浊,细胞核小,细胞间隙变大且出现空洞。综上,日粮中120和240 mg·kg-1铜引起大鼠肝脏组织损伤。
2.4 日粮铜水平对大鼠肝脏、空肠和回肠组织氧化标记物和抗氧化酶活性的影响
如表5所示:日粮铜水平对大鼠空肠、回肠及肝脏组织抑制羟自由基能力(inhibiting hyderoxyl raica)、蛋白质羰基(protein carbonyl)、丙二醛(MDA)及8-羟基脱氧鸟苷(8-OH-dG)等氧化标记物水平均无显著影响(P>0.05),但对空肠及回肠组织中NO水平有显著影响。与对照组相比,T1和T2组大鼠空肠和回肠组织中NO水平显著降低(P<0.05)。综上,日粮铜水平未影响大鼠空肠、回肠及肝脏组织脂质氧化及蛋白质氧化。
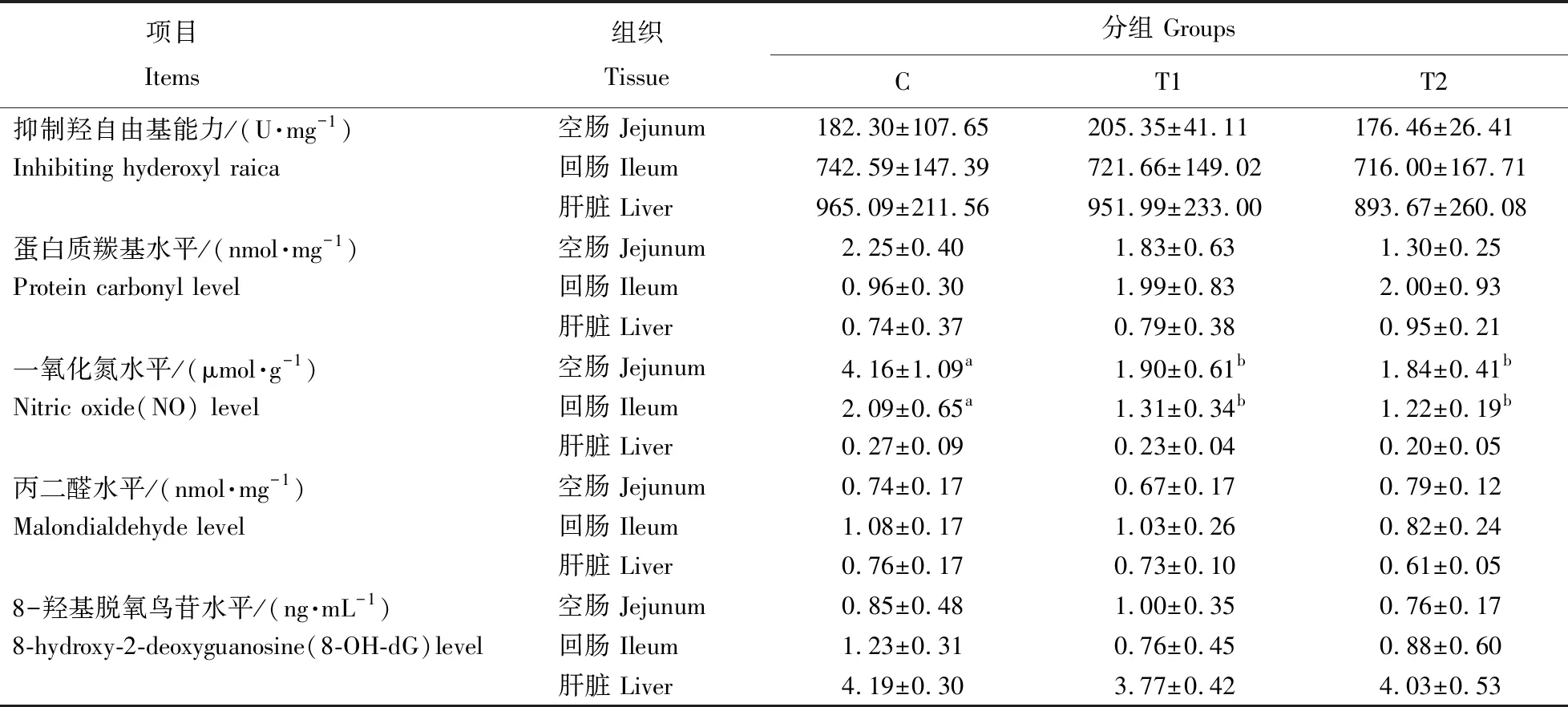
表5 日粮铜水平对大鼠空肠、回肠及肝脏组织氧化标记物水平的影响Table 5 Effects of dietary copper levels on the oxidative biomarkers of jejunum,ileum and liver in rats
如表6所示:日粮铜水平对大鼠空肠、回肠和肝脏组织中过氧化氢酶(CAT)、谷胱甘肽(GSH)及谷胱甘肽还原酶(GR)活性均无显著影响(P>0.05)。与对照组相比,T1和T2处理组大鼠肝脏中超氧化物歧化酶(SOD)及谷胱甘肽过氧化物酶(GSH-px)活性显著升高(P<0.05),大鼠回肠组织中超氧化物歧化酶(SOD)活性显著降低(P<0.05)。与对照组相比,T2组大鼠肝脏中锰-超氧化物歧化酶(Mn-SOD)活性显著升高(P<0.05);T1组大鼠空肠和肝脏组织中氧化型谷胱甘肽(GSSG)活性显著升高(P<0.05)。与对照组和T2组相比,T1组大鼠肝脏中铜锌-超氧化物歧化酶(CuZn-SOD)活性显著升高(P<0.05)。综上,日粮中120和240 mg·kg-1铜降低大鼠回肠组织抗氧化能力。
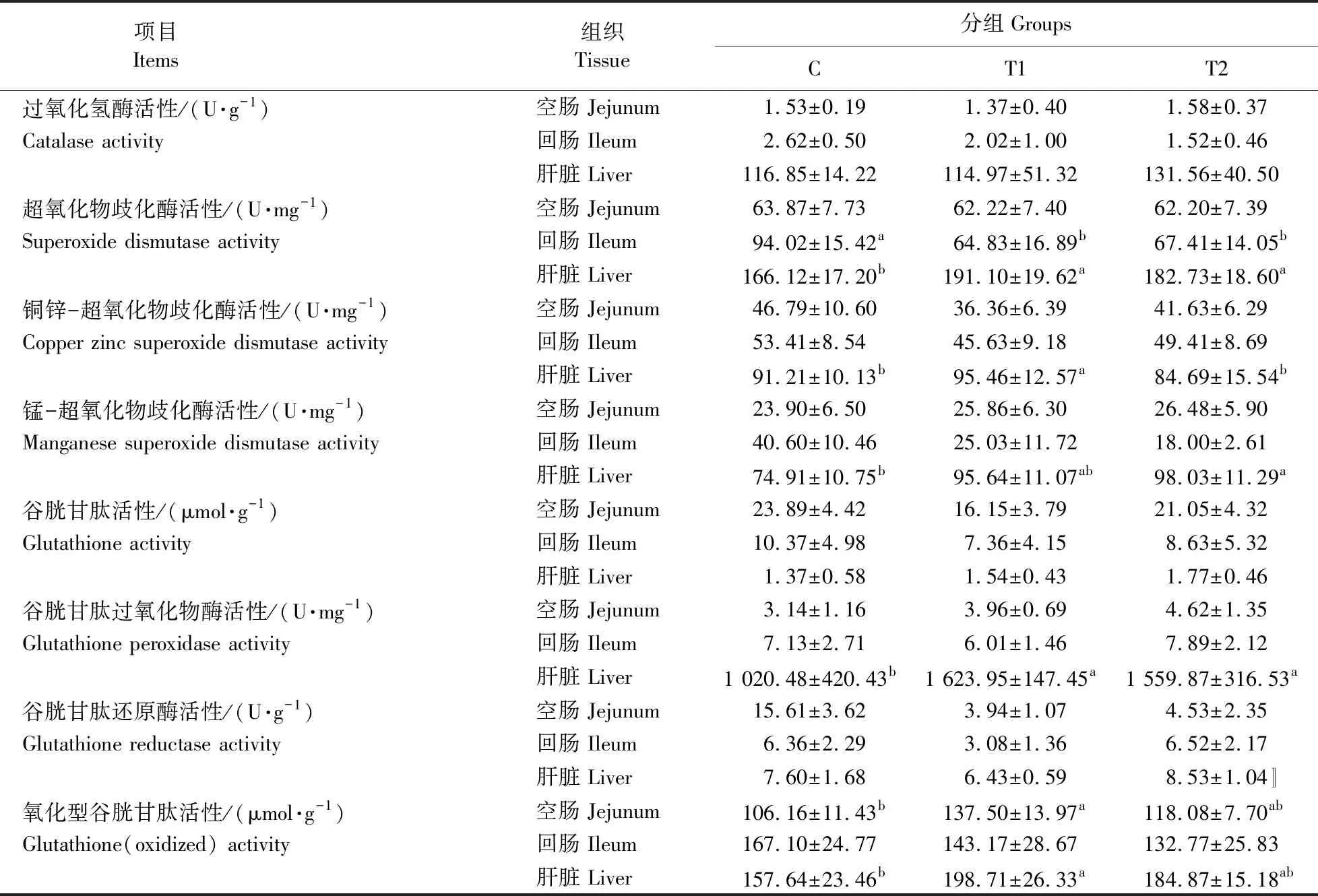
表6 日粮铜水平对大鼠空肠、回肠及肝脏组织抗氧化酶活性的影响Table 6 Effects of dietary copper levels on the antioxidant enzymes of jejunum,ileum and liver in rats
2.5 日粮铜水平对大鼠肝脏铜转运相关蛋白基因mRNA表达水平的影响
如图3所示:日粮铜水平对P型ATP酶基因(Atp7b)mRNA表达水平无显著影响(P>0.05)。与对照组和T1组相比,T2组大鼠肝脏中铜转运蛋白基因(Ctr1)mRNA表达水平显著下调(P<0.05)。与对照和T2组相比,T1组大鼠肝脏中铜锌超氧化物歧化酶基因(Sod1)、金属硫蛋白基因(Mt1a)和铜蓝蛋白基因(Cp)基因mRNA表达水平显著上调(P<0.05),铜锌超氧化物歧化酶伴侣蛋白基因(Ccs)mRNA表达水平存在上调的趋势(P=0.09)。与T2组相比,T1组大鼠肝脏中Sod1、Mt1a和Cp基因mRNA表达水平显著上调(P<0.05)。综上,采食120和240 mg·kg-1铜日粮大鼠肝脏中铜转运能力显著下降,采食120 mg·kg-1铜日粮大鼠肝脏铜的代谢能力显著提高。
2.6 大鼠肠道食糜铜含量与血清炎症因子、肠道组织氧化标记物及抗氧化酶之间相关性分析
如表7所示:血清中铜含量与炎症因子、肠道组织氧化标记物及抗氧化酶水平之间均无相关性(P>0.05)。大鼠血清肿瘤坏死因子α(TNF-α)水平与回、结肠食糜铜含量显著正相关(P<0.05),大鼠空肠组织中NO水平与回、结肠食糜铜含量显著负相关(P<0.05)。大鼠回肠组织中NO和SOD活性与其食糜铜含量显著负相关(P<0.05)。综上,大鼠肠道食糜中积累的铜影响大鼠炎症反应及回肠组织氧化还原反应。

表7 大鼠肠道食糜铜含量与血清炎症因子、组织氧化标记物及抗氧化酶间的相关性Table 7 Correlation between copper content with serum inflammatory cytokines,intestinal oxidative biomarks
2.7 大鼠肝脏及肠道食糜铜含量与血清炎症因子、肝脏铜转运相关蛋白mRNA水平、氧化标记物及抗氧化酶水平间相关性分析
如表8所示:肝脏铜含量与血清IL-6水平显著负相关(P<0.05),与肝脏Ccs和Cp基因的mRNA表达水平显著正相关(P<0.05),与肝脏SOD活性显著正相关(P<0.05),与CuZn-SOD活性极显著正相关(P<0.01)。回肠食糜铜水平与肝脏GSH-px活性显著正相关(P<0.05)。综上,大鼠肝脏中铜含量影响其铜代谢及抗氧化能力。

表8 大鼠肝脏及肠道食糜铜水平与血清炎症因子、肝脏组织铜转运蛋白mRNA水平、氧化标记物及抗氧化酶的相关性
3 讨论
大鼠的血糖水平主要由胰高血糖素和胰岛素调节[20],胰高血糖素通过抑制糖酵解、激活肝脏糖原分解和糖异生提高血糖水平[21],胰岛素则促进葡萄糖分解和糖原合成而降低血糖水平[22]。本试验中,T1和T2组大鼠血清中胰高血糖素和胰岛素水平及胰岛素抵抗指数存在增加趋势,表明日粮中120和240 mg·kg-1铜一定程度上会影响大鼠机体糖代谢的平衡。有研究报道日粮中的高铜可促进动物的采食量[23]。本试验中,与对照组相比,T2组大鼠血清中胃饥饿素水平显著升高,胃饥饿素可通过诱导食欲和控制能量消耗,在摄食调控中起关键作用[24],提示,240 mg·kg-1日粮铜通过提高大鼠血清胃饥饿素水平进而提高采食量,与本课题组报道的相同试验条件下大鼠前4周采食量提高的结果相一致[25]。有报道,长期摄入高铜不影响人血浆中TNF-α及IL-6的水平[26]。本试验中,T2组大鼠TNF-α水平显著高于对照组,IL-6水平显著高于T1组,提示,240 mg·kg-1日粮铜诱导促炎细胞因子(例如TNF-α和IL-6等)释放[20,27]。因此,240 mg·kg-1日粮铜影响大鼠糖代谢平衡并促进机体炎症反应,对大鼠健康不利。
本试验中,随着日粮铜水平的提高和高铜日粮采食时间的延长,血清中铜含量相对稳定,与铜转运相关蛋白水平也均未发生显著变化,提示,大鼠机体内的铜代谢稳态并未受到日粮铜水平的显著影响。大鼠肝脏铜含量可代表机体铜营养状态[28],大鼠持续2周口服40 mg·kg-1·d-1铜或按体质量皮下注射20 mg·kg-1·d-1铜均会显著增加肝脏中铜含量[29],但在本试验中,日粮铜水平对大鼠肝脏铜含量无显著影响,并且对照组大鼠肝脏组织中铜含量已经超过10 μg·g-1(平均11.71 μg·g-1),足以维持肝脏的正常功能[28],提示,动物肝脏组织会对高铜产生耐受,维持铜稳态[8,17]。本试验同时测定了大鼠回肠和结肠食糜中铜的含量,结果表明,T1组大鼠回、结肠食糜中铜含量比对照组提高了约12倍,T2组大鼠则提高了约30倍,提示,大鼠对日粮无机铜的吸收率低,主要滞留于肠道,并通过粪便排出体外。动物吸收及代谢利用后多余的元素,在肠腔食糜中累积,并经粪便和尿液排泄[30],通过控制吸收和增加排泄等措施维持体内的元素平衡[8],这对维持非反刍动物的机体稳态意义尤其显著[16]。
动物体内铜元素主要是通过十二指肠和空肠上端从日粮中吸收获得[31]。本试验中,小肠组织形态结果表明,T1和T2组大鼠回肠绒毛高度与对照组相比显著降低,绒毛变短,成熟的绒毛细胞减少,吸收面积和吸收能力降低[32-33],提示,120 和240 mg·kg-1日粮铜均降低了大鼠回肠组织的吸收能力;T2组(240 mg·kg-1)大鼠回肠绒毛高度和隐窝深度虽显著降低,但其比值与对照组相当,T1组(120 mg·kg-1)中回肠绒毛高度显著降低的同时绒隐比也显著降低,绒隐比值下降,隐窝变深,肠黏膜受损、更新速度加快。提示,高铜日粮(120 和240 mg·kg-1)均引起了大鼠回肠的损伤,120 mg·kg-1高铜日粮引起的损伤尚能通过隐窝细胞的分化、迁移得到修复,240 mg·kg-1高铜日粮在降低绒毛高度的同时也降低隐窝深度,隐窝细胞的分化能力也可能受到抑制,损伤更严重。尽管大鼠肝脏组织中铜含量保持较稳定的状态,但本试验结果表明,T1和T2组大鼠肝脏组织出现较明显的结构破坏,肝脏细胞出现胞浆浑浊以及细胞间隙变大等变化,表明日粮中120 和240 mg·kg-1铜水平对肝脏组织产生一定程度上的损伤。
高铜可催化活性羟自由基的形成,并通过Fenton和Haber-Weiss化学反应催化产生活性氧(ROS)[6,13,29],因此肠道内铜元素的积累,可能引起肠道组织氧化还原状态的改变。本试验中高铜日粮使大鼠回肠食糜中铜含量极显著增加,与对照组相比T1和T2组大鼠回肠组织中GSH水平存在降低的趋势,SOD水平显著降低,且回肠食糜铜含量与回肠组织SOD水平存在显著负相关。GSH是非酶性抗氧化因子,通过与铜螯合使其无法催化ROS的产生,并作为几种酶的配基清除机体中产生的ROS[34],SOD是主要的酶性抗氧化因子[35],也是抵抗氧化应激的第一道防线[36]。提示,120和240 mg·kg-1日粮铜引起的大鼠回肠食糜铜积累,显著打破回肠组织氧化还原平衡状态,降低大鼠回肠组织的抗氧化能力,加剧ROS对机体的影响[6]。机体无法保持ROS产生和清除之间的平衡就会发生炎症反应,因此炎症又被认为是由氧化应激引起的一种生化反应[37]。本试验中,大鼠回肠食糜铜含量与血清中TNF-α水平呈显著正相关,提示,回肠食糜中显著积累的铜元素,通过诱导氧化应激引起大鼠机体的炎症反应。
肝脏中铜离子在Cu+和Cu2+之间的转换,可诱导ROS的产生[13,29,38],ROS的产生会导致脂质过氧化及一些特定蛋白的氧化分解,导致蛋白质羰基、MDA等重要氧化标记物水平的变化[39]。Ozcelik等[14]报道大鼠通过饮水方式持续4周摄入100 μg·mL-1铜,肝脏中MDA水平存在升高的趋势。本试验中,长期摄入120和240 mg·kg-1日粮铜引起大鼠肝脏的形态学损伤,但蛋白质羰基、MDA及8-OH-dG等氧化标记物水平均无显著影响,却引起大鼠肝脏SOD和Mn-SOD活性显著升高;相关性分析表明,大鼠肝脏铜含量与肝脏SOD活性显著正相关,与肝脏CuZn-SOD活性极显著正相关,提示,大鼠肝脏对抗铜的氧化损伤主要由SOD系统完成。
CuZn-SOD由Sod1基因编码[40],SOD1蛋白产生活性的关键是肝细胞中铜的水平以及负责将铜插入SOD1的CCS蛋白水平[41]。本研究中,120 mg·kg-1日粮铜上调大鼠肝脏中Ccs基因和Sod1基因表达水平,从mRNA水平解释120 mg·kg-1日粮铜引起的肝脏CuZn-SOD水平的变化,提示,大鼠持续采食120 mg·kg-1铜水平日粮时,可通过调控自身的氧化还原平衡加以适应,因此该处理组大鼠肝脏切片显示的损伤也相对较小。本试验中,T2处理组大鼠肝脏中Ctr1基因mRNA表达水平与其他两组相比显著下调,CTR1是具有高亲和力的铜转运蛋白,也是肝脏铜吸收的主要途径[5],Nose等[42]最先报道了在猪十二指肠中铜含量对Ctr1基因表达量的影响,高铜刺激CTR1蛋白内吞作用以及潜在的降解,本试验结果与其相一致,提示,240 mg·kg-1日粮铜通过下调大鼠肝脏中Ctr1基因表达,降低CTR1蛋白水平,减少肝细胞对铜离子的摄取,使得大鼠虽长时间摄入高铜日粮,但其肝脏中铜含量仍然维持在较低和稳定的状态。肝细胞内的铜主要通过胆汁排出肝脏,这一过程主要依赖于转运蛋白ATP7B,ATP7B将铜转运至肝脏中的CP蛋白分泌入胆汁,帮助维持肝细胞中的铜稳态[9]。Bauerly等[43]报道随着日粮中铜水平增加,幼年大鼠肝脏中Atp7b基因mRNA表达水平上调,但在本试验中,日粮铜水平对大鼠肝脏中Atp7b基因mRNA表达不存在显著影响,可能是因为本试验中大鼠肝脏中铜含量未受日粮铜水平的影响,120 mg·kg-1日粮铜下调肝细胞中Ctr1基因表达,上调Cp和Mt1a基因mRNA表达进而维持肝脏铜水平的稳态。大鼠肝脏铜含量与Cp基因表达显著正相关,也说明CP蛋白在维持肝细胞铜稳态中的积极作用。
综上所述,大鼠持续摄入120和240 mg·kg-1铜水平日粮,食糜铜积累,回肠组织出现损伤,回肠抗氧化能力下降,氧化还原平衡被打破,引起大鼠机体的炎症反应;120 mg·kg-1铜日粮显著上调大鼠肝脏组织中Mt1a和Cp基因表达水平,CuZn-SOD活性显著升高,提高大鼠肝脏对日粮铜的适应性和耐受性,维持肝细胞内铜的稳态;240 mg·kg-1铜日粮除了能下调大鼠肝脏Ctr1基因的表达外,不能通过其他适应性的基因表达调控来提高肝细胞对高铜的耐受性,因此肝细胞的形态学损伤较严重。
