碳/金纳米电极制备及其对丁基黄药的测定
2020-07-27冯俊燕钱功明徐作行程翔宇丰明佳
冯俊燕,钱功明*,2,徐作行,程翔宇,丰明佳
(1.武汉科技大学资源与环境工程学院,湖北武汉 430081; 2.冶金矿产资源高效利用与造块湖北省重点实验室,湖北武汉 430081)
电化学传感器因其具有现场、实时、在线检测、灵敏度高、易微型化等优点,成为目前研究的热点。而纳米微电极作为纳米级尺寸的电化学传感器,由于其具备传质速率快、电流密度高及信噪比高[1 - 5]等优良特性而被广泛应用于分析检测领域。
丁基黄药作为一种常用的矿业药剂,其常用检测方法有铜试剂亚铜分光光度法[6]、气相色谱-质谱法[7,8]、流动注射法[9]、液相色谱法[10,11]和离子色谱法[12]等。目前国内多采用紫外分光光度法测定丁基黄药,但方法存在检测周期长,干扰多,步骤繁琐,误差大的缺点。而电化学传感器则因其检测迅速,操作便捷,灵敏度高的特点而在检测领域广受关注,但同时在矿业领域关于使用纳米微电极分析检测黄药的报道较少。针对这一现象,本文进行了电化学传感器在矿业药剂检测领域的尝试,制备全新的纳米微电极对丁基黄药进行了分析检测,为测定该药提供了新方法新思路。
1 实验部分
1.1 仪器及试剂
P-2000激光拉制仪、θ型石英毛细管(美国,sutter instrument公司);CHI 600E电化学工作站(上海辰华仪器设备有限公司)。
30%H2O2(分析纯,上海沃凯生物技术有限公司),H2SO4(分析纯,西陇化工股份有限公司),高纯N2,丁烷,HAuCl4·4H2O(>99.9%,阿拉丁),羟甲基二茂铁(>95%,阿拉丁),丁基黄药(C4H9OCSSNa)(>95%,深圳市思美泉生物科技有限公司)。超纯水。
1.2 实验方法
1.2.1 碳/金纳米电极的制备首先利用丁烷高温裂解出碳纳米颗粒沉积在石英毛细管内得到碳纳米电极[13]。然后,以该电极为工作电极,Ag/AgCl为参比电极,Pt丝电极为辅助电极,组成三电极体系,在0.5 mmol/L HAuCl4溶液中,采用循环伏安法(CV),以扫速为50 mV/s连续循环扫描多次得到碳/金纳米电极。
1.2.2 电极表征和电化学分析测试采用扫描电镜(SEM)进行纳米电极形貌分析,并用电化学方法对其进行了电化学性能测试,以及对丁基黄药的电催化作用和电化学响应。电化学实验采用三电极体系,实验中均用高纯N2气进行除氧。通过电化学工作站使用该电极对丁基黄药(C4H9OCSSNa)进行电化学测试:(1)以CV法测试pH为5、6、7、8、9、10的0.1 g/L的黄药溶液;(2)在电位0.75 V,以计时电流法在100 mL 0.1 mol/L的KCl溶液中,每隔一段时间加入0.1 mL 1 g/L丁基黄药溶液进行测试(期间持续充入高纯N2气保护,并起到搅拌混匀作用)。
2 结果与讨论
2.1 碳纳米微电极的形貌特征
图1是碳纳米电极尖端的扫描电镜(SEM)图以及实物放大图。从图1(A)可以看出碳纳米颗粒已经完全填实了石英纳米管的一侧孔道,形成了碳纳米电极。另外由图1(B)可看出在整个石英管内壁上都有均匀附着致密的碳层,有效保证了电极的导通。

图1 碳纳米电极扫描电镜(SEM)图(A)以及电极实物放大图(B)Fig.1 SEM image of carbon nanoelectrode (A) and magnified view of carbon nanoelectrode(B)
2.2 纳米电极的电化学性能表征
图2是0.5 mmol/L的羟甲基二茂铁(FcMeOH)在碳纳米电极上的伏安响应曲线。从图2中可以看出,该电极在电位0.45 V以后,由于离子扩散的速度达到极限从而电流无法再次增大,而出现氧化稳态电流平台,这是比较明显的超微电极特征[13]。

图2 0.5 mmol/L FcMeOH在碳纳米电极上的伏安响应曲线Fig.2 Voltammetric response curve of 0.5 mmol/L FcMeOH on carbon nanoelectrodes
图3(a)为碳纳米电极在0.5 mmol/L HAuCl4溶液中的循环伏安曲线。可以看出在镀金实验过程中随镀金次数的增加电流在逐渐增大,这说明在该电极附近离子扩散速度不变的情况下,电极面积在随着实验的进行不断提升,将使得该电极的信噪比得到提升。图3(b)是0.5 mmol/L的FcMeOH在碳/金纳米电极上的循环伏安曲线。可知,该碳/金电极同样具有明显的纳米电极特征,说明该电极在镀金过程中虽然电极面积增大,但并未破坏其纳米电极的特性,变为宏观电极。且与碳纳米电极(图2)相比,氧化稳态电流信号有显著的增加,这说明碳/金纳米电极面积显著大于碳纳米电极,同时提高了该电极的信噪比。其原因是金的沉积使纳米电极的电极面积变大。

图3 碳电极在镀金过程中的电化学信号及制备完成后的循环伏安(CV)测试图Fig.3 Electrochemical signal of carbon electrode in gold plating process and CV test chart after preparation a.Electrochemical signal during gold plating;b.CV image measured by FcMeOH solution.
2.3 碳/金纳米电极对丁基黄药的电化学响应
溶液pH和丁基黄药浓度对碳/金纳米电极的电化学响应的影响如图4。从图4中可以看出,随着pH的增大,测得的氧化峰电流越来越大。这是由于丁基黄药在水中易解离出黄原酸根,黄原酸根水解可生成黄原酸[14],pH越高弱酸黄原酸的产生也就越少,电流峰值也就会越高。同时由于过低的pH会使黄原酸迅速分解,使得黄药含量减少,从而降低电流峰值。
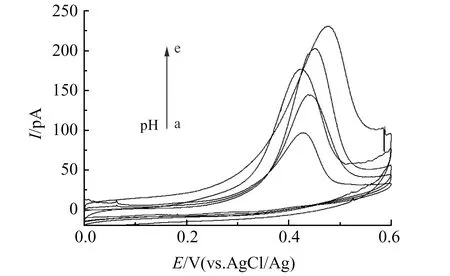
图4 黄药溶液pH对测定结果的影响Fig.4 Effect of pH of xanthate solution on determination resultspH(a-e):5,6,7,8,9.
图5为0.1 mol/L KCl溶液中丁基黄药在碳/金纳米电极上的计时电流响应曲线,外加电位0.75 V。从图5可以看出,该电极对黄药的响应为具有能斯特响应,电流信号与黄药浓度呈线性相关关系,浓度-电信号线性回归方程为:y(pA)=129.999x-46.244,响应斜率1.299×10-4A/(g·L-1),线性相关系数为0.997,检测限(S/N=3)为2.7×10-6g/L。低于国家标准(GB 3838-2002)中规定地表水源中丁基黄原酸盐的限量值5.0×10-6g/L要求。同时与常规的分光光度法[15]、离子色谱法[12]和原子吸收法[18]相比,本方法的检测限与其相当,但检测速度更快,取样少,易于实现在线实时检测。

图5 计时电流法测定不同浓度的黄药溶液的结果及其线性回归拟合Fig.5 The chronoamperometry method for the determination of different concentrations in xanthate solution and concentration-current linear regression fitting resultsinsert:Concentration-current linear regression fitting results.
3 结论
本文利用热沉积法制备了碳纳米微电极,并通过电沉积法制备了表面镀金的碳纳米微电极。将该电极运用在丁基黄药的测定中,为黄药的测定提供给了新方法新思路。在丁基黄药溶液中,在pH=7的条件下,该电极的催化氧化电流与丁基黄药浓度在1.0×10-4~1.0×10-1g/L的范围内呈良好的线性关系,检测限为2.7×10-6g/L。相较于其他传统检测方法,本方法同样具有较低的检测限。该电极仅利用了θ型电极的一侧就具有了良好的检测性能,对另一侧孔运用分子修饰,镀层沉积等手段制备复合纳米微电极探针对黄药的检测分析来说,具有更加重大意义。同时,两侧不同的复合电极之间的相互配合也会使探针的检测的耐用性、选择性、灵敏度得到极大提升。
