低剂量CT扫描联合血清胃泌素释放肽前体、神经元特异性烯醇化酶检测对小细胞肺癌的诊断价值
2020-07-27贾祯刘志广姚菁菁刘红春
贾祯 刘志广 姚菁菁 刘红春
1新乡市中心医院(河南新乡453000);2郑州大学(郑州450000)
肺癌为我国高发病率、高病死率恶性肿瘤之一,且随着生活环境的变化及社会压力的增加其发病率呈上升趋势[1],严重威胁人类生命。肺癌根据生物学行为差异可划分为小细胞肺癌(small cell lung cancer,SCLC)及非小细胞肺癌(non small cell lung cancer,NSCLC),其中SCLC 约占肺癌15%~20%[2]。由于SCLC早期患者通常无自觉症状,在确诊时仅30%左右,处于局限期[3],其余已进入广泛期,错失手术时机,仅能采取姑息治疗,预后较差。因此,早期确诊对于改善SCLC 预后意义重大。血清肿瘤标志物如胃泌素释放肽前体(pro-gastrinreleasing peptide,Pro-GRP)、神经元特异性烯醇化酶(neuron specific enolase,NSE)等在健康机体中含量极微,或在肿瘤组织中水平显著高于健康组织,故通过检测其水平可为恶性肿瘤诊断提供参考,但单一标志物检测特异度、灵敏度等并不理想。随着影像学技术的发展,CT 扫描因操作简单、快捷及扫描效果好等优势在肿瘤诊断方面的价值日益受到关注,已有学者将其用于恶性肿瘤、支气管疾病等的诊断中[4-5],且获取满意效果。但临床鲜有关于低剂量CT(low dose computed tomography,LDCT)扫描与实验室指标血清Pro-GRP、NSE 联合检测对SCLC 诊断价值的报道。故本研究选取103 例高度怀疑为SCLC 的患者,分析LDCT扫描与血清Pro-GRP、NSE 联合检测对该病的诊断价值,以期为该病诊断提供参考,现报告如下。
1 资料与方法
1.1 一般资料选取2017年8月至2019年8月本院103 例高度怀疑为SCLC 的患者,根据病理诊断结果将其设置为SCLC 组、非SCLC 组。另选取52 例同时期本院体检健康受试者,将其设置为正常组。3 组临床资料比较,差异均无统计学意义(P>0.05)。见表1。纳入标准:(1)正常组经体检机体各项指标正常;(2)103 例高度怀疑为SCLC 患者均以血痰、咳嗽及胸痛等为主要症状,无明显神经系统症状与主诉,影像学检查提示肺门/主支气管占位,年龄>40 岁,且至少符合以下1 项:①存在吸烟史,且每年多于20 包,或戒烟时间短于15年;②长时间被动吸烟;③存在氡、铀、石棉等职业暴露史长于2年;④弥漫性肺纤维化史等肺部疾病史;⑤恶性肿瘤家族史。排除标准:(1)CT 检查禁忌症;(2)NSCLC 患者;(3)主要器官严重功能不全;(4)肺部手术史;(5)肺部结节表现为索条状或钙化;(6)胸膜结节患者;(7)其他部位肿瘤肺部转移。医院伦理委员会已批准本研究,受试者均对研究内容知情同意。
1.2 方法
1.2.1 临床资料收集统计3 组临床资料,包括性别、年龄、体质量指数(body mass index,BMI)、吸烟史(>10年)、饮酒史(>10年)。
1.2.2 SCLC 确诊方式以《肺癌综合诊治规范化手册》为诊断依据[6]。阳性诊断标准:镜下细胞学涂片显示癌细胞并分型者确诊为SCLC,未观察到癌细胞者为肺良性病变。
1.2.3 LDCT 检查采用Somatom Sensation CT 扫描仪(德国SIEMENS股份公司)及其配套系统诊断:设置仪器参数为管电压120 kV,管电流40 mAs,层厚与螺距均为5 mm。叮嘱患者放松全身,缓慢屏气,扫描范围为肺尖至肺底,采用纵隔窗与肺窗摄片。纵隔窗:窗宽=500 HU,窗位:50 HU;肺窗:窗宽=1500 HU,窗位:-700 ~-600 HU。以病灶最大中心封面为扫描区域,针对病灶与可疑层面加用2 ~5 mm 薄层CT(外标法)或高分辨率CT 扫描。在患者屏气时完成扫描工作,时间约为20 s。由2位放射科医生对影像学结果进行确认,采用图像处理工作站处理图像。SCLC 确诊标准:发现≥1 个直径5 mm 以上的实性或部分实性非钙化结节,或发现直径8 mm 以上的非实性无钙化结节[7]。
1.2.4 血清Pro-GRP、NSE 水平检测于所有受试者空腹状态收集其4 mL 肘部静脉血,自然分层后经2 500 r/min 离心15 min,收集上清液。采用化学发光法检测血清Pro-GRP 水平,选用APNA 370化学发光分析仪(日本HORIBA 制作所)操作;采用酶联免疫法检测血清NSE 水平,选用NSE 酶联免疫试剂盒(购自上海源叶生物科技有限公司)操作,按照试剂盒说明书设计流程。
1.3 研究指标(1)正常组、非SCLC 组、SCLC 组临床资料;(2)诊断结果;(3)LDCT 结果;(4)正常组、非SCLC 组、SCLC 组血清Pro-GRP、NSE 水平比较;(5)LDCT、血清Pro-GRP、NSE 单独与联合诊断SCLC 的价值
1.4 统计学方法以统计学软件SPSS 26.0 对数据进行分析,计数资料以例(%)表示,采用χ2检验;计量资料以()表示,采用t检验;多样本计量资料采用单因素方差分析检验,进一步两两比较采用SNK-q 检验。采用Med Calc 9.3.0 对工作曲线(receiver operating curve,ROC)进行绘制,并计算曲线下面积(area under curve,AUC),AUC>0.5提示该模型对SCLC 有诊断价值,且该值越大,诊断价值越高。P<0.05 差异有统计学意义。
2 结果
2.1 正常组、非SCLC 组、SCLC 组临床资料比较3 组性别、年龄、BMI、吸烟史、饮酒史临床资料比较,差异均无统计学意义(P>0.05)。见表1。
2.2 诊断结果103 例高度怀疑为SCLC 的患者49 例经病理诊断确诊,构成比为47.57%,将其设置为SCLC 组;其余54 例为肺良性病变,构成比为52.43%,其中肺炎24 例,肺结核20 例,肺血管平滑肌瘤6 例,支气管囊肿4 例,将其设置为非SCLC 组。

表1 3 组临床资料比较Tab.1 Comparison of clinical data of the three groups 例(%)
2.3 LDCT 结果103 例高度怀疑为SCLC 患者均经LDCT 检查,23 例表现为毛刺征、分叶征、胸膜凹陷征,增强扫描后强化指征>20 HU;25 例病灶已累及到叶支气管,支气管表现为狭窄、僵硬、黏膜粗糙,伴有腔内结节及软组织肿块,且伴强化、阻塞性肺不张、阻塞性肺炎、阻塞性肺气肿征象,共计48 例确诊为SCLC。
2.4 正常组、非SCLC组、SCLC组血清Pro-GRP、NSE 水平比较3 组血清Pro-GRP、NSE 水平比较差异有统计学意义(P<0.05);SCLC 组血清Pro-GRP、NSE 水平均高于非SCLC 组、正常组,非SCLC组均高于正常组,差异均有统计学意义(P<0.05)。见表2。
2.5 LDCT、血清Pro-GRP、NSE 单独与联合诊断SCLC的价值ROC结果显示,血清Pro-GRP、NSE诊断周围型NSCLC的最佳截断点分别为76.13 pg/mL、18.54 ng/mL;LDCT、血清Pro-GRP、NSE 单独诊断SCLC 的AUC 分别为0.762、0.687、0.593,三者联合诊断的AUC 为0.813。见表3、图1。
表2 3 组血清Pro-GRP、NSE 水平比较Tab.2 Comparison of serum Pro-GRP and NSE levels in the three groups ±s
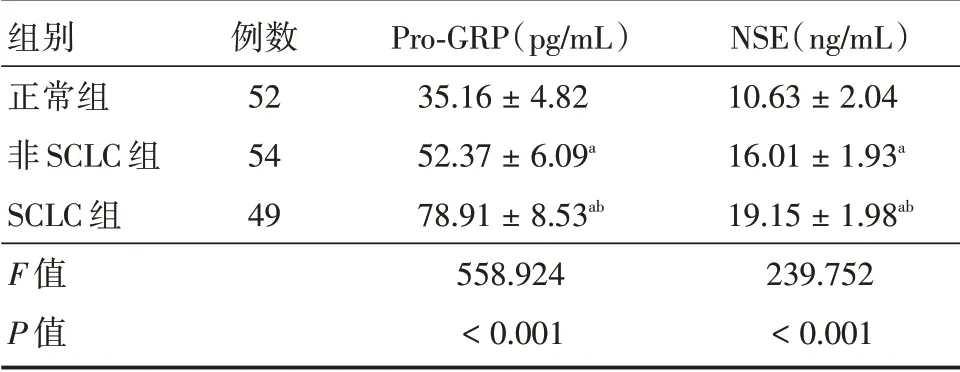
表2 3 组血清Pro-GRP、NSE 水平比较Tab.2 Comparison of serum Pro-GRP and NSE levels in the three groups ±s
注:与正常组比较,aP<0.05;与非SCLC 组比较,bP<0.05
组别正常组非SCLC 组SCLC 组F 值P 值例数52 54 49 Pro-GRP(pg/mL)35.16±4.82 52.37±6.09a 78.91±8.53ab 558.924<0.001 NSE(ng/mL)10.63±2.04 16.01±1.93a 19.15±1.98ab 239.752<0.001

表3 LDCT、血清Pro-GRP、NSE 单独与联合诊断SCLC 的价值Tab.3 LDCT, serum Pro-GRP,NSE alone and combined diagnostic value of SCLC
3 讨论
SCLC 为肺癌常见类型,早期以咳嗽、血样痰、气促、低热及呼吸困难等为主要症状,但由于以上症状缺乏特异性,多数患者在确诊时病灶已超越一侧胸腔,部分伴有心包积液及远处转移,预后生存期短[8]。SCLC 发病原因多样,多认为与严重吸烟史、大气污染、电离辐射、职业接触等有关。目前临床关于SCLC 的发病机制尚处于探索阶段,其中促癌基因活性增强、抑癌基因活性被抑制引起异质性恶性细胞形成认可度较高[9]。该病恶性程度强、生长迅速,且早期转移概率大[10],广泛期SCLC 患者无法进行手术切除,仅能通过放化疗减轻患者症状,从而延长其生存期限。因此寻找有效的早期确诊方式以提前治疗时间、改善患者预后是医学界重点课题。
本研究中,103 例高度怀疑为SCLC 患者49 例确诊为SCLC,周围型SCLC 表现为毛刺征、分叶征、胸膜凹陷征,增强扫描后强化指征>20 HU,中央型SCLC 病灶已累及到叶支气管,支气管表现为狭窄、僵硬、黏膜粗糙,伴有腔内结节及软组织肿块,且伴强化、阻塞性肺不张、阻塞性肺炎、阻塞性肺气肿征象。LDCT 扫描对肺部微小结节较为敏感,非钙化微小结节确诊率高,可清晰显示肺实质、肺结节及纵隔特征,且可对肺结节直径进行精确判定,并观察其边缘特征及内部结构,更准确地判断结节性质[11]。另外,其成像可克服X 线片重叠现象,提升隐匿部位病灶检出率[12]。肺癌LDCT影像学表现与肿瘤位置及组织学特点相关,周围型肺癌表现为残存支气管、肺泡,以及肿瘤表面胸膜牵拉所致空洞。中央型SCLC 则呈现浸润生长状态,以管腔狭窄及壁厚增加为主要病理变化。本研究中LDCT 采取低电流及低剂量扫描,放射剂量仅为常规CT 扫描的15%左右[13],故检查时患者累积的电离辐射剂量少,诱发电离辐射相关疾病的风险低,安全性高。
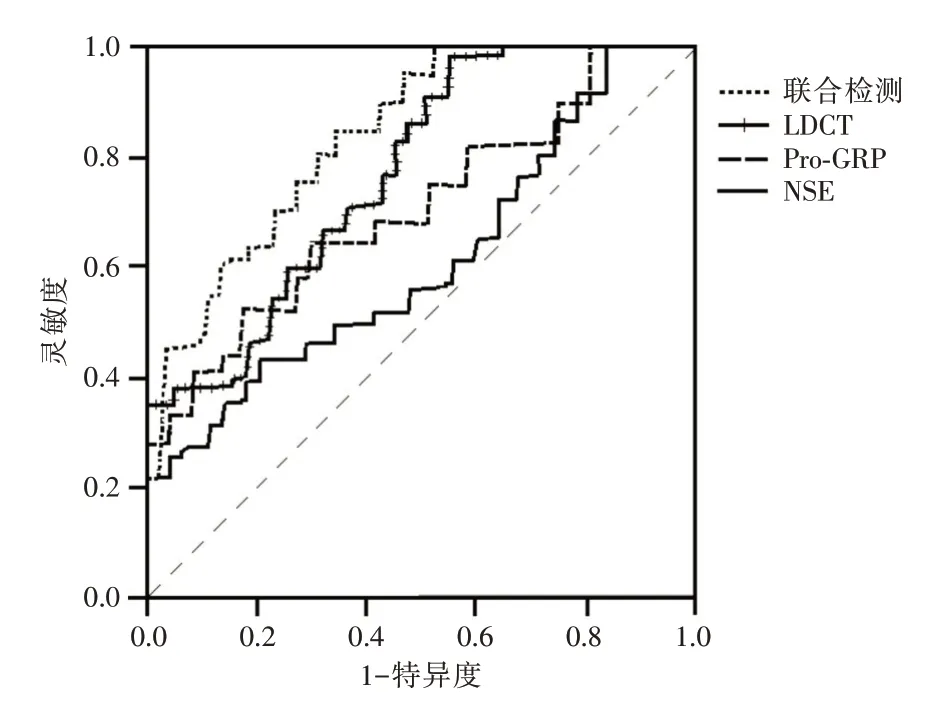
图1 LDCT,血清Pro-GRP、NSE 单独与联合诊断SCLC 价值的ROC 曲线Fig.1 ROC curve of LDCT,serum Pro-GRP,NSE alone and combined for SCLC diagnostic value
本研究通过比较正常组、非SCLC 组、SCLC 组血清Pro-GRP、NSE 水平发现,SCLC 组上述指标明显高于非SCLC 组,非SCLC 组明显高于正常组,提示SCLC 患者中血清Pro-GRP、NSE 水平异常升高,与WOJCIK 等[14]、GE 等[15]报道相似。胃泌素释放肽(gastrin releasing peptide,GRP)存在于健康机体胃、脑的神经纤维等及胎儿神经内分泌组织中,SCLC 细胞异常增生可导致GRP 大量生成,血清水平异常升高。但由于GRP 半衰期短,稳定性不足,故通常以其稳定前体Pro-GRP 作为肺癌诊断参考指标。NSE 属于常见糖酵解酶[16],通常分布于神经元及神经内分泌细胞,SCLC 神经内分泌分化特征显著,可刺激NSE 大量生成并释放入血液,导致血清水平升高。另有研究[17]表明,内分泌、神经、免疫系统可通过肽类激素、神经递质、细胞因子等互相作用,构成神经-内分泌-免疫网络。肺不仅是呼吸器官,也是重要的内分泌器官,参与多种生物活性物质的激活、生成、释放、转化。当出现肺炎、肺结核、肺血管平滑肌瘤、支气管囊肿等疾病时,机体免疫系统受到影响,反馈性调节神经递质及细胞因子等的释放,导致血清Pro-GRP、NSE 水平异常,与JIA 等[18]研究结论一致。
本研究ROC 结果显示,LDCT、血清Pro-GRP、NSE 单独诊断SCLC 的AUC 分别为0.762、0.687、0.593,三者联合诊断的AUC 为0.813,提示三者联合检测的价值大于单独检测。LDCT 依靠密度分辨率高、病灶特征清晰,以及不易受到机体组织结构重叠干扰等优势可作为SCLC 较为理想的诊断方式,但由于疾病进展通常超前于影像学表现,其有效性仍待进一步提升。尽管Pro-GRP、NSE 在SCLC 患者血清中含量显著高于其他恶性肿瘤,但同时与神经内分泌源组织有关,故两者在神经母细胞瘤、前列腺癌等神经内分泌相关肿瘤中同样存在异常升高现象[19-21],SCLC 诊断特异度、灵敏度不足,两者单独应用受到限制。三者联合可发挥彼此协同作用,弥补自身不足,促进诊断特异度及准确度的提升。因此,临床在诊断SCLC 时可联合LDCT 与血清Pro-GRP、NSE 检测,获取更为准确的诊断结果,降低漏诊率及误诊率,避免延误治疗时机,以延长患者生存期限。本研究结果中血清Pro-GRP、NSE 诊断SCLC 的最佳截断点分别为76.13 pg/mL、18.54 ng/mL,余卉等[23]在研究血清Pro-GRP、NSE 对SCLC 诊断价值时发现,两者最佳截断点分别为66.90 pg/mL、23.50 ng/mL,与本研究结果存在一定差异,分析原因可能与患者年龄、病情严重程度等个体差异有关,今后需进行更为深入的研究。
综上所述,LDCT、血清Pro-GRP、NSE 水平联合检测诊断SCLC 的价值高于三者单独检测,可为该病诊断提供有效指导。本研究新颖之处在于采用ROC 曲线以图示方法判断LDCT、血清Pro-GRP、NSE 水平联合检测SCLC 的临床准确性,客观反映三者联合检测的灵敏度、特异度及准确度,具有直观、简单及肉可判断的优势。当然,本研究仍存在一定局限性,由于研究时间、单中心研究等因素的限制,入选患者例数较少,在进一步研究中应增加样本量,为三者联合检测诊断SCLC 的价值提供更多依据。
