宫腔灌注粒细胞刺激因子对反复种植失败患者妊娠结局及免疫状态的影响
2020-07-27张曦倩许虹罗燕群朱秀兰董梅刘风华
张曦倩 许虹 罗燕群 朱秀兰 董梅 刘风华
广东省妇幼保健院生殖中心(广州511400)
随着辅助生殖技术的快速发展,临床结局不断改善,累积妊娠率已达80%[1],但仍有约10%的患者经多次胚胎移植仍未能成功植入,称为反复种植失败(recurrent implantation failure,RIF)[2]。目前尚无RIF 的统一诊断标准,一般是指年龄<40 岁,枚移植≥4 优质胚胎(包括新鲜及冷冻周期),仍未能获得临床妊娠,常由多种病理因素共同所致,机制复杂,目前尚未明确[3]。子宫内膜容受性是影响胚胎种植最常见的因素(占2/3)[4],因此改善子宫内膜容受性是治疗RIF 的有效策略[5]。有研究报道,粒细胞刺激因子(granulocyte-stimulating factor,G-CSF)可通过抑制NK 细胞,对子宫内膜容受性起正向调节的作用,宫腔灌注G-CSF 可改善RIF 患者的妊娠结局[6]。但目前有关G-CSF 宫腔内灌注治疗RIF 的临床研究仍较少,有待进一步证实其临床疗效及安全性[7]。本研究通过对RIF患者胚胎移植前G-CSF 宫腔灌注的随机对照研究,旨在探讨G-CSF 宫腔灌注对RIF 患者妊娠结局及免疫功能的影响,从而为G-CSF 宫腔灌注广泛运用于RIF 的治疗奠定基础。
1 资料与方法
1.1 一般资料选取2016年3月至2019年4月间在我院就诊并拟行冻融胚胎移植的RIF 患者作为研究对象,患者均签署知情同意书。(1)入组标准:①年龄:20 ~39岁女性;②均为RIF患者;③均为冻融卵裂胚移植。(2)排除标准:①女方年龄20岁以下或≥40岁者;②男、女及双方染色体异常患者;③子宫解剖学异常;④子宫、宫腔有器质性病变及宫腔粘连者;⑤患有高血压、糖尿病等慢性疾病者;⑥子宫内膜异位症;⑦子宫内膜异常菲薄(≤7 mm);⑧子宫内膜炎未经治疗者;⑨血栓前状态。
1.2 方法
1.2.1 分组按随机数字表法将纳入研究的RIF患者分为治疗组(拟行G-CSF 宫腔灌注治疗)和对照组(口服5 mg/d 强的松治疗)。
1.2.2 宫腔灌注时间第1 次:自然周期卵泡晚期或行HRT 人工周期补充雌激素第12 天;第2 次:自然周期的排卵日或行HRT人工周期内膜转化日。
1.2.3 操作步骤常规外阴、阴道消毒,注射器接人工授精管,抽取150 μg G-CSF(重组人粒细胞刺激因子注射液,瑞白,齐鲁制药有限公司),缓慢注入宫腔。患者卧床30 min,每5 min 改变1 次体位,使药物均匀分布于宫腔。
1.2.4 胚胎解冻移植日行卵裂期胚胎解冻(Vitrolife,瑞典),胚胎卵裂球数目达冷冻前卵裂球数目一半及以上认为复苏胚胎存活,采用Peter 评分系统对复苏胚胎进行评分[8]。
1.2.5 内膜准备及胚胎移植月经规律、排卵正常的研究对象采用自然周期准备内膜;不满足以上条件者则行雌孕激素替代疗法(即人工周期)准备内膜。胚胎解冻后,体外培养过夜,超声引导下,将移植管小心置入患者子宫腔内,注入胚胎,停留片刻后退出移植管。
1.2.6 黄体支持与随访胚胎移植后均行常规黄体支持,移植后第14 天血清人绒毛膜促性腺激素(HCG)水平>25 μg/L 判定为生化妊娠,移植后1 个月B 超观察到孕囊或胎心搏动诊断为临床妊娠。
1.2.7 宫腔液免疫状态分析收集治疗组患者GCSF 宫腔灌注及胚胎移植前的宫腔液,置液氮中储存备检。宫腔液样本复温后,高速离心10 min(10 000 r/min),取上清,采用ELISA 法检测宫腔液中白介素(IL-8、IL-10、IL-17)、γ-干扰素(IFN-γ)、转化生长因子-β1(TGF-β1)及嗜酸性粒细胞趋化因子(Eoxtaxin)水平。用BCA 试剂盒进行蛋白定量(碧云天)。操作步骤按照试剂盒说明书进行。
1.3 统计学方法采用SPSS 19.0 软件进行统计学分析,定量数据以()表示,t检验进行组间比较,率的比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象一般情况比较本研究共纳入拟行冷冻胚胎移植的RIF 患者69 例,其中治疗组35 例,对照组34 例。两组间患者平均年龄[(35.8 ± 3.6)vs.(35.5±3.3)岁]、不孕年限[(7.3±2.3)vs.(7.4±2.5)年]、BMI[(21.5±2.4)vs.(21.6±2.5)kg/m2]、基础FSH[(5.4 ± 1.8)vs.(21.6 ± 2.5)IU/L]、基础LH[(5.6 ± 1.6)vs.(5.7 ± 1.6)IU/L]、E2[(162 ± 15.2)vs.(169±14.9)pmol/L]及既往平均移植胚胎数分别为[(4.7vs.1.4)vs.(4.5±1.6)]枚,差异均无统计学意义(P>0.05)。见表1。
表1 两组基本情况比较Tab.1 Basicline of patients ±s
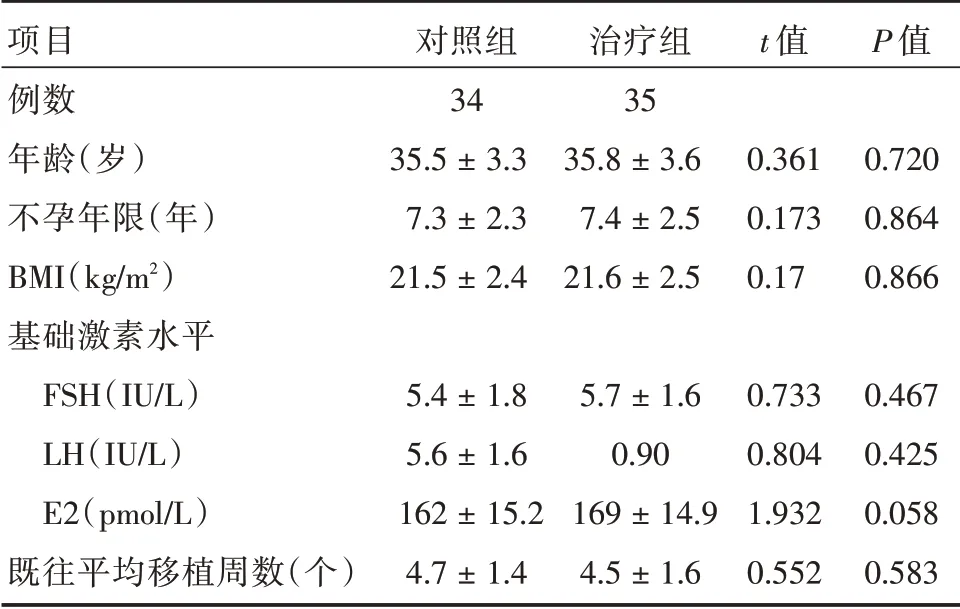
表1 两组基本情况比较Tab.1 Basicline of patients ±s
项目例数年龄(岁)不孕年限(年)BMI(kg/m2)基础激素水平FSH(IU/L)LH(IU/L)E2(pmol/L)既往平均移植周数(个)对照组34 35.5±3.3 7.3±2.3 21.5±2.4 5.4±1.8 5.6±1.6 162±15.2 4.7±1.4治疗组35 35.8±3.6 7.4±2.5 21.6±2.5 5.7±1.6 0.90 169±14.9 4.5±1.6 t 值0.361 0.173 0.17 0.733 0.804 1.932 0.552 P 值0.720 0.864 0.866 0.467 0.425 0.058 0.583
2.2 两组妊娠结局比较两组间平均移植胚胎数及平均移植优质胚胎数差异均无统计学意义(P>0.05)。治疗组的胚胎种植率(25.5%)、临床妊娠率(51.4%)及活产率(51.4%)均显著高于对照组(12.6%、26.5%和23.5%,P<0.05)。见表2。
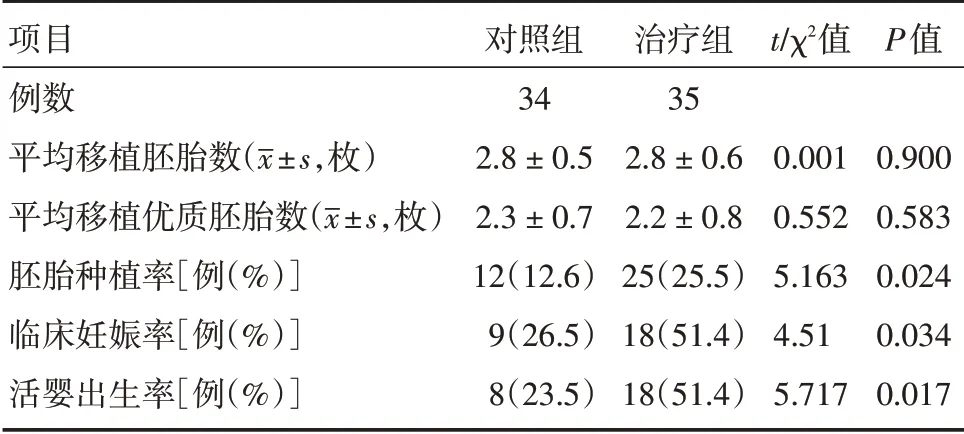
表2 两组妊娠结局比较Tab.2 Comparision of clinical outcomes
2.3 G-CSF治疗前后宫腔液免疫状态比较由表3可见,治疗后宫腔液中的INF-γ及IL-17水平较治疗前显著下降;IL-10、TGF-β1 及VEGF 水平则较治疗前显著增加(P<0.05),治疗组治疗前后Eoxtaxin水平差异无统计学意义(P>0.05)。
表3 治疗组宫腔灌注治疗前后宫腔液中细胞因子比较Tab.3 Comparison of cytokines in uterine cavity fluid before and after treatment ±s,pg/mL
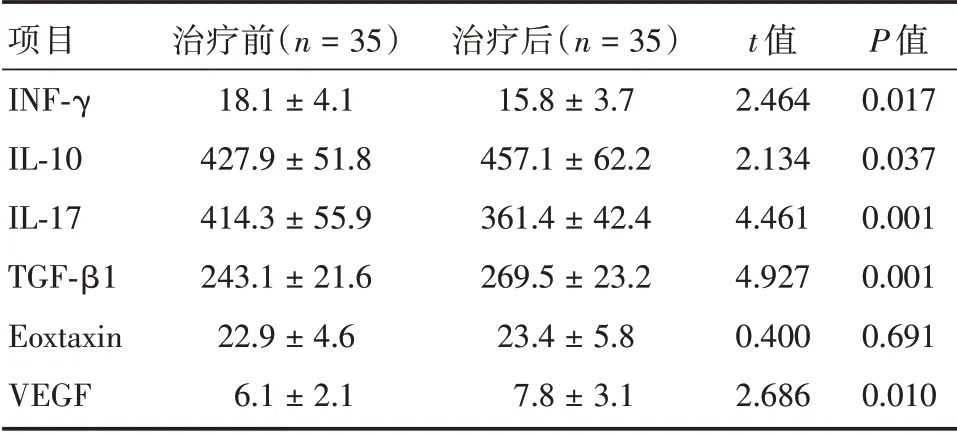
表3 治疗组宫腔灌注治疗前后宫腔液中细胞因子比较Tab.3 Comparison of cytokines in uterine cavity fluid before and after treatment ±s,pg/mL
项目INF-γ IL-10 IL-17 TGF-β1 Eoxtaxin VEGF治疗前(n=35)18.1±4.1 427.9±51.8 414.3±55.9 243.1±21.6 22.9±4.6 6.1±2.1治疗后(n=35)15.8±3.7 457.1±62.2 361.4±42.4 269.5±23.2 23.4±5.8 7.8±3.1 t 值2.464 2.134 4.461 4.927 0.400 2.686 P 值0.017 0.037 0.001 0.001 0.691 0.010
3 讨论
RIF 是目前生殖医学领域所面临的难点和挑战。通过优化胚胎选择、加强胚胎内膜同步化、内膜搔刮机械刺激、使用甾体类激素及抗凝药物等方法,虽在一定程度上提高了RIF 患者的胚胎种植率,但对某些原因不明以及免疫功能异常的RIF患者疗效有限[9]。
众所周知,妊娠本质上是一个同种异体移植过程,胚胎成功着床需避免和降低母体免疫系统对胎儿的排斥作用[10]。越来越多的证据显示,RIF的发生与母胎界面的免疫失衡密切相关,通过调节子宫内膜的免疫应答可改善RIF 患者的母体排斥反应[11-12]。G-CSF 宫腔内灌注作为一种新的免疫治疗技术,具有子宫内膜局部免疫调节作用,在RIF 治疗中的作用已受到越来越多的关注[13]。本研究的结果显示,治疗组的胚胎种植率(25.5%)、临床妊娠率(51.4%)及活产率(51.4%)均显著高于对照组(12.6%、26.5%和23.5%)(P<0.05),表明G-CSF 宫腔灌注可提高胚胎种植率,改善RIF 患者的临床结局。
有研究证实,免疫活性细胞包括辅助T 淋巴细胞(T helper cell,Th 细胞)、NK 细胞及巨噬细胞在RIF 的母胎免疫反应过程中起重要作用,其中Th1/Th2 与Th17/Treg 细胞间的免疫漂移及失衡是导致RIF 的决定性因素[14]。
Treg 细胞是一种具有免疫抑制功能的自然T细胞,可诱导机体产生免疫耐受。同时,Treg细胞还可分泌多种免疫抑制因子如IL-9、IL-10 及TGF-β,抑制CD4、CD8 细胞的增殖和母-胎界面的免疫排斥反应。Th17细胞也来源于自然T 细胞,但具有Treg 细胞不同的免疫学效应,可通过分泌IL-17,参与母-胎界面的免疫排斥反应[15]。有研究[16-17]发现,G-CSF 可通过调节Treg 细胞的数量,诱导IL-10产生,抑制炎症反应,改善子宫内膜局部的免疫耐受状态及RIF 患者的临床结局。
Th1 细胞可诱导NK 细胞活化及浸润,Th2 细胞则可分泌IL-10 等免疫抑制细胞因子,下调Th1,诱导免疫耐受,Th1/Th2 间的平衡在胚胎种植过程中同样发挥重要作用。宫腔液可反映胚胎所处宫腔的微环境,为进一步探究G-CSF 宫腔灌注治疗的作用机制,本研究对灌注治疗前后的宫腔液的免疫状态进行分析。结果显示,经G-CSF 治疗后,RIF 患者宫腔液中的IL-10 及TGF-β水平均明显上升,而INF-γ、IL-17 水平显著降低,表明G-CSF 宫腔灌注可诱导子宫内膜局部Th1/Th2 与Th17/Treg向Th2 及Treg 漂移,诱发局部免疫耐受,从而改善了RIF 患者的妊娠结局[18]。有研究[19]报道,G-CSF可通过VEGF 刺激局部血管内皮细胞增生及迁移,促进新生血管形成,增加子宫基底动脉的血流灌注,恢复子宫内膜细胞因子间的平衡,使内膜处于更有利于胚胎植入的理想状态。本研究结果也证实,G-CSF 治疗后宫腔液中VEGF 表达增加,这可能也是G-CSF 宫腔灌注改善RIF 患者妊娠结局的机制之一。本研究中,治疗组共出生活婴18 例,均未发现出生缺陷。由于本研究的样本量较少,G-CSF 宫腔内灌注对子代的影响仍需进一步研究证实。
综上所述,宫腔内灌注G-CSF 治疗可有效改善RIF 患者的妊娠结局及免疫状态,且简单易行,是改善RIF 患者临床结局的有效方法。
