新型冠状病毒感染后特异性IgM和IgG抗体变化规律的初步探索
2020-07-27刘国才刘智强张江袁红姜鹏
刘国才 刘智强 张江 袁红 姜鹏
新疆军区总医院1呼吸内科,2血液内科,3北京路临床部呼吸内科(乌鲁木齐830000);泰康同济(武汉)医院4感染三科,5感染四科(武汉430000)
新型冠状病毒(SARS-CoV-2)是人畜共患的单正链RNA 病毒,属于β属的冠状病毒[1]。2019年12月份首次在湖北武汉发现[2]。其引起的疾病,在2月11日被WHO 正式命名为 新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)[3]。《新型冠状病毒肺炎诊疗方案》试行第1 ~6 版中均强调COVID-19 的确诊需要RT-PCR 检测病毒核酸或进行基因测序获得病原学证据。应用RT-PCR进行病毒核酸检测曾一度被作为COVID-19 诊断的金标准,但是此方法对实验条件、设施、人员要求高,并且影响因素多、操作步骤多、检测时间长。更重要的是核酸检测虽然特异性高,但是限于各种原因导致其假阴性率较高[4-5]。在3月3日发布的最新版《新型冠状病毒肺炎诊疗方案(试行第七版)》[6]已明确指出SARS-CoV-2 特异性抗体可以作为COVID-19确诊的依据,但是由于疫情需要、临床应用紧急,对于SARS-CoV-2 感染人体后产生血清学特异性抗体的规律尚未明确,其作为确诊标准的意义还有待于更多的临床数据予以证实。因此本研究回顾性分析了768例COVID-19患者,以期探索特异性抗体产生规律,为临床实践提供依据。
1 对象与方法
1.1 研究对象回顾性分析泰康同济(武汉)医院2020年2月10日至3月27日收治的COVID-19确诊或疑似患者,病例诊断标准参考《新型冠状病毒肺炎诊疗方案(试行第六版)》[7]。确诊病例均具有SARS-CoV-2 病原学证据,疑似病例为具有COVID-19 流行病学、临床和影像特征但是未能得到病原学证据的患者。
1.2 研究方法所有纳入病例均在入院后进行了SARS-CoV-2 特异性抗体和核酸检测。SARS-CoV-2特异性抗体检测采用磁微粒化学发光免疫分析方法,试剂由Bioscience 公司提供。标本的采集、检测程序、结果判定等按照说明书进行。核酸检测由经培训合格的医务人员采集患者鼻咽拭子,采用实时荧光RT-PCR 方法检测。
1.3 统计学方法计数资料采用例(%)表示,采用χ2检验分析。计量资料符合正态分布的采用()表示;不符合正态分布的采用M(P25,P75)表示。所有统计过程均采用SPSS 23.0 统计学软件进行,P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象一般资料研究共纳入768名患者,其中男334 例(43.5%),年龄(61.01 ± 14.78)岁,病程(41.59 ± 15.07)d。泰康同济(武汉)医院作为一家COVID-19 定点收治医院,2月中旬开始收治患者,3月14日才开始引入特异性抗体定量检测,因此进行抗体检测的患者平均病程较长,多处于疾病的恢复期。研究共纳入确诊患者483 例,疑似患者285 例,各组间一般资料见表1。
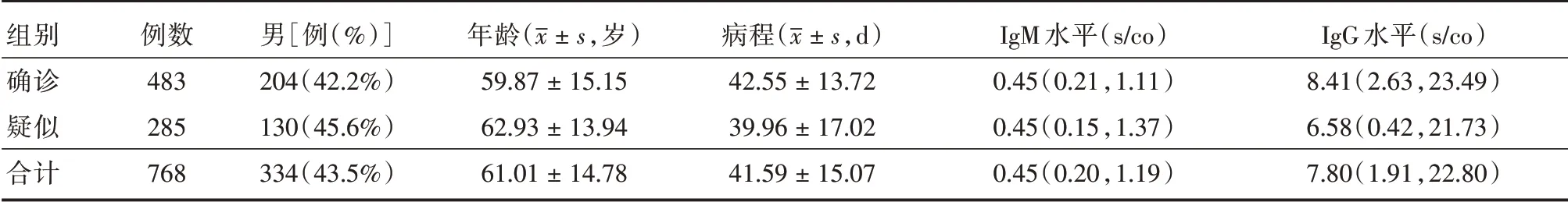
表1 纳入对象一般资料分析Tab.1 The basic characteristics of included cases M(P25,P75)
2.2 确诊和疑似病例特异性抗体阳性率确诊和疑似患者特异性IgM 的阳性率分别为27.1%(131/483)和31.9%(91/285),两者差异无统计学意义(P=0.156)。确诊组病例的特异性IgG 阳性率为88.8%(429/483),显著高于疑似组的71.6%(204/285)差异有统计学意义(P<0.01)。确诊患者中有25.7%(124/483)为双阳性,疑似患者中有30.5%(87/285)为双阳性,两者差异无统计学意义(P=0.145)。根据第七版诊疗方案,SARS-CoV-2 特异性IgM 和IgG 抗体同时阳性,可以确诊COVID-19,出院时将这些病例纳入确诊病例,重新分组后确诊病例有570 例,疑似病例有198 例。见表2。
2.3 病程与特异性抗体阳性率将病例根据抗体检测时的病程按照每两周分组,统计不同组的抗体阳性率。发病1 ~2周IgM阳性率为18.4%(9/49),随着病程延长,抗体阳性率逐渐增高,第7 ~8 周达到峰值为33.9%(105/310),第8周以后开始回落,差异有统计学意义。IgG阳性率、以及IgM和IgG双阳性率结果类似,随着病程延长抗体阳性率逐渐增加,在第7 ~8周达到峰值,之后开始回落(表3)。将IgM 和IgG 抗体水平的中位数与病程的关系作折线图,可见在第8 周以后抗体水平有明显的下降。见图1。

表2 确诊和疑似患者特异性抗体阳性率分析Tab.2 The positive rates of specific antibody in confirmed and suspected cases 例(%)

表3 病程与特异性抗体阳性率分析Tab.3 The relation between positive rates of specific antibody and course of disease 例(%)

图1 特异性抗体水平与病程折线图Fig.1 The plot of specific antibody level and course of disease
2.4 核酸结果与特异性抗体阳性率将病例根据抗体检验日期附近的核酸结果分组,统计核酸阳性、阴性病例组的特异性抗体阳性率。因部分病例核酸与抗体检测日期相差过大而未纳入分析,因此此结果中病例数少于本研究纳入的总病例数。核酸阳性的病例有104 例,其中IgM、IgG、IgM 联合IgG 的阳性率分别为26.9%(28),88.5%(92),26.0%(27);核酸阴性的病例有615 例,IgM、IgG、IgM 联合IgG 的阳性率分别为29.1%(179)、81.3%(500)、27.6%(170)。将核酸结果分别与IgM、IgG、IgM 联合IgG 的阳性率进行卡方分析,核酸阳性、阴性病例组的特异性抗体阳性率差异无统计学意义(P>0.05)。见表4。
3 讨论
病毒核酸检测作为确诊COVID-19 的金标准,具有特异性好、可早期诊断等优点,但是由于采样不规范等因素容易造成漏检,造成假阴性较高[5,8]。特异性抗体检测作为病毒感染性疾病的间接证据有重要意义,像乙肝、丙肝、艾滋病等病毒性疾病的诊断都离不开抗体检测。一般认为机体在接触病毒时,IgM 抗体最早产生,维持时间也短,可以作为急性期感染的诊断指标;IgG 产生稍晚,但维持时间长,血清IgG 阳性提示感染中后期或既往感染[9-10]。但以上只是一个普遍规律,SARS-CoV-2作为一种新出现的病毒,人们对于其引起的抗体应答规律仍知之甚少。

表4 核酸结果与特异性抗体阳性率的关系分析Tab.4 The relation between positive rates of nucleic acid and specific antibody 例(%)
不同研究报道的COVID-19 患者特异性抗体阳性率有所不同。李萍等[11]进行的一项研究显示在COVID-19确诊患者中IgM和IgG阳性率为75.9%(88/116)和90.5%(105/116),徐万州等[12]进行的一项研究发现确诊患者中IgM 和IgG 的阳性率分别为70.24%(144/205)和96.10%(197/205)。本研究共纳入确诊患者483 例,疑似患者285 例,发现确诊患者特异性IgM 和IgG 阳性率分别为27.1%(131/483)和88.8%(429/483)。本研究得出IgM 的阳性率要低于IgG,这与其他研究报道的数据一致,得出的IgG 阳性率与其他研究结果相差也不大,但是IgM 阳性率要明显低于以上两个研究。分析原因一方面可能与检验方法和采用不同公司的试剂有关[13-14],疫情发生后,国家药监局开始启动医疗器械应急审批程序,截止3月12日已有10 个核酸检测试剂、6 个抗体检测试剂得到审批投入临床,但是尚缺乏对不同试剂诊断效能的评估和比较。另一方面可能与选择的病例特点有关,处于疾病不同分期的患者抗体阳性率会有所不同[15]。
梁颖等[16]展开的一项研究发现确诊和疑似组的IgM 阳性率分别为73.31%(173/236)、12.66%(10/79),确诊组的阳性率是疑似组的6 倍左右,差异十分显著。本研究并未发现这种差异,本研究发现确诊和疑似患者IgM 的阳性率为分别为27.1%(131/483)和31.9%(91/285),疑似患者的阳性率略高于确诊组,两者差异无统计学意义(P=0.156)。本研究纳入的疑似病例,从流行病学、临床特征、CT 影像方面都高度支持COVID-19 的诊断,只是由于缺乏病原学证据而不能确诊。根据第七版诊疗方案关于IgM 和IgG 同时阳性可以确诊的推荐,本研究中有87 例(30.5%)近1/3 的疑似患者可以纳入确诊病例,如果可以获得患者初期和恢复期血清化验IgG 滴度的话,可以得到确诊的疑似患者比例将进一步增加。因此,确诊和疑似患者的抗体阳性率差异不应该如此巨大。出现与别的研究不一致的原因,主要是疑似患者的选择上。如果疑似患者经过反复检验最终得到确诊的比例高,那么两组的抗体阳性率应该差别不大,而如果疑似患者最终被排除COVID-19 比例较高,那么两组抗体阳性率就会呈现巨大差异。
新型冠状病毒特异性IgM 抗体多在发病3 ~5 d 后开始出现阳性[17-18]。本研究发现最早的一例患者在发病2 d 即可检测到IgM 和IgG 抗体同时阳性。在发病早期1 ~2 周内特异性抗体阳性率最低,IgM 和IgG 分别为18.4%、38.8%。随着病程延长,抗体阳性率逐渐增高,第7 ~8 周达到峰值,分别为33.9%、93.2%,第8 周以后抗体阳性率又开始下降。徐云云[19]的研究显示特异性IgM 抗体在病程的15 ~30 d 内阳性率最高。罗效梅等[20]分析了101 例确诊患者后发现在发病后8 d 后抗体阳性率升到最高,28 d 后IgM 开始消失,而IgG 阳性率随着病程延长逐渐升高,并未见到回落趋势。一项追踪SARS 患者的研究发现,特异性SARS-CoV IgM和IgG 在SARS 发病10 d 后逐渐升高,30 ~40 d 抗体滴度达峰,IgM 阳性率在发病51 ~60 d 后逐步下降,而IgG 阳性率在发病81 ~90 d 后逐步下降[21]。本研究得出的数据发现SARS-CoV-2 特异性抗体的达峰时间更晚,期待未来有更多的研究数据来证实这一点。
目前多地均有报道COVID-19 治愈出院后核酸复阳的病例[22],可能的原因之一在于核酸检测的假阴性率较高,根据连续2 次核酸检测阴性做为判断出院标准之一时,可能会将体内仍存在病毒复制的患者解除隔离出院。而抗体检测的稳定性相对较好,希望能够通过IgM 抗体阳性来预测核酸结果,从而作为辅助出院标准。将病例根据抗体检验日期相近的核酸结果分组,统计核酸阳性、阴性病例组的特异性抗体阳性率。将核酸结果分别与IgM、IgG、IgM 联合IgG 的阳性率进行比较,核酸阳性组、阴性病例组的特异性抗体阳性率差异无统计学意义(P>0.05)。即特异性抗体的阳性率不适合作为判断出院的标准。李萍等[11]分析了17例确诊患者转阴前后的IgM抗体,发现核酸转阴后血清IgM 抗体阳性率(52.9%,9/17)显著低于转阴前IgM 抗体阳性率(88.2%,15/17)。李萍等[11]研究分析的是同一批患者核酸转换前后的血清,理论上实验设计上更合理,但一方面样本量较小,另一方面抗体阳性率与病程有关,不能除外转阴后的IgM 阳性率降低是由于病程的影响。本研究纳入了719名患者进行分析,样本量较大,有较强可信度。建议进一步开展大样本、严格设计的临床试验研究证实这一点。
本研究存在一些不足。首先这是一个回顾性分析,纳入的均为确诊和疑似患者,没有设置对照组,无法计算特异性抗体诊断COVID-19 的特异度进一步评估特异性抗体的诊断效能。其次纳入的病例平均病程长、以疾病中晚期居多,对于早期病程的患者纳入比例相对较少,从而对于早期抗体趋势的判断可能欠精确。另外缺乏对同一病例的连续观察,尚不能完全反映SARS-CoV-2 感染后患者体内的特异性抗体产生及变化规律。
综上所述,SARS-CoV-2 特异性抗体可以作为COVID-19 辅助诊断的一个工具。随着病程增长,抗体阳性率逐渐增高,第7 ~8 周达到峰值,第8 周以后抗体阳性率又开始下降。但是尚需要更多的研究数据进一步探索SARS-CoV-2 特异性抗体的产生、变化规律和在COVID-19 疾病中的应用价值。
