99Tcm标记的经聚乙二醇修饰的黑色素纳米颗粒的制备及脑胶质瘤的初步显像研究
2020-07-27董星艺韩贵娟王明华
董星艺 韩贵娟 王明华
1贵州医科大学研究生学院(贵阳550004);2贵州医科大学附属医院核医学科(贵阳550004)
脑胶质瘤是由于大脑和脊髓胶质细胞癌变所产生的最常见的原发性颅脑恶性肿瘤,由于其侵袭性强、复发率高、预后差,至今仍然是所有恶性肿瘤中接受综合性治疗预后最差的一类中枢神经系统肿瘤[1-2]。因此对脑胶质瘤及时有效的诊断成为影响该疾病预后的关键因素。
黑色素是一种普遍存在的生物色素,是大多数生物体中存在的一种颜料,由于其具有抗辐射、抗氧化和螯合金属离子等多种特性,从而引起了生物医学的广泛关注。黑色素纳米颗粒(MNPs)是一种内源性、可降解的新型纳米粒子,在生物医学中非常重要。它可以进行光声(PA)成像或者螯合金属离子简化多模态成像探针的组装[3-5]。已有研究证明MNPs 具备多模态成像探针的潜力。
分子影像是从细胞、分子层面探测疾病的变化,在肿瘤的诊断方面具有独特的优势,其关键是设计有针对性的分子探针。目前,神经影像常规检查主要包括CT 和MRI。这两种成像方法对肿瘤解剖结构的显示较好,对胶质瘤的诊断效能近年有了很大提高,但对肿瘤内部组织活性的诊断不足[6-9]。PET(positron emission tomography)检查具有较高的特异性,但受其高精密性、复杂性以及所用的显像剂昂贵,检查费用高等因素,而限制了该技术的广泛应用。SPECT 可对了解胶质瘤良恶性提供一定帮助,对肿瘤细胞的增殖活力作出较准确的判断,与CT 或MRI 影像学检查起到互补作用[10-11]。本研究将具有生物学相容性的MNPs纳米粒子进行99Tcm标记,合成了99Tcm-MNP,该纳米颗粒通过聚乙二醇修饰后,得到的99Tcm-PEGMNP 有很好的生物稳定性和安全性,同时进行99Tcm-PEG-MNP 在肿瘤模型鼠的体内分布显像研究。
1 材料与方法
1.1 材料人脑胶质瘤U87-MG 细胞系购自美国标准细胞库;双氨基聚乙二醇NH2-PEG5000-NH2、酞菁类染料Cy5.5、黑色素购自于Life Technologies公司,噻唑基四唑(MTT)购自于Sigma-Aldrich 公司;动物实验所有小鼠为雌性Blab/c 裸鼠(购自于南方医科大学实验动物中心);透射电子显微镜购自飞利浦公司,粒度仪购自英国马尔文Mastersizer Micro 公司,放射性活度计购自美国Capintec公司。
1.2 MNPs的制备与修饰黑色素纳米粒子的制备、修饰及标记流程见图1,实验步骤参考文献[12-13]并有所改动,首先取黑色素(20 mg)在搅拌下溶于10 mL 的0.1 mol/L NaOH 的水溶液,在超声细胞粉碎机(15%,20 W)作用下于1 min 内加入0.1 mol/L HCl 调节至pH 7.0,得到黑亮的MNPs 水溶液,用离心过滤器(MWCO=30 kDa)离心除掉溶液中的Na+、Cl-,并用去离子水洗涤两次,冷冻干燥,得纯净黑色素纳米颗粒,备用。
用NH2-PEG5000-NH2对所得黑色素纳米颗粒进行表面处理,即取纯净黑色素纳米颗粒5 mg 溶于5 mL 超纯水中,加入28 wt%NH4OH 溶液调节至pH 9.0,加入pH 9.0 的NH2-PEG5000-NH2的水溶液,搅拌12 h,用离心过滤器(MWCO=30 kDa)离心,洗涤,冷冻干燥获得PEG-MNP 固体。
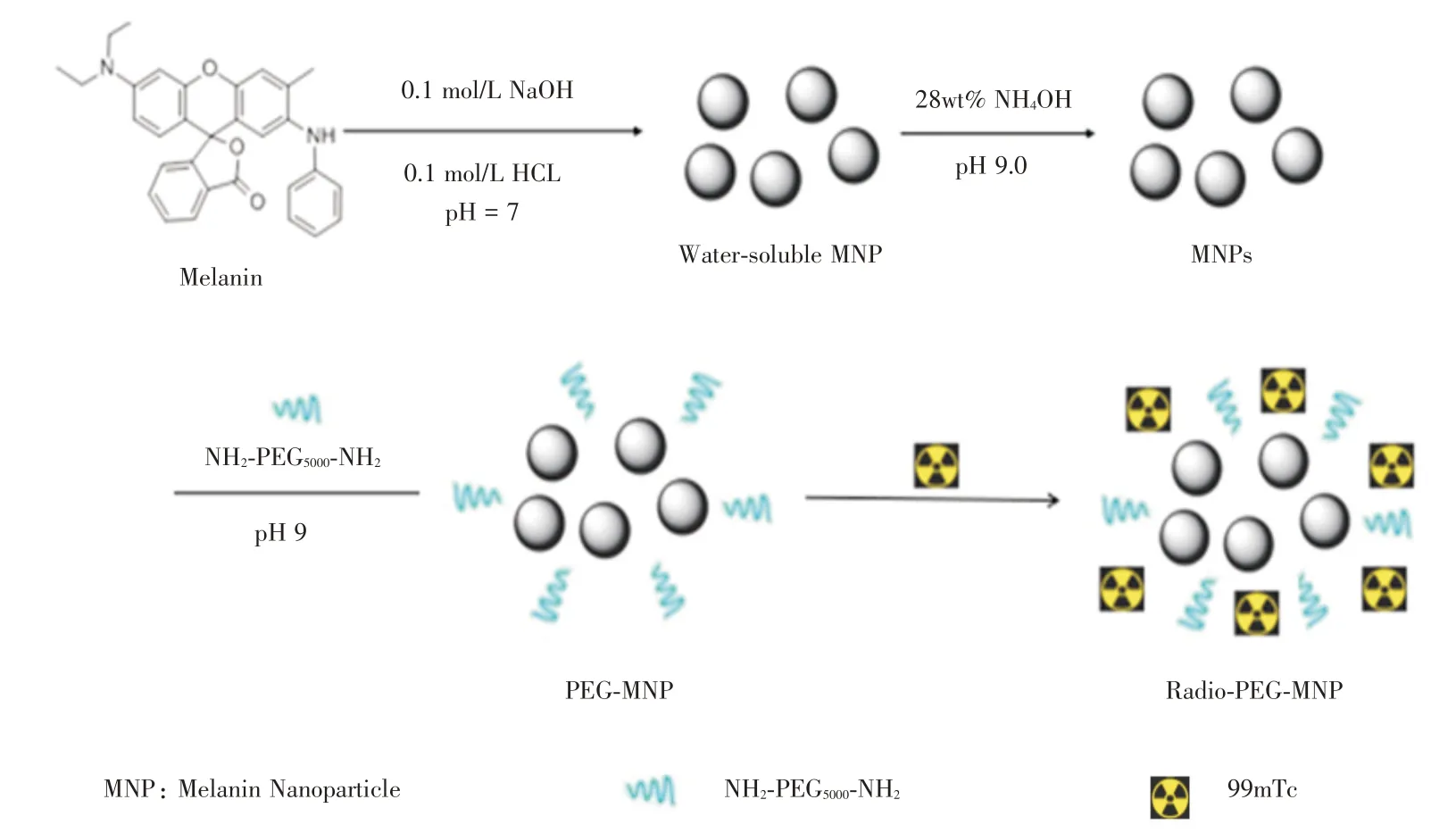
图1 Radio-PEG-MNP 合成、修饰及标记流程Fig.1 The synthesis,modification and labelling of Radio-PEG-MNP
1.3 MTT 法测得纳米颗粒对人脑胶质瘤细胞增殖的影响U87-MG 细胞按照每孔8 000 个细胞种植到96 孔板内,放置培养箱中培养过夜后,去除孔内上清液,添加99Tcm-PEG-MNP 浓度为0、12.5、25、50、100、200、400 μg/mL 的细胞培养液,继续培养24 h 后分别添加MTT 溶液10 μL,继续培养4 h。去除孔内液体,添加二甲基亚砜(DMSO)溶液置摇床低速孵育10 min 后,测定波长490 nm 处的吸光度(A)值,分析细胞存活率变化。
1.4 细胞摄取实验U87-MG细胞以2.0×105个/孔加到6 孔板中,孵育1 d 后,加入1 mL 的100 μg/mL的Cy5.5-99Tcm-PEG-MNP,指定时间(1、3、6、12、24 h)后,收集细胞,PBS 洗3 遍后,用激光共聚焦直接观察胞内Cy5.5 的荧光强度和分布。
1.5 Blab/c小鼠皮下瘤的构建3×106U87-MG细胞悬浮在PBS 中制成细胞悬液,在小鼠的右侧背部注射100 μL 的上述细胞悬液。当肿瘤体积达到60 mm3之后用于相关动物肿瘤实验。
1.6 Blab/c小鼠原位瘤的构建Blab/c小鼠原位瘤的构建接种部位参考文献[14-15],Blab/c 小鼠用0.8% 的戊巴比妥钠腹腔注射麻醉后(20 mL/kg),将小鼠俯卧位固定。用酒精消毒小鼠头皮后,用手术刀矢状切开小鼠头皮,3%过氧化氢清洁切口,暴露颅骨,延前囟后3 mm,旁开左侧2 mm,牙科钻打孔。26 号微量注射器注射5 μL 细胞悬液(约1 × 106个细胞),进针深度2 mm,退针0.5 mm,注射时间约25 s。停针5 min 后慢慢拔针,消毒手术切口。腹腔注射5 万单位青霉素抗感染。手术结束后SPECT 成像。
1.7 99Tcm-PEG-MNP 在肿瘤模型中的显像及体内生物分布肿瘤小鼠经0.8%的戊巴比妥钠腹腔注射麻醉后,皮下瘤尾静脉注射放射剂量为7.4 MBq的99Tcm-PEG-MNP,分别于1、3、6、12、24 h 进行γ相机成像采集,显像时间为10 min。原位瘤小鼠尾静脉注射放射剂量为29.6 MBq99Tcm-PEG-MNP,于1、3 h进行SPECT成像,显象时间15 min。
在脑胶质瘤Blab/c 小鼠皮下瘤模型上,我们对99Tcm-PEG-MNP 的生物分布进行了细致的考察。经尾静脉注射100 μCi 的99Tcm-PEG-MNP 后24 h,处死小鼠,收集小鼠的心、肝、脾、肺、肾及其肿瘤。用天平称量各个器官的质量,用伽马计数仪测量各个脏器的放射强度。通过计算,可得出24 h时各个器官和肿瘤中99Tcm-PEG-MNP 的富集量。
1.8 统计学方法实验数据用SPSS 21.0 软件进行分析。计量资料以均数±标准差表示。采用t检验进行比较,P<0.05 表示差异有统计学意义。
2 结果
2.1 MNPs 及PEG-MNP 的合成与评价MNPs 的制备有两种方法:通过多巴胺聚合成MNPs;从自然界提取天然黑色素,利用纳米技术制备天然MNPs,与合成黑色素相比,天然黑色素无毒、安全性高[16]。见图2,通过TEM 可观察到该纳米颗粒貌规整、分散性好,适合后续研究。其次,粒度仪测定黑色素纳米颗粒在去离子水溶液中的水合半径为20 nm 左右。见图3。

图2 PEG-MNP 电镜图Fig.2 TEM of PEG-MNP,scale bar=500 nm、20 nm and 0.2 μm
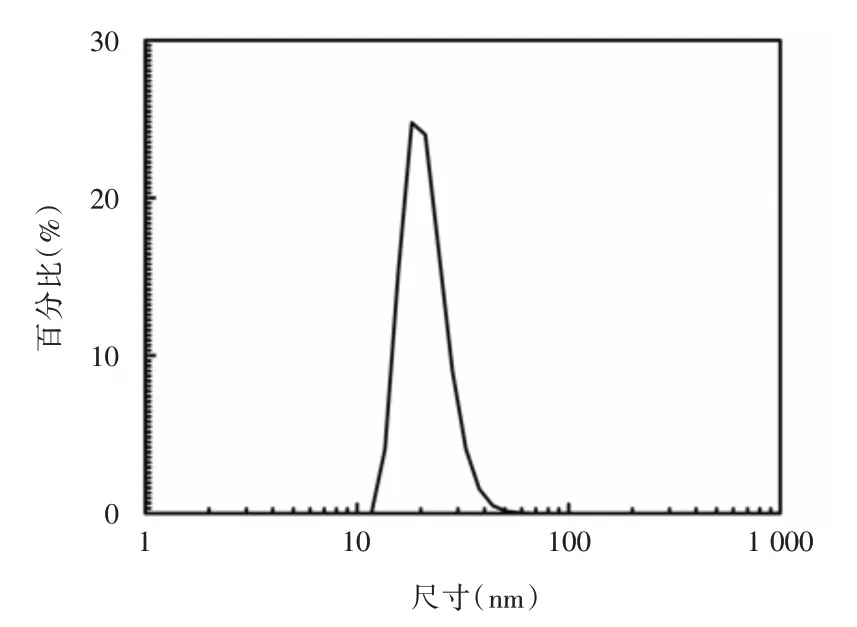
图3 PEG-MNP 动态光散射结果Fig.3 DLS of PEG-MNP[dinameter=(18±2)nm]
2.2 99Tcm-PEG-MNP 的稳定性检测在标记产物应用到小动物体内评价之前,进行了体外稳定性检测,本研究将99Tcm标记在PEG-MNP 上。见图4,99Tcm-PEG-MNP 在PBS 及血清中于24 h 内均保持良好的稳定性,标记物在两种溶液中的稳定性均保持在95%以上。
2.3 纳米颗粒与细胞的相互作用本研究将纳米颗粒结合上Cy5.5 荧光染料,然后将U87-MG 细胞与Cy5.5 标记的99Tcm-PEG-MNP 共孵育拍摄不同时间点的激光共聚焦显微镜图像,见图5。随着时间的延长,细胞增加了对Cy5.5 标记的99Tcm-PEGMNP 的摄取。
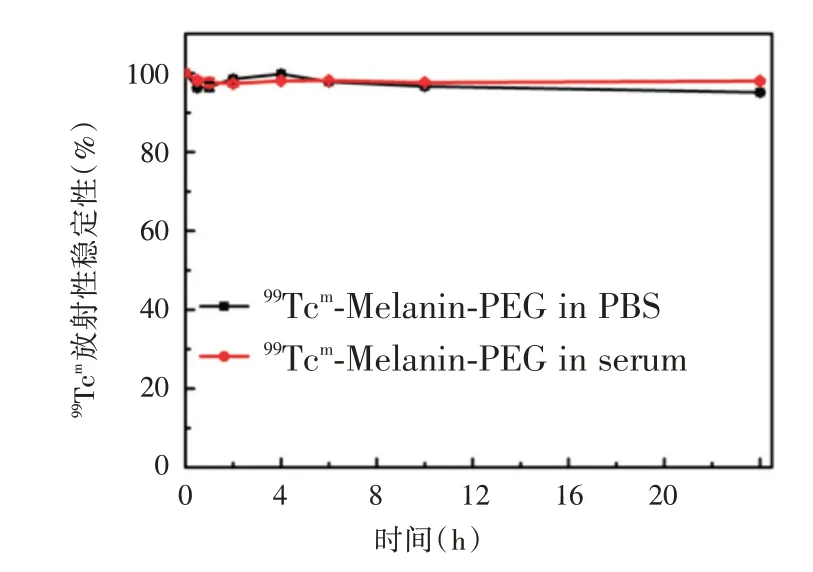
图4 99Tcm-PEG-MNP 在PBS 和血清中的体外稳定性测试Fig.4 In vitro stability of99Tcm-PEG-MNP in PBS and serum
2.4 MTT 法测得纳米颗粒对人脑胶质瘤细胞增殖影响0、12.5、25、50、100、200、400 μg/mL 的纳米颗粒处理后的细胞活力分别为:(100±2.49)%、(101.25 ± 2.43)%、(101.30 ± 2.32)%、(103.59 ±1.66)%、(99.11 ± 0.62)%、(96.36 ± 2.59)%、(94.07± 3.35)%,0、12.5、25、50 μg/mL 的纳米颗粒处理后的细胞存活率差异无统计学意义(P>0.05)。100、200、400 μg/mL 的纳米颗粒处理后的细胞存活率降低,400 μg/mL 的存活率最低,但仍然高于90%,故纳米颗粒浓度高达400 μg/mL 时对细胞仍无显著毒性(P>0.05)。
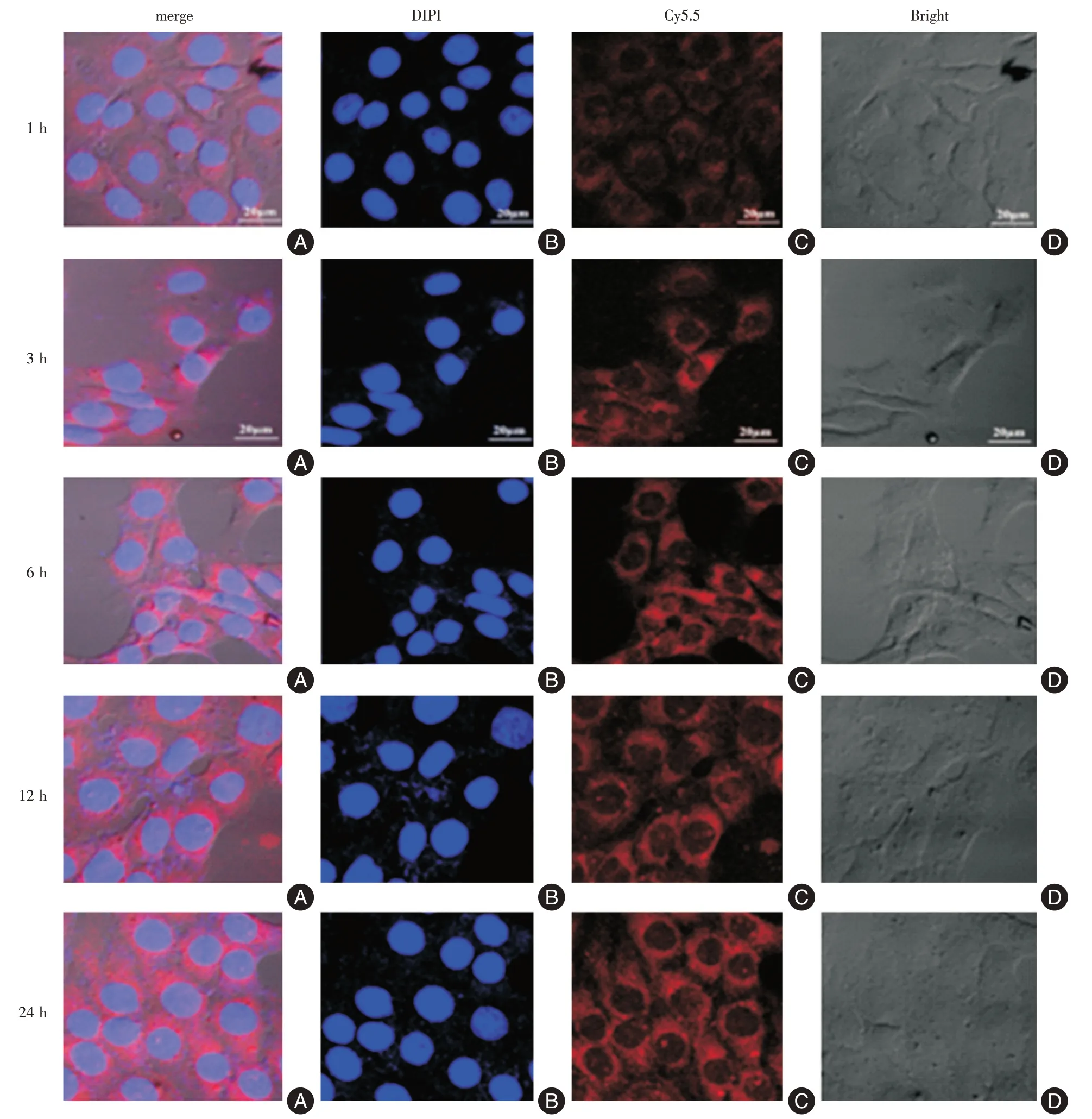
图5 激光共聚焦显微镜观察U87-MG 细胞中99Tcm-PEG-MNP 的摄取情况Fig.5 Observation of99Tcm-PEG-MNP uptake in U87-MG cells by laser confocal microscopy
2.5 99Tcm-PEG-MNP 在肿瘤模型中的显像为了进一步检测99Tcm-PEG-MNP 在肿瘤动物模型中的成像能力,在脑胶质瘤Blab/c 小鼠皮下瘤模型上,尾静脉注射99Tcm-PEG-MNP 后经不同时间点用γ相机进行成像。见图6a,注射99Tcm-PEG-MNP 后1 h,可见99Tcm-PEG-MNP 在肝脏内大量浓集。随着时间的延长,至6 h显像可见99Tcm-PEG-MNP 在肿瘤部位摄取较3 h 增多。这是由于纳米粒子的EPR 效应随着时间延长,其在肿瘤部位逐渐富集,至24 h由于代谢作用,99Tcm-PEG-MNP 在肝脏和肿瘤处的浓集比1 h 明显减少。
在脑胶质瘤Blab/c 小鼠皮下瘤模型上,尾静脉注射100 μCi99Tcm-PEG-MNP 24 h 后,处死小鼠,收集小鼠的心、肝、脾、肺、肾及其肿瘤,见图6b。99Tcm-PEG-MNP 在小鼠肝脏和脾内大量聚集,肿瘤部位次之,与γ相机成像结果一致。
本研究建立脑胶质瘤Blab/c 小鼠原位瘤模型,并进行SPECT 成像。见图7,经尾静脉注射99Tcm-PEG-MNP 1 h 后,与生物分布的结果一致,放射性主要集中于肝脏,而在其他器官中分布较少。随着时间延长至3 h,通过活体成像系统可观察到裸鼠颅内原位瘤模型中的化学发光信号强度高于1 h。
3 讨论
本研究从天然黑色素中提取了黑色素纳米颗粒,利用聚乙二醇对其表面进行修饰,并用核素99Tcm对其进行标记,成功构建出放射性纳米探针99Tcm-PEG-MNP。放射性活度计检测该探针的放射性标记率在95%左右。在细胞毒性的研究上,我们分析了不同浓度的探针对细胞活力的影响,在浓度高达400 μg/mL 时对细胞仍然无显著毒性,证明了99Tcm-PEG-MNP 具有良好的生物安全性。在小动物水平上,构建了小鼠胶质瘤细胞U87-MG 皮下瘤和原位瘤,经尾静脉注射99Tcm-PEG-MNP 后通过γ相机与SPECT 进行成像,实现了99Tcm-PEGMNP 对脑肿瘤的显像。

图7 99Tcm-PEG-MNP 在Blab/c 小鼠中SPECT 成像图,由左至右显像时间分别为注射前、注射后1、3 hFig.7 SPECT imaging of Blab/c xenograft model with99Tcm-PEG-MNP,from left to right Before the injection,After the injection 1 h imaging,3 h imaging,respective
纳米探针分为无机纳米探针和有机纳米探针,对于无机纳米探针的显像,杜鹏等[17]研究发现用99Tcm标记磁性纳米颗粒Fe3O4颗粒可在裸鼠模型中SPECT/MRI 双模态成像。周征等[18]研究发现Fe3O4纳米颗粒对XPF 细胞的生长有显著的抑制作用,但表现出了一定的细胞毒性,说明Fe3O4纳米颗粒不适合应用于有核苷酸剪切修复基因突变的人群。与Fe3O4等无机纳米颗粒相比,内源性生物材料为基础的有机纳米粒子具有应用范围广、安全性高等特点,因此在分子影像领域获得广泛研究。
MNPs 是一种内源性的纳米颗粒,其尺寸小、不易被吞噬,且相比其他纳米材料,毒性也较低。ZHANG 等[19]证明了即使MNPs 浓度高达800 μg/mL也无显著的细胞毒性。LIOPO 等[16]发现金纳米棒的细胞毒性是合成MNPs的2倍。现有的研究证明,MNPs 具备多模态成像探针的潜力。目前已有人用124I、64Cu 等标记PEG-MNP 纳米粒子,并在肿瘤模型鼠中实现了PET 显像[13,20],但是PET 显像相对价格昂贵,患者所要付出的经济代价较高。而伽马相机或SPECT 显像相对经济代价较低,寻找合适的用于伽马相机或SPECT 的探针成为现代医学急需解决的问题。
综上所述,本研究首次合成了经99Tcm标记的黑色素纳米探针99Tcm-PEG-MNP,并成功将该探针用于肿瘤的核素显像,但是对于细胞株、纳米颗粒种类的考察不够全面,不同的细胞株和纳米粒子会有出现不同规律的可能,具体机制和应用价值还有待进一步深入研究。
