草酸对珊瑚砂的溶蚀作用及其机制研究
2020-07-27李越煊李鹏飞董元华
李越煊,李鹏飞,潘 杰,刘 云,王 萍,董元华
(1.兰州交通大学化学与生物工程学院,甘肃 兰州 730070;2.中国科学院南京土壤研究所土壤环境与污染修复重点实验室,江苏 南京 210008;3.中国科学院大学,北京 100049)
吹填珊瑚岛礁在保护我国海洋及陆域资源[1-2]和维护海洋权益[3]等多方面具有重要作用,因此,近年来国内学者对岛礁的地基沉降变形[4]、微生物固化[5-6]、珊瑚砂水稳性能[7]和植物建植[8-9]等方面的研究较多。为了建设适用于人类生产活动且宜居的生态环境,人工种植防风固沙植被已被提上日程[9-10]。目前,植被建植研究主要集中于采用草种筛选、控水炼苗等措施提高草坪成坪覆盖度方面[10],同时通过回填客土以及调节pH和添加有机肥来提高植物成活率。由于珊瑚岛礁主要由珊瑚砂组成,而珊瑚砂主要晶体晶型为文石、方解石和镁方解石等碳酸盐矿物,内部具有结构疏松多孔、体积质量相对较小、易破碎且高压缩等特点[11]。目前,对于我国南方碳酸盐岩上覆土层的物质来源研究[12-13]较多,并且提出碳酸盐岩风化作用产生的土层是其主要的物质来源[14],且小分子有机酸含有一个或多个羧基可促进碳酸盐岩溶蚀风化成土[15-16]。小分子有机酸广泛分布在自然界中,主要来源于动植物残体的分解、微生物的合成分泌、植物根系的分泌以及土壤中有机物的转化等[17],在改变植物根系土壤的理化性质、促进植物对养分的吸收、对矿物的溶蚀和迁移方面起着不可替代的作用[18-19]。此外,有机酸也是地层中主要酸性流体之一,随着中国海相碳酸盐岩油气勘探进入发现高峰期,研究者发现地层中酸性流体与碳酸盐岩发生相互作用,促进次生孔隙的发育[20]。草酸作为自然环境中常见的一种小分子有机酸,属于有机酸中的强酸,且草酸有着很强的配合能力,能与金属形成有机配体,并导致羟基的电荷密度增加,从而加快矿岩水解溶蚀过程[21]。然而,目前对于草酸溶蚀珊瑚砂的相关报道很少,研究草酸对珊瑚砂的溶蚀机制和沉积规律对于珊瑚岛礁建设以及深海相油田开发有着重大意义[22]。
笔者开展了草酸对珊瑚砂的溶蚀研究,分析了不同浓度草酸与珊瑚砂的溶蚀过程,结合草酸的解离与草酸钙沉积理论,研究草酸与珊瑚砂的反应过程与机制以及溶蚀规律。
1 材料与方法
1.1 实验材料
珊瑚砂实验样品:实验所用珊瑚砂取自中国南方某岛屿,将珊瑚砂粉碎至粒径约为1~2 mm,将珊瑚砂在蒸馏水中浸泡12 h后反复冲洗直至浸泡液电导率低于30 μS·cm-1,在烘箱中于75 ℃条件下烘干备用。
1.2 实验试剂
盐酸、氢氧化钠、草酸和磷酸氢二钾均为分析纯试剂,甲醇为色谱纯。其中,草酸、磷酸氢二钾和盐酸购自南京化学股份有限责任公司,氢氧化钠购自上海沃凯生物技术公司,甲醇购自美国天地试剂公司。
1.3 实验仪器
Isss-120644型X射线衍射仪(XRD,日本理学);Optima 8000 型电感耦合等离子原子发射光谱仪(美国珀金埃尔默);BSA124S型分析天平(北京赛多利斯);Star A211型台式数显酸度计(美国奥利龙);UV8100B型分光光度计(北京菜伯泰科);QHZ-12B型组合式全温度恒温振荡培养箱(太仓华美);Nicolet 8700型红外光谱仪(美国尼高利);KT260凯氏定氮仪(丹麦福斯);Waters Aliance 2695型高效液相色谱仪(美国沃特世);MERLIM型扫描电子显微镜(SEM,德国蔡司)。
1.4 实验方法
1.4.1珊瑚砂基本性质测定及组相分析
均匀取少量备用珊瑚砂于玛瑙研钵中将其研磨过0.15 mm孔径筛,采用X射线衍射仪、电镜分析仪对珊瑚砂固体进行分析。用电感耦合等离子原子发射光谱仪对消煮后的珊瑚砂溶液中K、Ca、Mg等离子含量进行测定[23],采用凯氏定氮仪及分光光度计对其中的N、P含量进行测定[24]。
X射线衍射光谱使用Cu靶,电流为20 mA,电压为40 kV,扫描步长为0.02°,扫描速度为2°·min-1,扫描范围为2~60°。SEM图像通过高分辨率热场发射扫描电镜MERLIN SE2 得到。XRD数据采用Jade 6.5软件处理分析其衍射图谱,使用粉末衍射卡(PDF)确定其晶体结构。
1.4.2不同浓度草酸对珊瑚砂的溶蚀动态
称取10.00 g珊瑚砂,分别加入100 mL不同浓度(1、10和100 mmol·L-1)草酸溶液和100 mL去离子水(CK)于250 mL锥形瓶中,锥形瓶加盖硅胶塞阻止空气中二氧化碳进入。置于30 ℃摇床中振荡,转速为185 r·min-1。分别于0.25、0.5、0.75、1、1.5、2、4、8、12、18、24、36、48、60 h时用针管从锥形瓶中抽取约1.5 mL液体,用0.45 μm滤头快速过滤进行固液分离,测定草酸浓度以及液体部分pH和Ca2+、Mg2+浓度,并采用XRD分析固体组分,通过SEM观察其表面形貌特征。上述系列实验均设置3次重复。
1.4.3不同水岩比对草酸溶蚀珊瑚砂的影响
取浓度为1、10和100 mmol·L-1草酸溶液及去离子水(CK)100 mL于250 mL锥形瓶中,分别与备用珊瑚砂以10∶1、20∶1和100∶1(mL/g)的比例混合,加盖硅胶塞后于30 ℃摇床中按185 r·min-1振荡,分别于1、3、9、16、24、33、57和94 h时抽取1.5 mL溶液,测定其Ca2+浓度。
溶液中Ca2+、Mg2+浓度用电感耦合等离子体发射光谱仪(ICP-OES) 进行测定,pH采用Star A211 pH计测定。草酸浓度用高效液相色谱仪测定,所用色谱柱为Gemini C18(150 mm×4.6 mm,5 μm),保护柱为Gemini C18(4.0 mm×3.0 mm i. d.),流动相由0.8 mol·L-1磷酸二氢钾水溶液(用磷酸调节pH为2.52)与色谱甲醇按体积比99∶1混合而成,流速为0.8 mL·min-1,进样量为20 μL,柱温为30 ℃[25]。
上述系列实验均设置3次重复。
2 结果与分析
2.1 珊瑚砂基本性质的测定及组分分析
通过对珊瑚砂元素含量的分析发现珊瑚砂中主要含有大量Ca、Mg以及少量Na和微量N、P和K等,其Ca、Mg、Na、K、P、N、Fe、Al、Mn和Ba含量分别为329.13、10.56、2.79、0.26、0.17、0.03、0.19、0.12、0.01和0.01 mg·g-1。
用 X 射线衍射仪对珊瑚砂进行物相分析,衍射谱图见图1(a),采用Jade 6.5软件对其特征谱线进行分析发现,特征峰3.408 5(111)、3.285 1(021)、2.708 9(012)、2.491 2(102)、2.379 1(112)、1.980 5(221)、1.884 9(202)、1.817 9(132)和1.745 9(113)为文石的特征谱线,与粉末衍射卡(PDF,卡片71-1663)匹配,经过筛选比对确定特征峰2.995 7(104)为镁方解石的特征峰,此外,少量杂峰显示珊瑚砂中还含有少量方解石。采用Jade软件对样品进行半定量分析得到珊瑚砂中方解石、镁方解石和文石质量含量分别为6.1%、16.6%和77.3%。在珊瑚砂的SEM图〔图1(b)〕中可以明显观察到珊瑚砂结构疏松多孔,颗粒骨架存在大量孔隙,且表面粗糙。
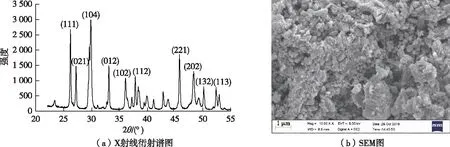
图1 珊瑚砂的X射线衍射谱图及SEM图
2.2 不同浓度草酸对珊瑚砂的溶蚀动态
不同浓度草酸溶液与珊瑚砂溶蚀反应过程中Ca2+、Mg2+、草酸浓度及pH随时间的变化曲线见图2。随着草酸浓度的增加,Ca2+浓度逐渐减小,Mg2+浓度逐渐增加。当c(草酸)为100 mmol·L-1时,Ca2+浓度在0~0.25 h范围内迅速上升并达到最大值,随后缓慢降低,60 h时c(Ca2+)为0.08 mmol·L-1;Mg2+浓度在0~36 h范围内迅速上升,随后逐渐趋于平衡,60 h时c(Mg2+)为2.87 mmol·L-1;草酸浓度在0~60 h范围内逐渐降低,随后逐渐趋于平缓,60 h时c(草酸)为38.54 mmol·L-1;pH值在 0~60 h 范围内缓慢上升,60 h时pH为1.45。当c(草酸)为10 mmol·L-1时,c(Ca2+)在0~0.25 h范围内上升至0.07 mmol·L-1,随后在0.25~4 h范围内逐渐降低,在4~60 h范围内逐渐上升,60 h时c(Ca2+)接近平衡,为0.14 mmol·L-1;Mg2+浓度在 0~24 h范围内缓慢上升,24~60 h时处于平衡状态,c(Mg2+)为0.56 mmol·L-1;草酸浓度在0~8 h范围内迅速降低,随后达到平衡,其在60 h时的平衡浓度为0.11 mmol·L-1;pH值在0~24 h范围内迅速上升至7.96,随后缓慢上升达到平衡,其在60 h时pH值为8.38。当c(草酸)为1 mmol·L-1时,Ca2+浓度在0~8 h范围内迅速上升,随后在8~36 h范围内缓慢上升,在36 h后达到平衡,60 h时c(Ca2+)为0.59 mmol·L-1;Mg2+浓度在0~24 h范围内缓慢上升,24 h时达到平衡,60 h平衡时c(Mg2+)为0.08 mmol·L-1;草酸浓度在0~1 h范围内迅速降低,1~36 h时缓慢降低,随后达到平衡,60 h时平衡c(草酸)为0.03 mmol·L-1;pH值在0~48 h范围内缓慢上升,随后达到平衡,60 h时pH值为8.46。当用去离子水做CK时,Ca2+浓度在0~60 h范围内逐渐增大,60 h时c(Ca2+)为0.65 mmol·L-1,高于不同浓度草酸溶液溶蚀珊瑚砂后溶液中Ca2+浓度,这是因为草酸根离子与Ca2+反应生成草酸钙沉淀,从而使得溶液中Ca2+浓度降低。在去离子水溶液中,Mg2+浓度在0~0.25 h时迅速增加,随后缓慢增加,60 h时c(Mg2+)为0.12 mmol·L-1,低于草酸溶蚀珊瑚砂后溶液中Mg2+浓度。
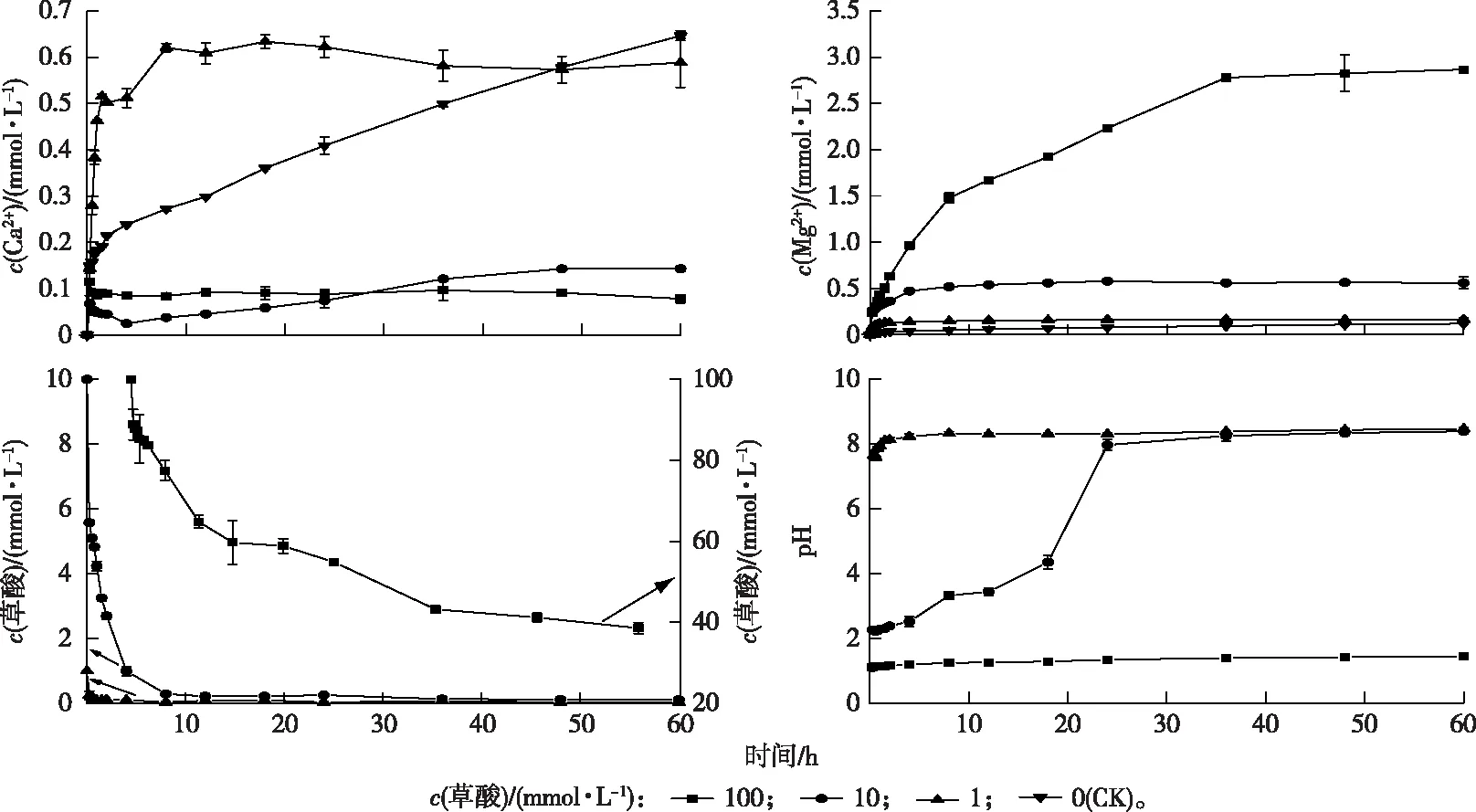
图2 珊瑚砂与草酸反应过程中Ca2+、Mg2+、草酸浓度及pH随时间的变化曲线
2.3 水岩比对不同浓度草酸溶蚀珊瑚砂的影响
图3显示,在同一浓度草酸溶液中,随着水岩比的增加,94 h 时Ca2+浓度也逐渐增加。当c(草酸)为100 mmol·L-1时,水岩比为10∶1、20∶1和100∶1处理组总体趋势表现为Ca2+浓度在0~1 h范围内迅速上升,随后在3 h时降低至最低点,在3~33 h范围内持续上升至最高点,在33~57 h范围内缓慢下降,57 h时达到平衡。
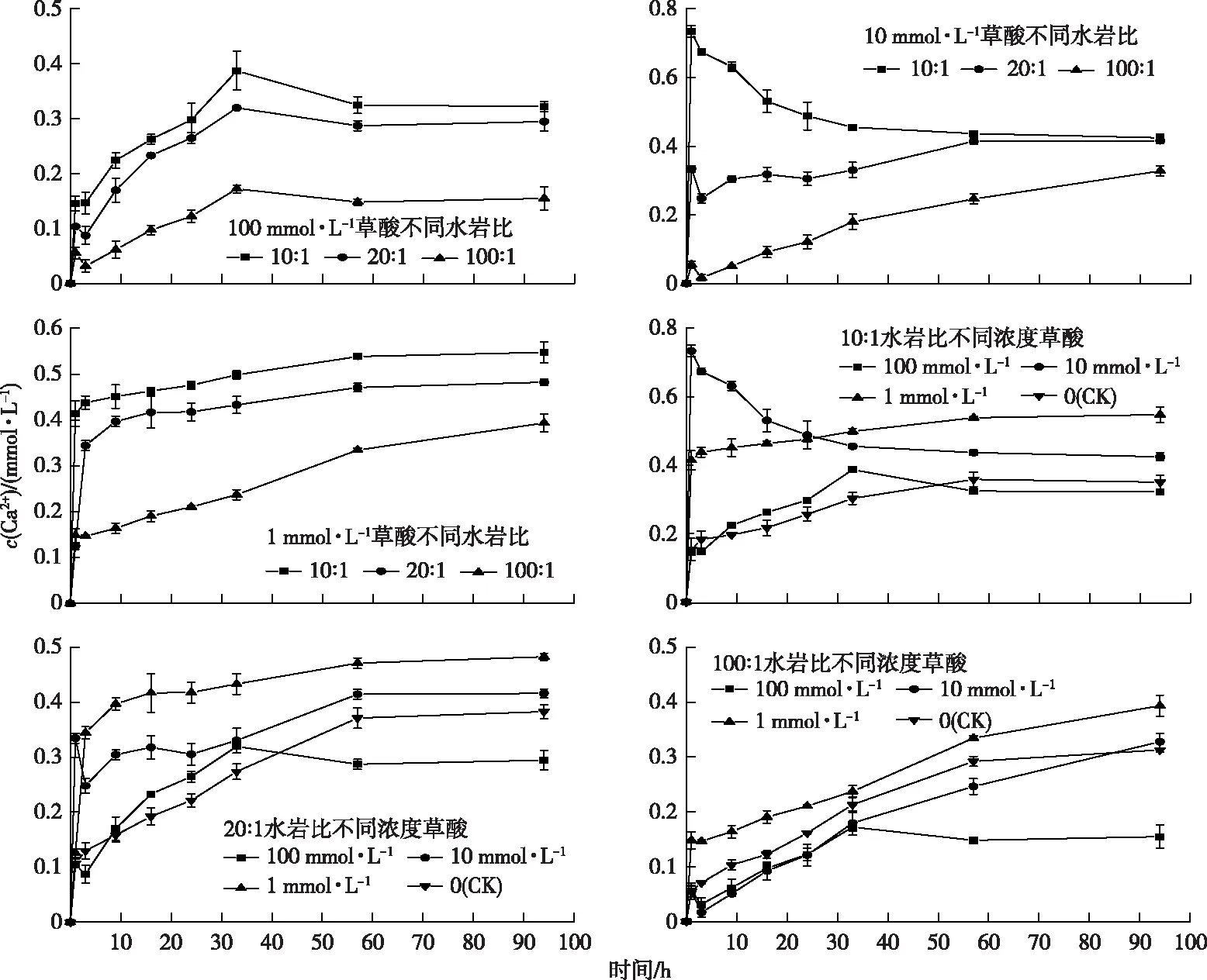
图3 草酸浓度与水岩比对钙离子溶出的影响
当c(草酸)为10 mmol·L-1时,水岩比为10∶1处理组Ca2+浓度在起始时达到最高,随后逐渐降低至平衡;水岩比为20∶1处理组Ca2+浓度在0~3 h范围内迅速上升,随后缓慢上升逐渐达到平衡;水岩比为100∶1处理组Ca2+浓度在1~3 h范围内降低,随后逐渐上升,94 h时c(Ca2+)为0.33 mmol·L-1。当c(草酸)为1 mmol·L-1时,水岩比为10∶1和20∶1处理组Ca2+浓度在0~2 h范围内迅速上升,随后缓慢升高逐渐达到平衡;水岩比为100∶1处理组Ca2+浓度在0~1 h范围内迅速上升,随后匀速上升,94 h时c(Ca2+)为0.39 mmol· L-1。图3显示,在相同水岩比不同浓度草酸溶液中,随着草酸浓度的增加,94 h时Ca2+溶出量逐渐降低,且对照组Ca2+溶出量大于100 mmol·L-1草酸溶液中Ca2+溶出量。
2.4 珊瑚砂溶蚀后晶型和形貌的特征
珊瑚砂与1、10和100 mmol·L-1草酸振荡反应60 h后固相部分和珊瑚原砂的XRD谱图见图4,其特征谱线分别为5.958 6(100)、3.653 8(040)、3.403 5(111)、3.350 5(011)、3.280 3(021)、2.991 7(104)、2.705 9(012)、2.489 9(102)、2.376 7(112)、2.109 1(220)、1.979 6(221)、1.879 8(041)、1.816 6(132)和1.745 2(113)。
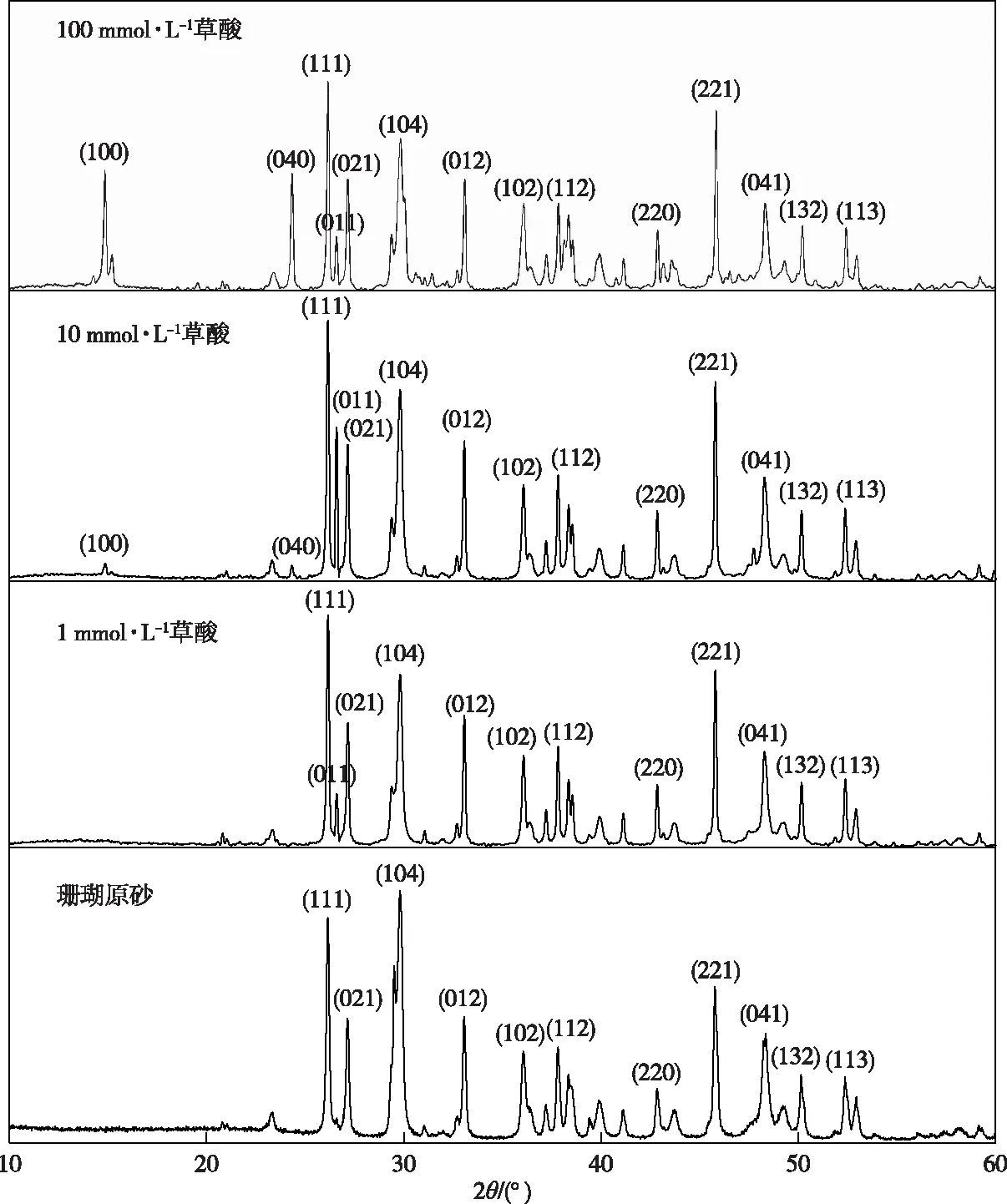
图4 草酸与珊瑚砂反应60 h后固体部分XRD谱图
采用Jade 6.5软件将XRD衍射图谱与PDF卡片库进行对比,发现特征峰3.403 5(111)、3.280 3(021)、2.705 9(012)、2.489 9(102)、2.376 7(112)、2.109 1(220)、1.979 6(221)、1.879 8(041)、1.816 6(132)、1.745 2(113)与文石卡片(99-0013)特征峰匹配,特征峰5.948 6(100)、3.653 8(040)与水合草酸钙石卡片(99-0107)特征峰匹配,特征峰2.991 7(104)与镁方解石卡片(71-1663)特征峰匹配,经过筛选比对发现特征峰3.350 5(011)与石英卡片(99-0088)特征峰匹配,此外,少量杂峰显示其中含有少量方解石,分别对其物相组分含量进行半定量分析,结果见表2。当c(草酸)为1和10 mmol·L-1时,随着草酸浓度的增加,镁方解石在珊瑚砂中的相对含量显著降低,当c(草酸)为10 mmol·L-1时,有水合草酸钙石的生成,且随着草酸浓度的增加,其含量逐渐增大。
1、10和100 mmol·L-1草酸与珊瑚砂振荡反应60 h后剩余固相部分放大1万倍的SEM图见图5。当c(草酸)为1 mmol·L-1时,反应后的珊瑚砂表面与珊瑚原砂相比无明显差异,较难明显观察到新的团簇状物相(图5);当草酸浓度为10和100 mmol·L-1时,可明显观察到有大量新的团簇状物相堆积聚集在珊瑚砂表面及珊瑚砂孔隙(图5),且当c(草酸)为100 mmol·L-1时,生成新的团簇状物相堆积形成的颗粒互相胶连,附着在珊瑚砂颗粒表面。结合草酸与珊瑚砂反应后固相部分组成的XRD分析结果,认为新生成的团簇状物相可能为草酸钙沉淀。
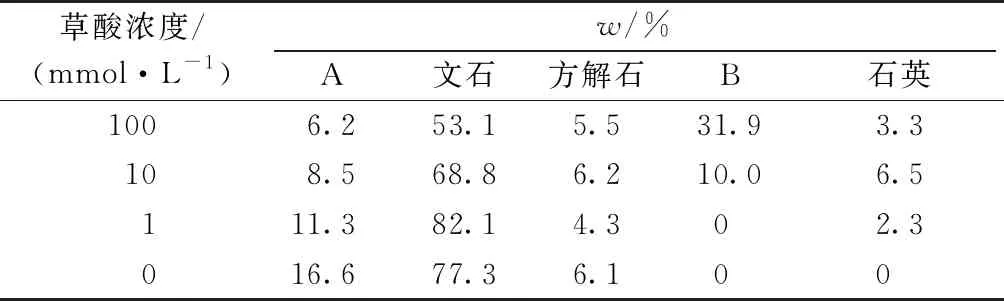
表2 不同浓度草酸与珊瑚砂反应60 h后固相部分组成

A—1 mmol·L-1草酸;B—10 mmol·L-1草酸;C—100 mmol·L-1草酸。
3 讨论
草酸(C2H2O4)是一种二元弱酸,其在水中的电离反应式[26]为
pka1=1.23,
(1)
pka2=4.19。
(2)
由草酸的pka值计算得出不同pH值条件下草酸形态分布图(图6)。当pH值在0~2范围内时,溶液中主要以C2H2O4和草酸一氢根(C2HO4-)形态存在,当pH值在2~6范围内时,主要以C2HO4-和草酸根(C2O42-)形态存在,当pH值大于6时,主要以C2O42-形态存在[27]。
由于珊瑚砂的主要成分为文石与镁方解石,因此草酸溶液与珊瑚砂混合反应可以用式(3)~(7)表示[28]:

(3)

CO2,
(4)
2HCO3-(aq),
(5)

Ca2+(aq)+0.17Mg2+(aq)+H2O(l)+CO2。
(6)
当溶液中Ca2+浓度与C2O42-浓度的乘积大于草酸钙(CaC2O4)的溶度积〔c(Ca2+)×c(C2O42-)>Ksp〕时,溶液中会发生式(7)的反应生成草酸钙沉淀[29]:

(7)
因此,整个反应式可写为

0.17Mg2+(aq)+H2O(aq)+CO2+0.83CaC2O4(s)+
0.17C2O42-(aq)。
珊瑚砂在水溶液中的溶解过程用式(8)~(10)表示[30]:

(8)

OH-(aq),
(9)

OH-(aq)。
(10)
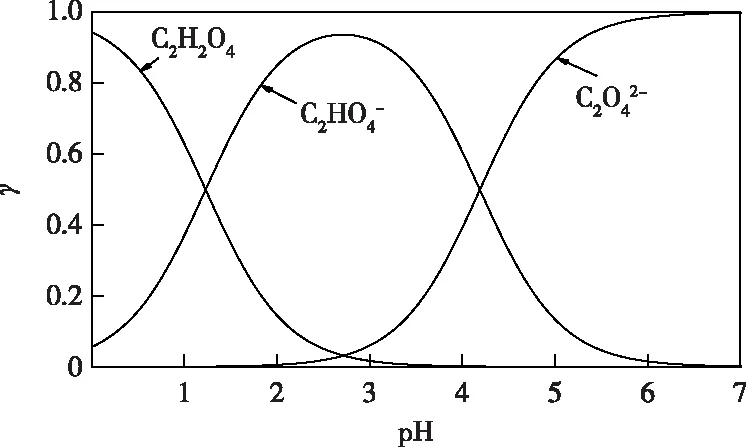
图6 25 ℃、不同pH条件下草酸形态的摩尔分数
当珊瑚砂与草酸溶液混合后,首先发生的是珊瑚砂的酸碱溶出反应,珊瑚砂中Ca2+、Mg2+迅速溶出,溶液中H+被消耗,pH上升,随后溶液中Ca2+与草酸根离子反应产生草酸钙沉淀,减缓了Ca2+的溶出速率,抑制了Ca2+的溶出,溶液中草酸根离子含量逐渐降低,碳酸根离子浓度逐渐升高。由于草酸钙Ksp与碳酸钙相近,此时溶液中会有少量碳酸钙重结晶生成,其中,H+、CO2和C2O42-含量共同控制着珊瑚砂的溶解和沉淀。当c(草酸)为1 mmol·L-1时,反应2 h时溶液中c(Ca2+)×c(C2O42-)=1.77×10-8,接近于草酸钙的Ksp(2.4×10-9),此时伴有草酸钙和碳酸钙生成。随着反应的进行,溶液pH升高,溶液中Ca2+的消耗速率与其溶出速率基本一致,该体系中反应基本达到平衡。当c(草酸)为10 mmol·L-1时,反应时间在0.25~3 h内时,珊瑚砂溶出大量Ca2+,Ca2+优先与高浓度草酸根离子发生反应,溶液中草酸根离子浓度迅速降低,高浓度草酸根离子固定Ca2+〔式(7)〕的速率大于H+溶出珊瑚砂中Ca2+〔式(4)、(6)〕速率,同时碳酸根离子浓度逐渐升高,碳酸根离子会与Ca2+发生重结晶,反应60 h时,溶液pH值为8.38,溶液中基本不再发生式(4)和(6)的反应,此时溶液中草酸以C2O42-形态存在,c(Ca2+)×c(C2O42-)=1.63×10-8,接近于CaC2O4的Ksp(2.4×10-9),草酸钙沉淀与解离接近平衡,溶液中溶解碳酸钙的速率和生成草酸钙、碳酸钙重结晶的速率基本相同,该反应体系基本达到平衡。当c(草酸)为100 mmol·L-1时,草酸根离子浓度不断降低,pH略有上升,Mg2+浓度不断上升,Ca2+浓度不断降低,此过程体系中同时发生式(3)、(4)、(6)和(7)的反应。随着反应的不断进行,生成的大量草酸钙逐渐附着在珊瑚砂颗粒表面并填充在珊瑚砂颗粒孔隙中,降低珊瑚砂与溶液的接触面积,从而降低反应速率。在去离子水中珊瑚砂Ca2+的溶出是因为碳酸钙在水中发生溶解,当珊瑚砂在去离子水(CK)中时,发生溶解反应〔式(8)~(10)〕,因此,溶液中Ca2+浓度不断增加,pH值增大,随后Ca2+的溶出速率和沉淀速率基本相同,最终反应基本达到平衡。反应结束后固相部分XRD的分析结果表明,珊瑚砂中镁方解石相对含量明显降低,文石相对含量明显升高,且10和100 mmol·L-1处理镁方解石含量比1 mmol·L-1处理低。因此,草酸对珊瑚砂中镁方解石的溶蚀性高于珊瑚砂中其他组分。
由于在草酸溶蚀珊瑚砂的过程中不仅存在Ca2+的溶出反应〔式(4)、(6)〕,而且存在Ca2+被草酸根固定沉淀的反应〔式(7)〕,溶液中Ca2+浓度不能代表珊瑚砂溶出的Ca2+浓度,因此不能简单地通过数学模型对Ca2+浓度进行动力学模拟。笔者研究中只对珊瑚砂中Mg2+浓度进行动力学模拟。通常,矿物溶解动力学多数受扩散过程、表面反应过程以及扩散过程和表面反应过程的综合影响[31]。当体系中溶解的离子浓度主要受扩散作用影响时,可以用Stumm微分方程〔式(11)〕进行模拟[32],当溶解过程同时受扩散过程和界面反应过程影响并伴有化学反应时,可用Stumm修正方程〔式(12)~(14)〕进行模拟。通过在matlab程序中利用式(11)~(14)对珊瑚砂中Mg2+溶出的溶解动力学进行计算拟合,发现式(11)对Mg2+浓度随时间的变化曲线的拟合度较高,因此推测Mg2+的溶出主要受扩散过程的影响,具体动力学方程见表3。
dC/dt=K(Cs-Ct)n,
(11)
dC/dt=K(Cs-Ct) +K2,
(12)
dC/dt=K(Cs-Ct)n+Ct-K2,
(13)
dC/dt=K(Cs-Ct)n(Ct-K2)。
(14)
式(11)~(14)中,Cs为溶液中溶解离子平衡浓度,mmol·L-1;Ct为t时刻溶解离子浓度,mmol·L-1;K为表观速率常数,mmol1-n·Ln-1·h-1;K2为反应常数,mmol·L-1;n为反应级数。

表3 不同浓度草酸体系中Mg2+的溶解动力学方程
在相同浓度不同水岩比以及相同水岩比不同浓度草酸溶出珊瑚砂中Ca2+的实验中,随着水岩比的不断升高和草酸浓度的增加,Ca2+溶出浓度逐渐降低。当草酸浓度为100 mmol·L-1时,溶液中Ca2+浓度低于CK组去离子水中Ca2+浓度,此时,草酸抑制了珊瑚砂中Ca2+的溶出。通过对94 h时不同处理组Ca2+浓度进行双因素方差分析(表4),发现草酸浓度与水岩比对Ca2+溶出的影响均达显著水平,但两者的交互作用对Ca2+溶出的影响不显著,且在草酸溶蚀珊瑚砂促进Ca2+溶出的过程中,草酸与珊瑚砂的水岩比对其的影响更大。
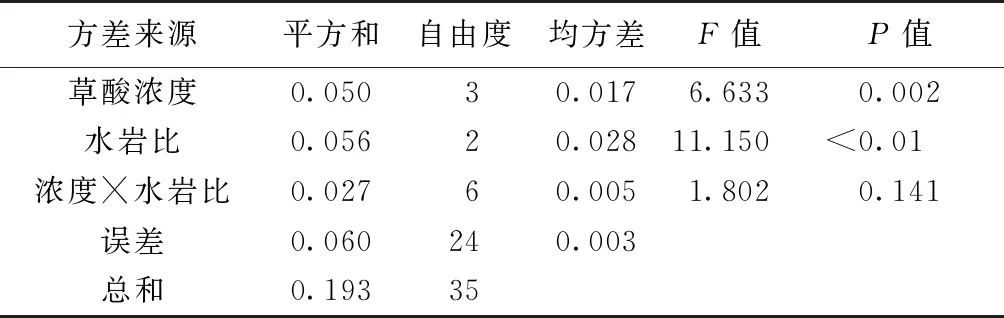
表4 草酸浓度、水岩比对Ca2+溶出影响的双因素方差分析
4 结论
(1)不同浓度草酸与珊瑚砂的溶蚀反应过程中,反应初始阶段主要发生Ca2+、Mg2+的酸碱溶出反应,此后Ca2+与草酸主要发生沉淀反应,生成的草酸钙沉淀阻止反应的继续进行。随着草酸浓度的增加,反应达到平衡的时间逐渐延长,平衡时Ca2+浓度逐渐降低,Mg2+浓度逐渐升高。
(2)通过不同浓度草酸溶液对珊瑚砂中Mg2+溶出的动力学研究发现,其溶解动力学符合Stumm模型,溶解过程主要受扩散作用的影响。
(3)在草酸对珊瑚砂Ca2+溶出的影响中,草酸与珊瑚砂的水岩比相对于草酸浓度对Ca2+溶出的影响更加显著。
(4)在草酸对珊瑚砂溶蚀过程中,优先溶解珊瑚砂中镁方解石,其次是文石和方解石。
