糖基化鳕鱼小清蛋白消化过程中的致敏性
2020-07-26涂宗财胡月明
张 敏 涂宗财 王 辉 刘 俊 胡月明
(1. 南昌大学食品科学与技术国家重点实验室,江西 南昌 330047;2. 江西师范大学国家淡水鱼加工技术研发专业中心,江西 南昌 330022;3. 江西师范大学江西省淡水鱼高值化利用工程技术研究中心,江西 南昌 330022)
食物过敏是常见的免疫系统疾病,由食物中的主要过敏原引起,包括大豆、牛奶、鱼类等,主要症状有哮喘、荨麻疹、腹泻等,严重时会引起过敏性休克。随着鱼类养殖面积和消费量的不断增加,因食用鱼类过敏反应也日益严重[1]。在美国,约有0.4%的成人和0.1%的儿童因食用鱼类而产生过敏[2];在摩洛哥,自述食物过敏发生率中儿童(28.2%)远高于成人(16.8%)[3];在中国,自述因食用鱼类过敏的患病率约为0.20%~2.29%,其中约有95%以上鱼类过敏患者的IgE抗体会与多种鱼类产生交叉反应[4]。
鱼类的主要过敏原是小清蛋白(parvalbumin,PV),其是维持细胞内Ca2+交换的酸性蛋白,分子量约为10.5~12.2 kDa,等电点约为3.9~5.5[5]。国内外在降低PV致敏性方面也做了大量研究,包括糖基化[6]、磷酸化[7]、发酵[8]等改性手段,其中糖基化改性是降低其过敏原致敏性较为有效的方法。糖基化是碳水化合物与蛋白质中α或ε-氨基共价结合形成糖蛋白的过程[9],该反应不需催化剂、加热会产生特殊的色、香、味,常被用于食品加工过程中。李铮[10]对草鱼PV进行糖基化改性后发现,产物的抗原性得到了有效降低;Jongh等[11]研究糖基化对鳕鱼PV的IgE结合力的影响,发现其IgE结合力明显减弱;Zhao等[6]研究发现重组PV经糖基化修饰后其IgG/IgE也显著下降。
但目前关于过敏性的检测都是体外检测,糖基化蛋白进入人体后,需要经过胃和肠消化后才能被人体吸收,而蛋白质在整个消化过程中,胃蛋白酶和胰蛋白酶会通过酶切作用使蛋白质本身的结构被破坏,可能会使消化产物的致敏性发生改变。阿拉斯加狭鳕具有肉质细嫩、口感细腻等特点,受到广大消费者的喜爱。然而糖基化鳕鱼PV经胃肠道消化后致敏性的变化鲜有报道。团队前期研究不同还原糖(葡萄糖、果糖、核糖、乳糖、半乳糖)与PV反应后其IgE和IgG结合能力的变化,发现核糖与PV反应后产物的IgE/IgG结合能力降低程度最大。因此,试验拟选择核糖对PV进行糖基化改性,采用间接竞争ELISA法研究糖基化鳕鱼PV在体外模拟消化过程中致敏性的变化,利用高效液相色谱和光谱学技术分析消化产物分子量和结构的变化,揭示糖基化鳕鱼PV在消化过程中致敏性与结构的变化规律,以期为低致敏性蛋白在人体消化过程中的安全评估提供指导。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
阿拉斯加狭鳕PV:纯度91.36%,实验室自制;
鱼类过敏患者IgE血清:美国PlasmaLab International公司;
兔抗PV的IgG血清:实验室自制;
HRP标记羊抗人IgE、HRP标记羊抗兔IgG抗体:美国Biocheck Inc公司;
D-核糖、4-(2-氨乙基)苯磺酰氟盐酸盐:分析纯,上海阿拉丁生化科技有限公司;
胃蛋白酶:100 U/mg,北京索莱宝公司;
胰蛋白酶:250 U/mg,北京索莱宝公司;
其他材料均为分析纯。
1.1.2 过敏患者血清池
过敏患者血清池由10个鳕鱼过敏患者的血清(P1~P10)组成,其基本信息如表1所示。

表1 鱼类过敏患者病史
1.1.3 主要仪器设备
冷冻干燥机:LGJ-1D-80型,北京亚泰科隆仪器技术有限公司;
酶标仪:Synergy H1型,美国伯腾仪器有限公司;
高速冷冻离心机:GL-20G-II型,上海安亭科学仪器厂;
荧光光谱仪:F-7000型,日本Hitachi公司;
高效液相色谱仪:Primaide型,日本Hitachi公司;
垂直电泳仪:MP4型,美国Bio-Rad公司。
1.2 试验方法
1.2.1 样品制备 称取PV后用超纯水溶解并调整其浓度为5 mg/mL,以核糖∶PV质量比1.5∶1.0混匀后冻干。在65%的饱和NaCl溶液下60 ℃反应1 h,冰浴终止、透析冻干后得到糖基化样品,记作PV-Rib。
1.2.2 模拟人体胃肠道消化 参考沙小梅等[12]的方法稍作修改。用0.5 mol/L的盐酸调节溶液pH至2.0,按酶与样品质量比1∶50加入胃蛋白酶,震荡酶解1 h后用NaHCO3溶液调节pH至7.0,按酶与底物质量比1∶25加入胰蛋白酶,分别震荡酶解1,2 h,用4-(2-氨乙基)苯磺酰氟盐酸盐终止反应。其中PV和PV-Rib经胃消化1 h、胃肠消化2 h、胃肠消化3 h的产物分别记作G-PV-1 h、GI-PV-2 h、GI-PV-3 h、G-PV-Rib-1 h、GI-PV-Rib-2 h和GI-PV-Rib-3 h。
1.2.3 消化率测定 参照Naourez Ktari等[13]的方法,通过测定PV自由氨基含量的变化来反映产物的消化率。
自由氨基的测定参照宋启东等[14]的方法,消化率的计算公式:
(1)
式中:
DH——消化率,%;
OD0——消化后样品的吸光值;
OD1——未消化样品的吸光值;
A——赖氨酸的自由氨基数,mg/mL;
K——标准曲线的斜率;
MW——赖氨酸的分子量,g/mol;
b——消化液的浓度,mg/mL。
1.2.4 IgE和IgG结合能力的测定
(1) IgE结合能力:采用间接竞争ELISA法测定糖基化PV消化后IgE结合能力的变化,产物的IgE结合能力用抑制率来表示,抑制率越低则结合能力越低[15]。在96孔板上加入100 μL 4 μg/mL的抗原,37 ℃孵育1 h;加入250 μL 2%的BSA封闭液,37 ℃孵育2 h;加入50 μL样品(4 μg/mL)后再加入50 μL IgE一抗(1∶500),37 ℃孵育1 h;加入100 μL酶标二抗(1∶600),37 ℃孵育1h;加入100 μL TMB显色液,37 ℃避光孵育15 min;最后加入100 μL 2 mol/L H2SO4终止液,在450 nm/630 nm双波长下读取其吸光值。按式(2)计算抑制率。每个样品做3个平行取平均值。
(2)
式中:
w——抑制率,%;
B——添加竞争性抗原后样品的吸光值;
B0——不添加竞争性抗原样品的吸光值。
(2) IgG结合能力:糖基化PV消化后IgG结合能力测定方法同IgE结合能力测定,一抗稀释度为1∶800,二抗稀释度为1∶5 000。
1.2.5 分子量测定
(1) SDS-PAGE:采用12%分离胶和5%浓缩胶,1×上样缓冲液,上样量为10 μL,超低分子量Marker。初始电压为80 V进入分离胶后调整为100 V,取下后用考马斯亮蓝R250染色15 min,脱色至背景清晰。
(2) HPLC:参照GB 31645—2018,将样品稀释至1 mg/mL后用0.22 μm滤膜过滤。用5%的B相平衡规格为4.6 mm×250 mm的凝胶色谱柱,样品的洗脱条件为进样量10 μL;流速0.5 mL/min;柱温45 ℃;波长220 nm。利用流动相配制相同浓度的标准品:细胞色素C(MW12 384 Da)、抑肽酶(MW6 511.51 Da)、谷胱甘肽(MW612.63 Da)、羟脯氨酸(MW131.13 Da),过0.22 μm滤膜后上样。
1.2.6 荧光光谱测定
(1) 内源荧光:参照Kim等[16]的方法,用蒸馏水配制1 mg/mL样品,用荧光光谱仪测定。扫描速率1 200 nm/min,激发波长295 nm,发射波长扫描范围为200~600 nm,狭缝宽度5 nm。
(2) 同步荧光:用蒸馏水配制1 mg/mL样品,用荧光光谱仪测定。Δλ分别为15,60 nm,其他条件同内源荧光测定。
1.2.7 数据处理 数据采用3次平行试验“平均值±标准偏差”表示,利用IBM SPSS 21.0和GraphPad Prism 8软件对数据、图像进行处理。
2 结果与分析
2.1 自由氨基含量
糖基化前后PV消化率的变化如图1所示。PV-Rib的消化率显著低于PV,随着消化时间的延长,PV与PV-Rib的消化率不断增加,在G-1 h和GI-2 h时增长速率最快,并于GI-3 h时达到最大。说明经糖基化改性后PV的胃和肠消化率均出现下降,可能是胰蛋白酶能对赖氨酸和精氨酸的羧基端肽键进行特异性水解,而糖基化可通过修饰PV的赖氨酸和精氨酸残基,使这些残基无法被胰蛋白酶识别[12]。目前也有研究[17-19]表明经糖基化修饰后乳清蛋白、乳球蛋白、酪蛋白的消化性均出现下降,且下降程度与蛋白特性和还原糖种类有关。
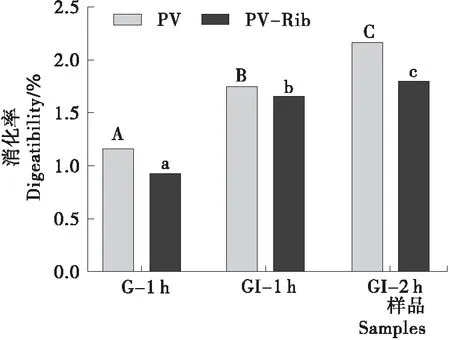
字母不同表示差异显著(P<0.05)
2.2 IgE和IgG结合能力
PV和PV-Rib消化后IgE/IgG结合能力的变化如图2所示。PV-Rib的IgE/IgG结合能力显著低于PV,在二者的消化产物中也观察到同样的变化。在消化过程中PV和PV-Rib的IgE/IgG结合能力出现明显下降,其中G-1 h下降趋势最快,分别降低了42.86%,36.36%和53.42%,30.36%,在GI-2 h时达到最低并在GI-3 h时略有上升,但远低于消化前。由此可见胃蛋白酶对PV和PV-Rib过敏表位的破坏较为明显,同样的结果也在几种淡水鱼小清蛋白的消化产物中被发现[20]。糖基化能通过掩盖或破坏蛋白质分子上的过敏表位来降低其致敏性[21],参与胃肠道消化的蛋白酶也可以通过酶切作用破坏蛋白质的过敏表位,但随着消化时间的延长可能会由于蛋白酶的过度酶切使部分过敏表位被暴露,导致产物的致敏性增加。
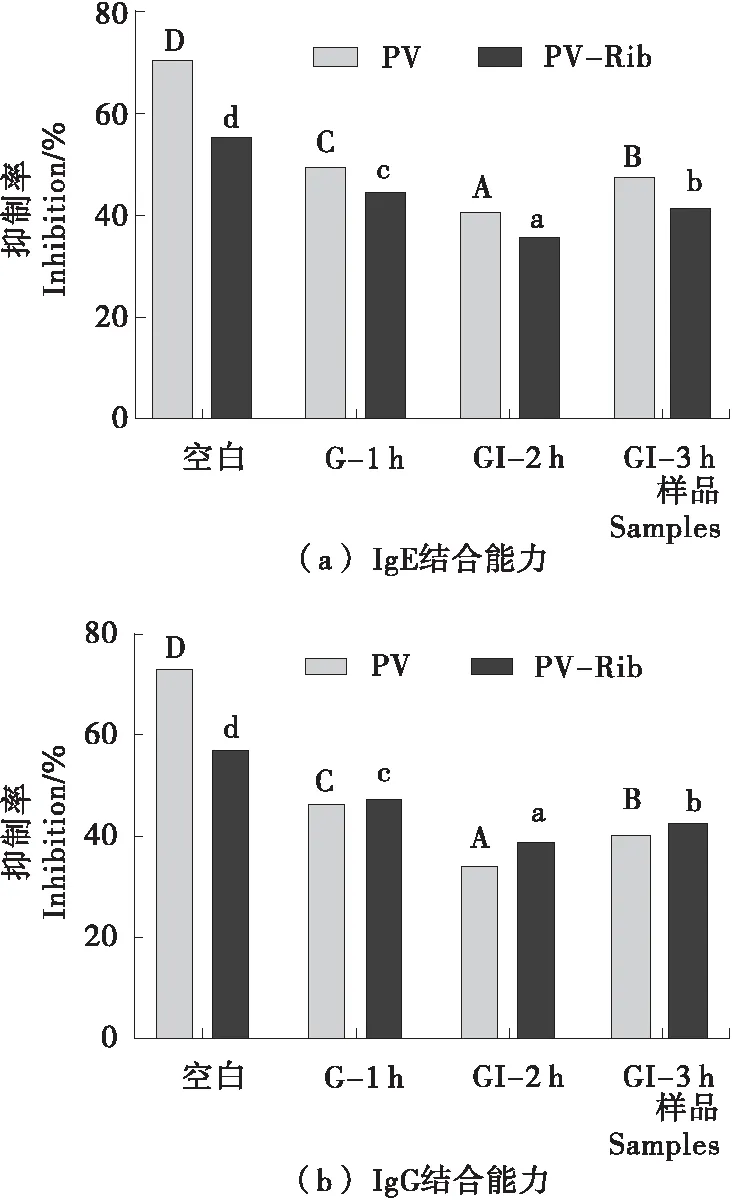
字母不同表示差异显著(P<0.05)
2.3 SDS-PAGE
PV和PV-Rib消化产物的SDS-PAGE如图3所示,对比泳道1,泳道2的蛋白条带出现了明显上移;对比泳道4、6、8,泳道3、5、7的蛋白条带明显较多,泳道5~8的蛋白条带有了明显的降解;对比泳道1、2,泳道3、4出现了分子量较大的条带。糖基化反应中,PV与核糖发生共价交联后分子量会有一定的增加,表现出PV-Rib蛋白条带的上移。但在消化过程中,加入的胃蛋白酶未被完全分解,在SDS-PAGE中表现出新的条带,由于蛋白酶的存在大分子蛋白质被降解,随着消化时间的延长,逐渐被消化成为小分子多肽甚至游离氨基酸,不易在SDS-PAGE中被观察到,且分子量较小的肠消化产物(<3 kDa)容易在凝胶上浸出,为了明确消化产物的分子量分布进行了高效液相色谱试验。
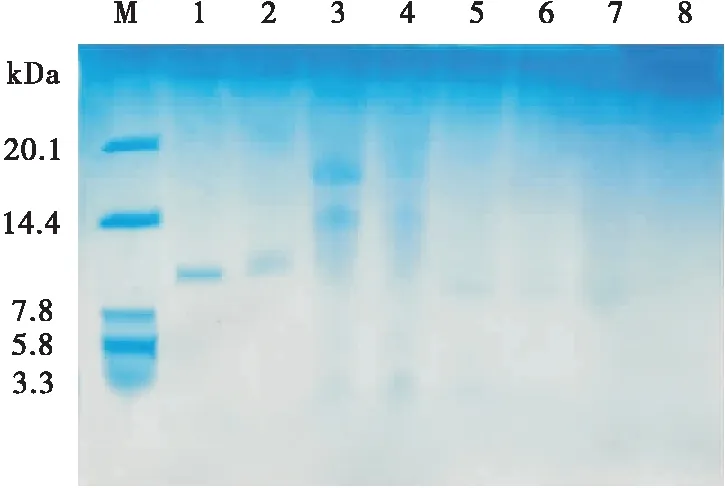
M. Marker 1. PV 2. PV-Rib 3. G-PV-Rib-1 h 4. G-PV-1 h5. GI-PV-Rib-2 h 6. GI-PV-2 h 7. GI-PV-Rib-3 h 8. GI-PV-3 h

图4 PV和PV-Rib消化产物的高效液相图谱
2.4 高效液相色谱
以标准品分子量的对数(lgMW)为横坐标,以保留时间(RT)为纵坐标作线性分析,拟合后得到的方程为:RT=-4.252 6 lgMW+28.128(R2=0.994 7,P<0.05),相关性良好。PV和PV-Rib消化产物的高效液相图谱如图4所示。与PV相比,PV-Rib的出峰时间从11.05 min提前到10.47 min,峰强有所降低;PV和PV-Rib的消化产物在11.05 min和10.47 min处的主峰强度逐渐减弱,出峰时间不断延长,并产生了一系列新的洗脱峰。说明核糖与PV发生共价交联后产物的分子量增加,出峰时间提前,峰强降低。消化过程中,PV和PV-Rib随着消化时间的延长不断被蛋白酶分解,于是出现强度不一的新峰,这也与SDS-PAGE的结果一致。
PV和PV-Rib经消化产物的分子量分布如图5所示,肽段的含量用肽段组分的面积与所有峰面积的比值来表示,按分子量大小将其分为>9 000,7 000~9 000,5 000~7 000,3 000~5 000,1 000~3 000,500~1 000,< 500 Da 7个范围。分析发现PV和PV-Rib经胃消化1 h后>9 000 Da的肽段分别降低了40.0%和31.0%,1 000~3 000 Da的肽段分别增加了13.0%和13.5%;经胃肠道消化2 h后5 000~9 000 Da肽段基本消失;<500 Da肽段的数量先增加后降低。这表明分子量>9 000 Da的肽段对胃蛋白酶的抗消化能力较弱,5 000~9 000 Da的肽段对胰蛋白酶的抗消化能力较弱;在胃蛋白酶作用下产生的<500 Da肽段在胰蛋白酶的作用下重新聚合[22]。分子量<3.5 kDa的肽段一般不具有免疫反应性,但试验发现PV和PV-Rib经消化后仍保持一定的致敏性,在GI-3 h甚至出现了增加,可能也与<500 Da小分子肽段的重新聚合有关。糖基化PV被酶解后分子上的抗原表位被破坏,但依旧有部分线性表位存在,随着小分子肽段的重新聚合,可能又形成了含有某些抗原决定簇的氨基酸序列[23]。
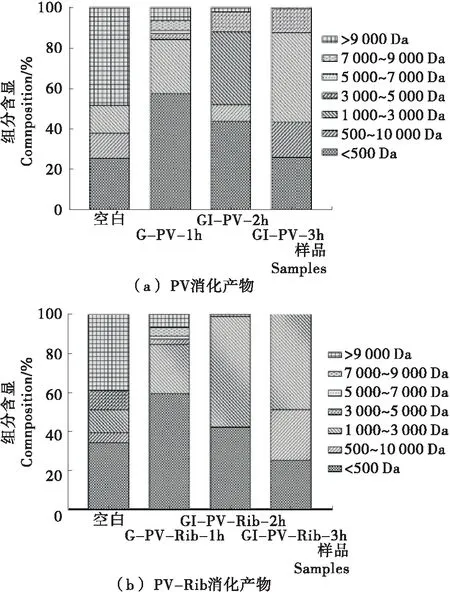
图5 PV和PV-Rib消化产物的分子量分布
2.5 内源荧光
PV和PV-Rib消化产物的内源荧光光谱如图6所示。消化前PV的发射波长在300 nm附近,PV-Rib的发射波长出现红移,消化后PV和PV-Rib在348 nm处有新发射峰,其强度随消化时间的延长先降低后升高。有所不同的是,PV消化产物的发射波长均出现红移,且消化时间与红移程度呈正相关,而PV-Rib只有在新发射峰处出现了红移,在300 nm处却出现蓝移。这些结果表明糖基化后PV的Tyr残基所处微环境的亲水性增加,在消化过程中PV与PV-Rib肽链的结构展开使内部的Trp残基逐渐被暴露,PV-Rib部分消化产物Tyr残基的疏水性增加[24],肽段的重新聚合使二者产物的Trp残基逐渐被掩埋。说明糖基化PV致敏性下降主要是由于核糖对其抗原表位的修饰作用,而消化可进一步破坏其构象表位,随消化时间的延长线性表位也不断减少,但其仍保持一定致敏性,说明小分子短肽的特殊序列依然会使机体对蛋白过敏。
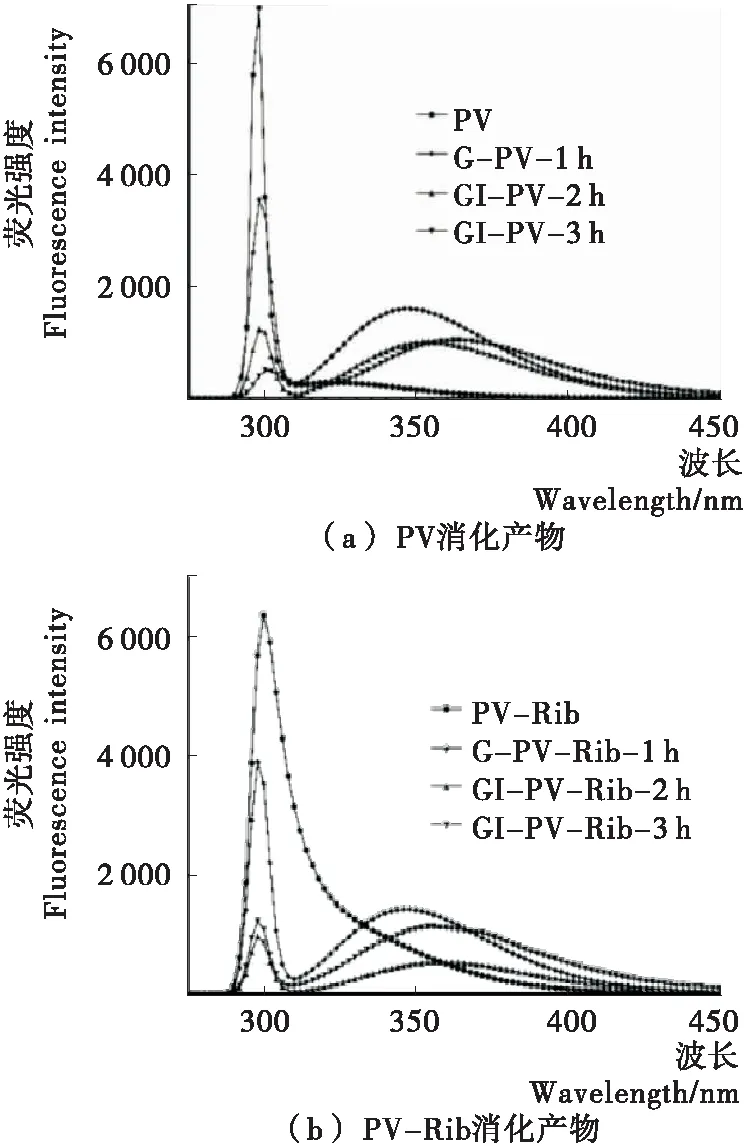
图6 PV和PV-Rib消化产物的内源荧光光谱
2.6 同步荧光
PV和PV-Rib消化产物的同步荧光光谱如图7所示。消化后PV和PV-Rib的Tyr和Trp的荧光强度都出现降低,二者均出现了新的发射峰,发射波长也出现了红移;随着消化时间的延长,Tyr的荧光强度逐渐降低,Trp的荧光强度先增加后降低。消化过程中,PV和PV-Rib的消化产物中Tyr和Trp的微环境发生了变化,并产生了从Tyr到Trp残基的能量转移[25],可能是在消化过程中蛋白质结构的展开使Tyr和Phe的贡献减少[26];PV和PV-Rib分子中的Tyr残基对胃肠道的消化更为敏感,可能与氨基酸的极性有关[27-28]。这些结果也与分子量、致敏性和内源荧光的研究结果一致,表明糖基化和消化都能显著改变PV的构象,通过修饰和破坏其抗原表位来降低PV的致敏性,也进一步说明了糖基化结合胃肠道消化是降低鳕鱼PV致敏性较为有效的方法。
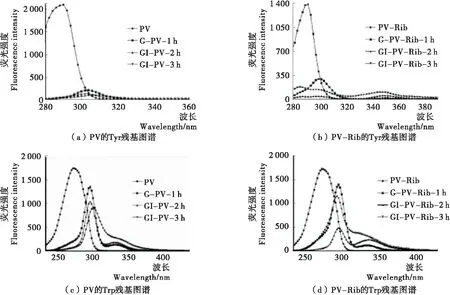
图7 PV和PV-Rib消化产物的同步荧光光谱
3 结论
糖基化鳕鱼小清蛋白经体外模拟消化后发现,胃消化1 h后产物的IgE和IgG结合能力降低速率最快,胃肠消化2 h时最低,3 h略有增加,消化性也出现降低;胃蛋白酶酶解产生的分子量<500 Da的肽段在胰蛋白酶的作用下会重新聚集;产物均产生了新的发射峰和红移,发射峰的荧光强度呈先降低后增加趋势。这表明糖基化改性结合体外模拟消化可有效降低鳕鱼小清蛋白的致敏性。但消化吸收过程中蛋白质的过敏表位会发生显著变化以及消化产物会引起机体在致敏与激发阶段的免疫系统变化还需要进一步研究。
