响应面法优化金枪鱼下脚料双菌发酵制备防腐功能海鲜风味调料的研究
2020-07-25于学娟姜竹茂陈英乡
于学娟,姜竹茂,陈英乡
(1.烟台职业学院,山东 烟台 264000;2.烟台大学,山东 烟台 264005)
金枪鱼是一类具有胸甲的几个属鱼类的总称,是世界上主要的鱼类资源之一[1]。金枪鱼富含蛋白质、脂肪、维生素、氨基酸和微量元素,具有很高的保健价值,并可促进脑的发育,改善记忆力,预防老年痴呆和“三高症”,同时还兼具瘦身美容的功能等[2]。因此,金枪鱼作为营养与健康并存的食物,被加工成各类食品,但在其加工中产生约50%~70%的副产物,金枪鱼副产物中只有少部分被加工成鱼粉等作为饲料出售,绝大多数副产物未被充分开发利用,造成资源浪费,因此迫切需要开拓金枪鱼副产物的增值途径。
水产加工副产物因营养丰富,活性肽类产品制备成为其高值化利用的热点研究。目前,研究人员主要采用酶解工艺对其进行研究开发,探索了活性肽和基于酶解的调味料的生产工艺[3-11]。此方法虽工艺流程简单、容易操作,但酶对水产品蛋白质的降解无法消除其固有的腥味,并且酶解产物易被污染,导致变质,难于储藏。因而,近年来利用发酵法研究水产加工副产物的高值化应用得到人们的关注。发酵法利用微生物与水产下脚料进行固态发酵,可生成具有抗菌、保健等多种功能的活性肽[12-14]。如果能与蛋白肽的液态制备工艺有效融合,不仅可分解水产加工副产物制备基于蛋白肽类的无腥味调味料,同时还可赋予发酵产物抑菌功能,从而获得延长食品货架期的天然调味料。然而,利用微生物开展金枪鱼下脚料发酵工艺及防腐功能海鲜风味调料的研究鲜见报道。
本试验使用金枪鱼下脚料为基质,以水解度为指标,采用纳豆菌和枯草芽孢杆菌进行双菌液态发酵,通过考察单因素试验和响应面(RSM)[15-17]Box-Behnken设计(BBD)对双菌纳豆菌(Bacillusnatto)和枯草芽孢杆菌(Bacillussubtilis)发酵条件进行优化和相关分析,从而确定发酵的最佳工艺参数。利用最佳发酵工艺制备的发酵液生产防腐功能海鲜风味调料,为金枪鱼下脚料的开发利用提供了理论依据。
1 材料与方法
1.1 材料与试剂
金枪鱼下脚料:去除内脏和鱼皮,清洗并绞碎备用,山东蓝润水产有限公司;枯草芽孢杆菌(Bacillussubtilis)、纳豆菌(Bacillusnatto):北京北纳创联生物技术研究院;乙腈(色谱纯):美国Fisher Scientific公司;试验用水均为重蒸水;其余试剂均为分析纯。
1.2 仪器与设备
TSQ Quantum Access HPLC/MS联用仪 美国Thermo公司;HZQ-F160型恒温摇床 金坛市万华实验仪器厂;QB立式压力蒸汽灭菌锅 上海云泰仪器仪表有限公司;SPX-250B-Z型生化培养箱 上海博迅实业有限公司医疗设备厂;UV-2450型紫外-可见分光光度计 日本岛津公司;GB1302电子精密天平 梅特勒-托利多仪器(上海)有限公司;F1-130药物粉碎机 中南制药机械有限公司;TL-250 低速大容量离心机 威海海拓仪器设备有限公司;L-8900全自动氨基酸分析仪(AAA) 日本Hitachi公司;RE-52CS-1 旋转蒸发器 上海亚荣生化仪器厂;Milli-Q Academic 超纯水系统 美国默克密理博公司。
1.3 方法
1.3.1 菌株活化及生产菌液制备
1.3.1.1 纳豆菌活化及生产菌液制备
取甘油封存的纳豆芽孢杆菌菌种,采用平板划线法接种到BPY培养基上,在37 ℃进行24 h倒置培养;再将其接种于营养琼脂斜面,静置培养,24 h活化完成;将活化后的纳豆菌接种于液体培养基中,在温度为37 ℃、摇床频率为120 r/min下培养24 h,测定培养液的OD630至1.2~2.0即得到生产菌液。
1.3.1.2 枯草芽孢杆菌活化及生产菌液制备
取枯草芽孢杆菌冻干粉,将其溶于营养琼脂/肉汁培养基,采用涂布法接种到营养琼脂培养基,在37 ℃进行24 h倒置培养即得活化的枯草芽孢杆菌;将活化后的菌接种于液体培养基中,在温度为37 ℃、摇床频率为150 r/min下培养24 h,培养液的OD630至1.5~2.5即得到生产菌液。
1.3.2 双菌发酵工艺研究与响应面试验设计
1.3.2.1 双菌发酵制备防腐功能海鲜风味调料的工艺流程
将金枪鱼下脚料、麸皮和葡萄糖按15∶4∶1混匀作为发酵基质,装入1 L锥形瓶中,加入一定量水(含水量90%~100%),在温度为121 ℃下灭菌20 min,待冷却至30 ℃,接入纳豆菌和枯草芽孢杆菌生产菌液,然后置于40 ℃生化培养箱中发酵,并每隔4 h搅拌一次,72 h后发酵完成;发酵终产物经过滤,获得防腐功能海鲜风味调料。
1.3.2.2 单因素试验
称取500 g发酵基质,为系统全面地研究双菌发酵制备防腐功能海鲜风味调料工艺,本试验对主要影响变量进行了分析,选取基质水分含量(≤50%、50%~70%、70%~90%、90%~100%、100%~120%、120%~140%、140%~160%)、初始pH值(5.5,6,6.5,7,7.5,8,8.5)、接种量(2,5,8,11,14,17,20 mL/100 g)、双菌接种量比(14∶0、12∶2、10∶4、8∶6、7∶7、4∶10、2∶12)、发酵温度(25,30,35,40,45,50,55 ℃)和发酵时间(36,48,60,72,84,96,108 h)6个变量分别进行单因素试验,研究各因素对防腐功能海鲜风味调料发酵中水解度的影响。
1.3.2.3 响应面试验设计
为系统研究双菌发酵制备防腐功能海鲜风味调料的工艺中各因素对其的影响,以单因素试验条件为基础设计响应面试验,最终选取基质水分含量、双菌接种量比、发酵时间和发酵温度4个因素,设计四因素三水平的BBD试验,试验结果以水解度为指标,响应面试验设计的因素与水平见表1。

表1 响应面试验设计因素与编码水平Table 1 Factors and coded levels of RSM design
2 结果与分析
2.1 双菌发酵金枪鱼下脚料工艺单因素试验结果与分析
2.1.1 基质水分含量对双菌发酵的影响
在初始pH 7.5、接种量14 mL/100 g、双菌接种量比7∶7和发酵温度40 ℃的条件下,发酵基质水分含量分别在≤50%、50%~70%、70%~90%、90%~100%、100%~120%、120%~140%、140%~160%时进行双菌发酵72 h,研究基质水分含量对双菌发酵的影响,结果见图1。

图1 基质水分含量对双菌发酵金枪鱼下脚料水解度的影响Fig.1 Effect of substrate water content on the hydrolysis degree of tuna scraps by double bacteria fermentation
由图1可知,随着基质水分含量的不断提高,金枪鱼下脚料的水解度呈现先增后降的变化趋势,并在基质水分含量为90%~100%时,双菌发酵金枪鱼下脚料达到最高水解度(43.61%)。结果表明,金枪鱼下脚料双菌发酵的水解度与初始基质水分含量直接相关,根据微生物生理特性,水分是微生物生长和代谢的决定因素,基质水分含量低,不利于双菌的生长,导致次级代谢生成的酶量及其活性不足;而基质水分含量过高,阻碍了氧气的传递,抑制了双菌的呼吸生长,限制了双菌的活性和降低了酶的生成量,因此过低或过高的基质水分含量都会降低双菌发酵金枪鱼下脚料的水解度。经SPSS分析,基质水分含量为90%~100%时金枪鱼下脚料的水解度显著大于其余基质水分含量(P<0.05),故最佳基质水分含量选择90%~100%。
2.1.2 初始pH值对双菌发酵的影响
在基质水分含量90%~100%、接种量14 mL/100 g、双菌接种量比7∶7和发酵温度40 ℃的条件下,发酵基质初始pH值分别在5.5,6,6.5,7,7.5,8,8.5时进行双菌发酵72 h,研究基质初始pH值对双菌发酵的影响,结果见图2。

图2 初始pH值对双菌发酵金枪鱼下脚料水解度的影响Fig.2 Effect of initial pH value on the hydrolysis degree of tuna scraps by double bacteria fermentation
由图2可知,在pH 5.5~7.5范围内,随着pH值的升高,双菌发酵金枪鱼下脚料的水解度急剧增高,pH 7.5时水解度达到最大值44.72 %,而在pH大于7.5时,水解度随着pH的增大而快速下降。结果表明,pH值过高或过低均不利于双菌发酵金枪鱼下脚料的水解,这是由于双菌活性受pH的影响,其活性的变化导致分泌酶的能力出现波动,且酶的活性也受pH的影响,在小于或大于最适 pH时酶活降低,因此双菌发酵金枪鱼下脚料的水解度均表现出显著下降(P<0.05),故选择最佳初始pH值为7.5。
2.1.3 接种量对双菌发酵的影响
在基质水分含量90%~100%、初始pH 7.5、双菌接种量比7∶7和发酵温度40 ℃的条件下,发酵基质双菌接种量分别为2,5,8,11,14,17,20 mL/100 g时进行双菌发酵72 h,研究接种量对双菌发酵的影响,见图3。

图3 接种量对双菌发酵金枪鱼下脚料水解度的影响Fig.3 Effect of inoculation amount on the hydrolysis degree of tuna scraps by double bacteria fermentation
由图3可知,随着双菌接种量的增加,金枪鱼下脚料的水解度随之增加,当双菌接种量为14 mL/100 g时水解度达到42.17%,之后双菌接种量再增加,水解度的增量均表现为非显著上升(P>0.05)。这可能是由于菌种浓度的增加,引起微生物的竞争性抑制,最终影响了双菌分泌酶量的减少。考虑到经济效益,选择最佳接种量为14 mL/100 g。
2.1.4 双菌接种量比对双菌发酵的影响
在基质水分含量90%~100%、初始pH 7.5、接种量14 mL/100 g和发酵温度40 ℃的条件下,发酵基质双菌接种量比分别为14∶0、12∶2、10∶4、8∶6、7∶7、4∶10、2∶12时进行双菌发酵72 h,研究双菌接种量比对双菌发酵的影响,结果见图4。

图4 双菌接种量比对双菌发酵金枪鱼下脚料水解度的影响Fig.4 Effect of inoculation amount ratio on the hydrolysis degree of tuna scraps by double bacteria fermentation
由图4可知,随着枯草芽孢杆菌比例的增加,金枪鱼下脚料的水解度先略有增加随后急剧提高,当双菌接种量比为7∶7时,水解度趋向于最佳值41.99%,与其相比,之后水解度的增加量均呈非显著增加(P>0.05)。可能是由于纳豆菌分解蛋白质活性低于枯草芽孢杆菌,但纳豆菌比例降低至一定量时,其生物功能趋于稳定,枯草芽孢杆菌增加到一定量时,其对蛋白质的生物学活性无显著差异(P>0.05)。考虑到经济性,选择最佳双菌接种量比为7∶7。
2.1.5 发酵温度对双菌发酵的影响
在基质水分含量90%~100%、初始pH 7.5、接种量14 mL/100 g和双菌接种量比7∶7的条件下,设置发酵温度分别为25,30,35,40,45,50,55 ℃,双菌发酵72 h,研究发酵温度对双菌发酵的影响,结果见图5。
由图5可知,在25~40 ℃范围内,随着发酵温度的升高,金枪鱼下脚料的水解度不断增加,且增加幅度逐渐提高,在40 ℃时水解度达到峰值43.55%,随后继续升高温度,水解度快速下降。结果表明,温度是影响双菌发酵的重要因素之一,在适宜的温度条件下,菌株生长与代谢旺盛,产生的次级代谢产物和酶数量多且活性高,反之,菌株的活性降低,导致分泌的酶量不足,难以发挥蛋白质的降解作用,故选择最佳发酵温度为40 ℃。

图5 发酵温度对双菌发酵金枪鱼下脚料水解度的影响Fig.5 Effect of fermentation temperature on the hydrolysis degree of tuna scraps by double bacteria fermentation
2.1.6 发酵时间对双菌发酵的影响
在基质水分含量90%~100%、初始pH 7.5、接种量14 mL/100 g、双菌接种量比7∶7和发酵温度40 ℃的条件下,发酵时间分别为36,48,60,72,84,96,108 h时进行双菌发酵,研究发酵时间对双菌发酵的影响,结果见图6。

图6 发酵时间对双菌发酵金枪鱼下脚料水解度的影响Fig.6 Effect of fermentation time on the hydrolysis degree of tuna scraps by double bacteria fermentation
由图6可知,随着发酵时间的延长,金枪鱼下脚料的水解度升高趋势明显,发酵至72 h时,水解度达到42.64%,之后水解度间无显著差异(P>0.05)。这是由于随着发酵时间的延长,基质中菌和酶的含量逐渐增加,基质不断被消耗,导致水解度先缓慢增加后急剧提高,在发酵后期,产物与基质中底物产生竞争抑制或者产物占据酶催化部位导致酶失活,水解度达到平衡。考虑到经济性,选择最佳发酵时间为72 h。
2.2 双菌发酵金枪鱼下脚料工艺优化结果与分析
2.2.1 RSM回归模型及显著性结果与分析
表2中的试验结果采用多元回归拟合,建立响应值(Y金枪鱼下脚料的水解度)与4个因素之间的多元二次回归模型(A双菌接种量比;B发酵时间;C基质水分含量;D发酵温度),其回归模型方程为:Y=41.60+2.47A-1.19B+2.87C+2.12D-3.84AB-2.41AC-2.25AD+1.75BC+3.44BD-3.50CD-1.67A2-2.39B2-0.042C2-2.35D2。

表2 RSM试验设计及结果Table 2 RSM experimental design and results
所得二次多项回归模型方差分析结果见表3。

表3 RSM回归模型方差分析Table 3 The analysis of variance for the fitted regression model of RSM
结果显示:该回归模型的P=0.0001<0.01(属极显著),试验结果和该回归模型高度拟合,表明该回归模型具有极高可靠性;失拟项 P=0.2655>0.05(属不显著),回归模型与试验数据拟合充分,试验误差小,说明试验结果受未知因素干扰很小,也就是说该回归模型可用于分析和预测金枪鱼下脚料双菌发酵工艺条件,且回归模型的R2=0.9915,RAdj2= 0.9830,C.V.=1.46%,说明金枪鱼下脚料水解度的真实值与预测值的拟合度好,回归模型能反映实际情况。另外,回归模型中除C2(P=0.8530)不显著,其余因素(A,B,C,D;A2、B2、D2)与因素之间(AB、AC、AD、BC、BD、CD)的P<0.01,具有极显著影响,也表明回归模型可以很好地描述各因素间与水解度的关系。F值显示:4个因素对水解度的影响大小依次为C>A>D>B,即基质水分含量>双菌接种量比>发酵温度>发酵时间。综上,本试验方法可靠,各因素设计合理,该回归模型可以替代真实试验分析和预测金枪鱼下脚料双菌发酵工艺。
2.2.2 响应面分析
响应面图能直观地反映每个因素对水解度的影响程度,而因素之间交互作用强弱反映水解度响应不同因素变化的敏感度。若等高线为椭圆形反映两因素有相对较强的交互作用,而等高线为圆形则表明两因素有相对较弱的交互作用,另外,等高线密集且间距窄表示因素影响加大,反之因素影响小;响应曲面坡度越大表明水解度对变量的改变越敏感,反之则越迟钝。
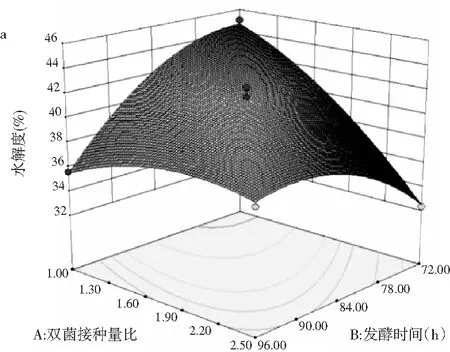


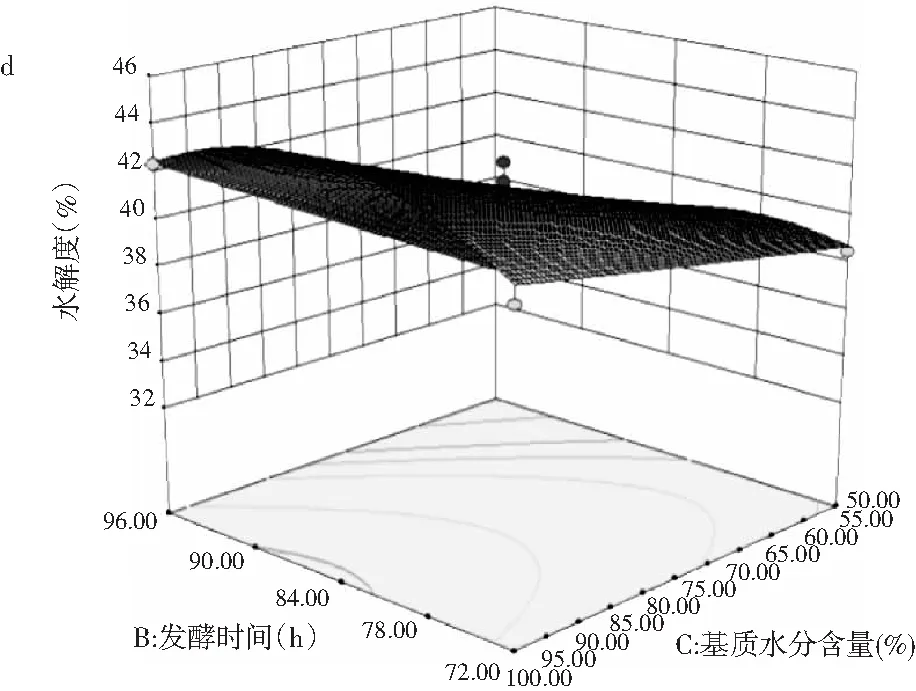

由图7可知,本试验所选4个因素之间交互作用的响应曲面坡度均比较陡峭且弯曲度较大,反映各因素对水解度的影响极显著;等高线显示:沿各因素轴向等高线密集,且趋向于椭圆形,表明4个因素之间交互作用极显著,另外从等高线密集程度与间距宽窄可得各因素影响大小为C(基质水分含量)>A(双菌接种量比)>D(发酵温度)>B(发酵时间),上述结果与表3的回归结果分析一致。图7的响应面均呈现向上凸的曲面,说明水解度存在最大值。通过回归模型方程预测水解度的结果显示:其极值点为A=7∶7,B=72,C=100%,D=40,此时预测的水解度最大值为48.7683%。

图7 各因素交互作用对金枪鱼下脚料水解度的响应面图和等高线Fig.7 The response surface diagrams and contour lines of the interaction of various factors on hydrolysis degree of tuna scraps
2.2.3 双菌发酵最佳优化工艺及验证试验
为确定预测值的可靠性与准确性,依据回归模型优化金枪鱼下脚料双菌发酵的最佳条件,并结合实际生产操作的可行性,最佳工艺参数设定为:基质水分含量90%~100%,接种量14 mL/100 g,双菌接种量比7∶7,发酵温度40 ℃,发酵时间72 h,初始pH 7.5。以此条件进行3次重复试验,结果见表4。

表4 双菌发酵最佳参数及验证试验结果Table 4 The optimum parameters of double bacteria fermentation and the results of verification test
由表4可知,水解度的测定值(48.2912%)与预测值(48.7683%)的误差为0.98%,未表现出显著差异性,说明该RSM模型能替代试验预测双菌发酵的实际情况。
3 结论
以单因素试验为基础,确定发酵温度、发酵时间、双菌接种量比和基质水分含量进行响应面试验设计,优化金枪鱼下脚料双菌发酵制备调味料的工艺,BBD模型拟合与方差分析结果表明:所建回归模型效果极显著,4个因素及两因素之间的交互作用对水解度的影响极显著,各因素的影响大小顺序是基质水分含量(C)>双菌接种量比(A)>发酵温度(D)>发酵时间(B);优化所得最佳工艺参数为基质水分含量90%~100%,接种量14 mL/100 g,双菌接种量比7∶7,发酵温度40 ℃,发酵时间72 h,初始pH值7.5。水解度与预测值无显著性差异,表明RSM模型可替代试验预测双菌发酵制备调味料的实际情况。
