芽菜中高效降解亚硝酸盐菌株的分离鉴定
2020-07-24黄雪芹左勇张强杨建飞徐佳秦世蓉何颂捷
黄雪芹,左勇,2*,张强*,杨建飞,徐佳,秦世蓉,何颂捷
(1.四川轻化工大学 生物工程学院,四川 宜宾 643000;2.四川师范大学生命科学学院,成都 610101)
宜宾芽菜是中国“四大特色酱菜”之一[1],历史悠久、风味独特,含有丰富的氨基酸、蛋白质、维生素等营养成分。在腌制过程中,由于微生物的作用,发酵产生有机酸、醇类、酯类等风味物质,使芽菜香、脆、甜、嫩、美味可口,深受消费者喜欢。
芽菜原料是芥菜的嫩茎,新鲜芥菜中亚硝酸盐主要来源于土壤中固有氮和氮肥,经芥菜吸取后以硝酸盐的形式储存,在大肠杆菌、副大肠杆菌等有害菌产生的硝酸还原酶作用下,被还原成亚硝酸盐。亚硝酸盐具有很强的毒性,一般人体摄入0.3~0.5 g就会引起中毒[2,3],我国国标GB/T 5009.33-2003中规定酱腌菜中亚硝酸盐小于20 mg/kg[4]。酱腌菜中亚硝酸盐的降解,主要方法有物理(合理降低氮肥使用量)、化学(花色苷、抗坏血酸等对亚硝酸盐的清除作用)和微生物降解。目前,研究最多的是利用可降解亚硝酸盐的微生物或其产生的亚硝酸还原酶(NiRs)来降低亚硝酸盐[5,6]。
芽菜中主要的功能菌是细菌,包括产酸类细菌、嗜盐类、乳酸菌类、芽孢杆菌属等[7-9]。芽菜在发酵期间的亚硝酸盐含量先增加达到亚硝峰后再降低,发酵后熟阶段含量远低于国家标准[10],这可能与芽菜中富含高效降解亚硝酸盐菌株有关,但是关于这些菌株却鲜有报道。本研究采用微生物方法从发酵芽菜中分离、筛选具有亚硝酸盐高效降解的菌株,以期丰富酱腌菜中降解亚硝酸盐的微生物类型,同时为后期研究制作酱腌菜中亚硝酸盐发酵菌剂提供了理论菌种基础。
1 材料与方法
1.1 样品与试剂
芽菜:取自某芽菜食品有限公司。
主要试剂:DP336细菌试剂盒、硝酸钾、亚硝酸钠、盐酸萘乙二胺、对氨基苯磺酸、革兰氏染色剂。
1.2 培养基[11]
分离培养基:MRS培养基、牛肉膏蛋白胨琼脂培养基、PDA培养基。
种子培养基:相应的液体分离培养基。
基础产酶培养基:含亚硝酸钠(作为亚硝酸还原酶的诱导物)的液体分离培养基。
1.3 试验方法
1.3.1 亚硝酸盐的测定及标准曲线的制作
盐酸萘乙二胺分光光度法[12]。
1.3.2 菌株的分离纯化
从芽菜厂取样并真空保存,样品取回后在无菌条件下称取芽菜10 g,加入90 mL无菌生理盐水(NaCl 0.85%)中,(37±1) ℃,100 r/min恒温培育过夜后,制备成10-1~10-6的稀释液,各取0.1 mL均匀涂布于含亚硝酸盐的3种分离培养基上,每一梯度样品做3个平行,(37±1) ℃下于恒温箱中培养至长出明显菌落后,挑取单菌落,再用平板划线法纯化,在相应的固体培养基斜面上于4 ℃冰箱保存。
1.3.3 亚硝酸盐降解菌初筛
将分离纯化得到的菌株制成种子菌悬液,按1%(V/V)接种量接种于浓度为200 μg/mL NaNO2的液体培养基(装液量50 mL/250 mL)中,(37±1) ℃恒温培养24 h,培养结束后取1 mL培养液进行显色反应[13],观察颜色变化,以不加菌种的试管为颜色对照(CK)。
由于在弱酸条件下,亚硝酸盐与对氨基苯磺酸重氮化后,再与盐酸萘乙二胺耦合形成紫红色染料,故选择颜色较浅的进行复筛。
1.3.4 亚硝酸盐降解菌复筛
将初筛得到的菌株制成种子菌悬液,以接种量为1%(V/V)接种于浓度为400 μg/mL NaNO2的液体培养基(装液量100 mL/250 mL)中,(37±1) ℃摇床振荡培养,在培养时间为12,24,36,48,60,72 h时取样,于12000 r/min离心1 min除去菌体,取上清液在波长538 nm处检测亚硝酸盐剩余量(NE,μg/mL)[14],计算剩余亚硝酸盐含量和降解率。以含200 μg/mL NaNO2未接种的培养基为对照(CK)(NC,μg/mL)。
降解率=(NC-NE)/NC×100%。
1.4 菌株的鉴定
1.4.1 菌体形态学鉴定
菌体、菌落形态观察[15]:将菌株接种于培养基上,于37 ℃培养箱中培养24 h后观察并记录菌落的生长情况、颜色和大小、形态、表面、边缘、隆起形状、透明度等。
革兰氏染色[16]:挑取单菌落进行革兰氏染色,细胞保留初染剂(蓝紫色)的细菌为革兰氏阳性菌,细胞中初染剂被脱色剂洗脱而染上复染剂的颜色(红色)的细菌为革兰氏阴性菌。
1.4.2 分子鉴定
细菌采用16S rDNA分子鉴定[17]:液体培养基,37 ℃、180 r/min 条件下振荡培养16 h,收集菌液,细菌总DNA提取按照DP336试剂盒所提供的提取方法进行。以提取得到的基因组DNA作为PCR扩增模板。反应体系50 μL,将PCR扩增后的产物进行琼脂糖凝胶电泳,结束后用凝胶成像仪观察条带,将观察到的目的条带进行切胶处理,用DNA胶回收试剂盒进行切胶回收。
细菌通用引物(27F:GAGAGTTTGATCCTGGCT,1492R:TACGGCTACCTTGTTACGAC),以细菌的总DNA为模板进行PCR扩增。
真菌采用核糖体ITS rDNA区的通用引物ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′,以菌株的总DNA为模板进行PCR扩增[18]。
反应体系(50 μL):DNA 模板为1 μL,PF(10P)1 μL,PR(10P)1 μL,Mix酶25 μL,ddH2O补加至50 μL。扩增程序:98 ℃变性3 min;98 ℃10 s;55 ℃15 s;72 ℃ 20 s,39个循环;72 ℃延伸5 min,保持4 ℃。
PCR产物经切胶回收后,送至专业检测机构(擎科生物技术有限公司)进行测序。
1.4.3 DNA测序和系统发育树的构建
将测得的16S rDNA序列在NCBI 网站(https://www.ncbi.nlm.nih.gov/)上使用BLAST程序在GenBank基因库上进行同源性分析,选择相似性较高的序列,采用MEGA 6.0软件构建系统发育树[19]。
2 结果与分析
2.1 亚硝酸盐降解菌初筛
采用3种不同的培养基,挑选5个不同发酵阶段的芽菜样品进行菌株筛选,共选出53个能在含亚硝酸盐培养基上生长的单个菌落,经过初筛的显色反应,筛选出颜色较深的菌株33株,较浅的菌株共20株,部分菌株的显色结果见图1,说明这些菌株都具有降解亚硝酸盐的能力,只是强弱不同,且部分颜色较浅的菌株具有较强的降解能力。

图1 显色反应颜色深浅对比图Fig.1 Color contrast diagrams of chromogenic reaction
2.2 亚硝酸盐降解菌株复筛
2.2.1 亚硝酸盐标准曲线的制作
为定量检测亚硝酸盐的含量,以亚硝酸盐的浓度为横坐标,以波长538 nm处的吸光度OD值为纵坐标作图,绘制亚硝酸盐浓度标准曲线,见图2。
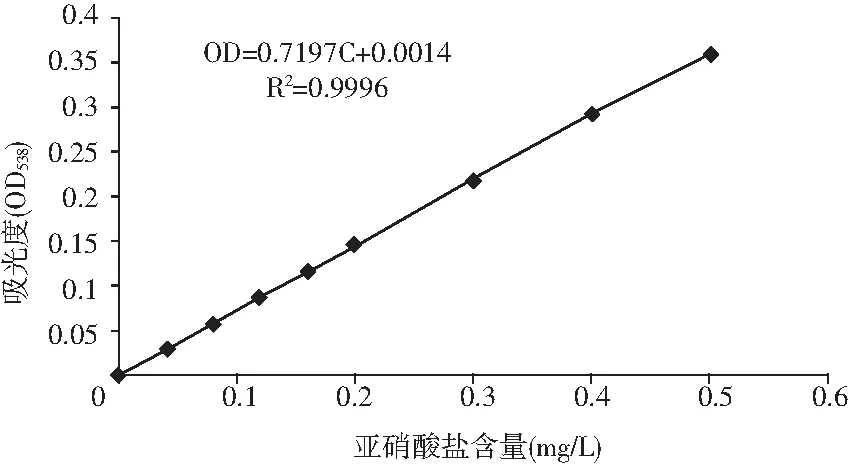
图2 亚硝酸盐浓度标准曲线Fig.2 The standard curve of nitrite content
由图2可知,在波长538 nm处,0~0.6 mg/L的浓度范围内,亚硝酸盐浓度C和吸光度OD值呈良好的线性关系,满足方程OD=0.7197C+0.0014,R2=0.9996。
2.2.2 菌株降解亚硝酸盐结果
对显色较浅的20株菌进行亚硝酸盐72 h降解能力的测定,结果表明,有12株菌的降解率较高,亚硝酸盐在72 h内各菌株的降解情况及降解率结果见图3和图4。

图3 培养液中亚硝酸钠浓度随培养时间变化趋势Fig.3 The variation trend of sodium nitrite concentration in culture solution with cultivation time
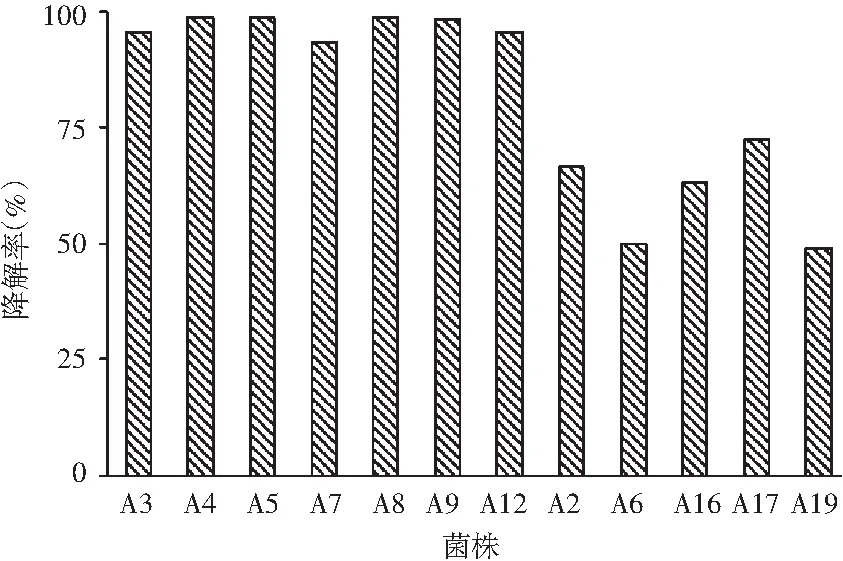
图4 分离菌株对亚硝酸盐降解率的比较Fig.4 The comparison of isolated strains on degradation rates of nitrite
由图3和图4可知,筛选得到亚硝酸盐降解率很高的7株菌株A3、A4、A5、A7、A8、A9、A12,在培养72 h后的降解率均达到95%以上。其中A5、A7在浓度为400 μg/mL NaNO2的液体培养基中培养24 h时降解率最快,且在培养72 h后降解率接近100%。
2.3 菌落形态及菌体特征
通过分离、纯化、筛选,将从芽菜中筛选出的亚硝酸盐降解能力较强的7株菌株进行菌落形态学特征鉴定、革兰氏染色,结果见表1。
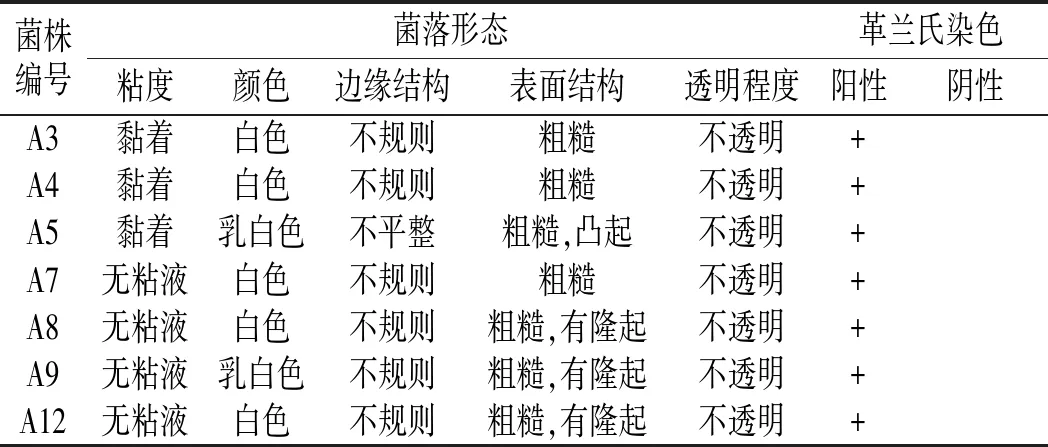
表1 菌落形态和革兰氏染色鉴定表Table 1 The identification results of colony morphology and gram staining
各菌株稀释10-6倍后,第2天在培养基上开始生长出单菌落,初步判断菌株能在含亚硝酸盐培养基上生长。A3、A4的单菌落形态特征基本相同,白色菌落,表面粗糙,黏着,不规则;A5、A7菌落形态不同(见图5)。A8、A9、A12单菌落形态特征基本相同,乳白色,表面粗糙,隆起,不规则。结合菌落形态和革兰氏染色结果都为阳性,初步判断7株菌皆为细菌。
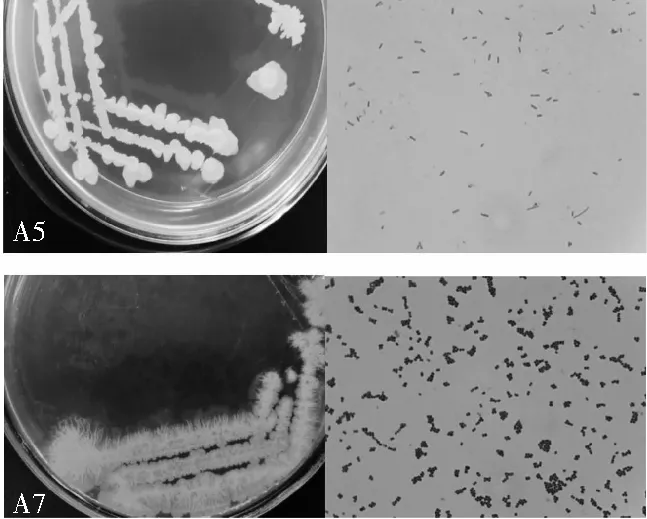
图5 A5(上)与A7(下)菌株在平板上的培养特征及显微形态Fig.5 Culture characteristics and microscopic morphology of strains A5(up) and A7(down) at the plate
2.4 系统发育分析和分子生物学点鉴定结果
2.4.1 亚硝酸盐还原菌株16S rDNA的PCR扩增
将降解能力最强的7株菌株进行16S rDNA扩增,经扩增后的PCR产物进行1%琼脂糖凝胶电泳(150 V、100 mA、20 min),电泳结果见图6(电泳图M:DL2000 DNA Ladder)。

图6 亚硝酸盐还原菌株16S rDNA PCR产物琼脂糖凝胶电泳Fig.6 Agarose gel electrophoresis of nitrite-reducing bacteria 16S rDNA PCR products
由图6可知,经1%琼脂糖凝胶电泳后,各菌株得到的特异性条带片段大小均在1000~2000 bp之间。
2.4.2 亚硝酸盐还原菌系统发育树构建
将7株菌株的PCR产物送至擎科生物技术有限公司进行测序,将16S rDNA测序结果在NCBI GenBank基因文库中进行比对,选择相似性不小于99%的序列,使用MEGA 6.0构建系统发育树,结果见图7。

图7 菌株进化树Fig.7 Phylogenetic tree of bacterial strains
经过序列的BLAST比对显示,7株菌株均属于芽孢杆菌属的一个种。利用MEGA 6.0软件构建系统发育树,并结合形态特征,确定菌株A3、A4同为芽孢杆菌(Bacillussp.);A5为枯草芽孢杆菌(Bacillussubtilis);A7为贝莱斯芽孢杆菌(Bacillusvelezensis);A8、A9、A12同为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。
3 结论
本研究通过菌株降解能力测定,从几个不同发酵阶段的芽菜中分离、筛选具有高效降解亚硝酸盐能力的菌,并通过形态学和分子生物学鉴定,结果显示筛选得到的高效降解亚硝酸盐的菌株皆为芽孢杆菌属。且培养72 h后7株菌的降解率都接近99%。
芽孢杆菌是一种具有丰富酶系、除氮能力的异养型细菌,能快速高效地分解外界环境中的污染物、蛋白质及水溶性有机物。关于芽孢杆菌降解亚硝酸盐,报道最多的是应用于水体养殖和水污染治理等方面。但本试验从芽菜中筛选出高效降解亚硝酸盐的芽孢杆菌属,说明在酱腌菜的发酵生产中芽孢杆菌在降解亚硝酸盐方面具有很大的作用。为后期研究利用菌株产亚硝酸还原酶降解酱腌菜中的亚硝酸盐提供了可行性菌种。
