儿童超说明书用药的伦理实践
2020-07-24吴柳娟柳龚堡陆毅群
吴柳娟,柳龚堡,史 雨,陆毅群
(1.国家儿童医学中心(上海),上海 201102; 2.复旦大学附属儿科医院医务部,上海 201102; 3.复旦大学附属儿科医院伦理委员会,上海 201102)
超说明书用药是药物的使用超出国家药品监督管理部门批准范围,包括超出药品说明书适应证、适用年龄、给药途径以及剂量的用药[1-2]。我国0~14岁的儿童数占全国总人口数的16.6%,而我国所有药物制剂中专用于儿科的品种却不足2%[3]。因此,虽然超说明书用药在医疗机构的任何科室都能见到,但尤以儿童、妊娠期妇女等特殊人群居多。国内一项调查数据显示,儿科门诊超说明书用药处方所占比例为53%~82.7%,住院超说明书用药医嘱所占比例为46.9%~95%[4]。2013年,国内另一项研究结果显示,出生0~27 d患儿发生超说明书用药的比例最高[5]。美国学者的研究结果也显示,94%的超说明书用药患儿存在1种以上药品的超说明书用药[6]。意大利学者针对新生儿用药情况的分析结果显示,37.4%属于超说明书用药[7]。
儿童超说明书用药的主要风险有:(1)立法不明确,虽然有关部委先后制订了多部规范药品使用的相关法律法规,例如《处方管理办法》《药品管理法》和《药品管理法实施条例》等,但都未明确规定超说明书用药的法律地位[8]。目前,我国有众多医药学组织、学会颁布的指南、专家共识,但都未通过国家卫生行政部门和立法机关认可,缺乏足够的法律效力。超说明书用药的临床医师和医疗机构处于法律风险中。(2)用药风险增加。儿童器官功能不成熟,药物吸收、分布、排泄与成人有很多不同,很多患儿按照“小儿酌减”的原则服用成人药,存在着极大的安全隐患,不仅难以保证儿童准确的用药量,还可能因随意改变药物原有剂型导致药效降低,增加不良反应。研究结果发现,与常规用药比较,儿科患者超说明书用药所致的不良反应发生率显著升高[9];婴儿期超说明书用药不良反应发生率高达30.56%[10]。因此,儿童超说明书用药的安全问题是一个严峻的问题。
儿童超说明书用药可造福患儿,但也存在着很大的风险。在儿童超说明书用药实践中需要权衡可能的风险与预期的受益,既要让患儿得到合理的药物治疗,又要规避超说明书用药的潜在风险,伦理审查尤为重要。目前,我国暂无关于儿童超说明书用药伦理审查的总结性文献,指导性文献也较少。复旦大学附属儿科医院(以下简称“我院”)自2012年6月起开展儿童超说明书用药的伦理审查后,积累了一定的审查数量,现就我院儿童超说明书用药的伦理审查实践报告如下。
1 资料与方法
1.1 资料来源
资料来源于2012年6月至2019年6月我院伦理委员会审查的83份超说明书用药申请。
1.2 方法
采用回顾性研究方法,从超说明书用药类型、科室、疾病、药品种类和审查结果5个方面对已审查的超说明书用药的临床治疗申请进行分析汇总。
1.3 申请及审查流程
临床科室根据需求提出申请,填写《超说明书用药的伦理申请表》,申请书中需写明超说明用药的理由、适应证、治疗方案、用法与用量、依据、疗效、可替代药物及不良反应等,并附上国内外安全性和有效性的文献依据、知情同意书样张以及药品说明书。伦理委员会秘书受理后,安排会议审查,会上由申请医师汇报并答疑,伦理委员充分讨论后,投票表决。审查结果包括同意、修改后同意、修改后再审和不同意,申请医师根据修改后同意和修改后再审的意见修改或补充资料后复审,不同意则需向申请医师阐明理由,见图1。
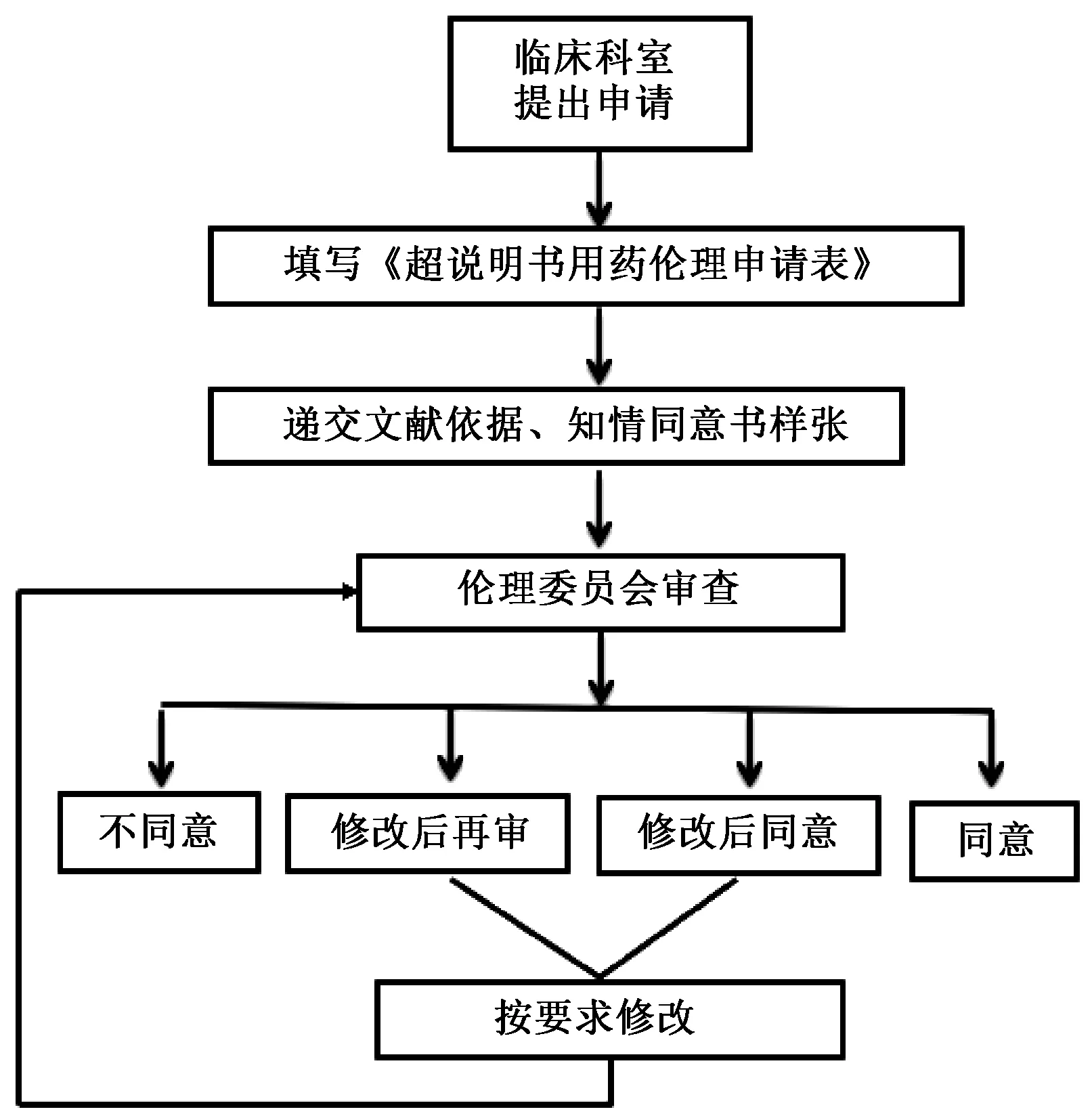
图1 超说明用药伦理申请与审查流程Fig 1 Process of ethical application and review of off-label drug use
2 结果
2.1 申请伦理审查的超说明书用药类型
83份超说明书用药申请中,超给药途径申请5份(占6.02%),超适应证申请46份(占55.42%),超年龄申请57份(占68.67%),其中同时超适应证和超年龄的申请有25份(占30.12%),无超剂量申请,见图2。可见,儿童超说明书用药伦理申请主要集中于超适应证和超年龄,而超年龄申请最多。由于儿童药物临床试验的缺乏,很多药品说明书中均无儿童用药信息,药品说明书中儿童用药常以“在儿童患者中的安全性和有效性尚未建立”来描述。
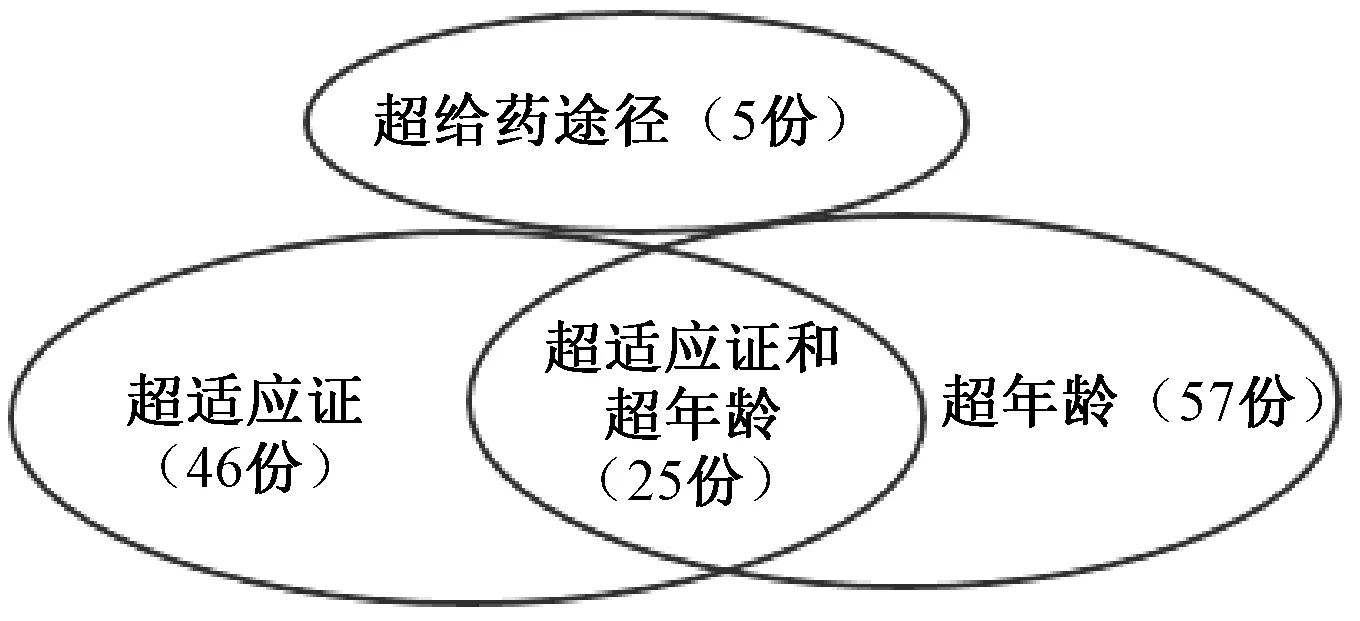
图2 申请伦理审查的超说明书用药类型Fig 2 Types of ethical applications for off-label drug use
2.2 各科室超说明用药伦理申请情况
我院有22个临床科室申请过超说明书用药,占全院临床科室总数的81%,可见儿童超说明书用药在临床治疗中存在普遍性和必要性。其中,风湿科、神经内科、肿瘤外科和新生儿科的申请数量居多,分别占15.66%、14.46%、9.64%和8.43%,上述4个科室超说明书用药申请数合计占48.19%,见表1。

表1 各科室超说明用药伦理申请情况Tab 1 Numbers of ethical applications for off-label drug use in various clinical departments
2.3 超说明用药的疾病分类
申请超说明书用药的病种主要为系统性红斑狼疮、幼年特发性关节炎及白塞病等风湿类疾病,癫痫、结节性硬化症、自身免疫性脑病及肌无力等神经系统类疾病,恶性实体肿瘤,新生儿胃食管反流、新生儿过敏及新生儿感染等新生儿疾病,脓毒血症、支原体等感染性疾病,抽动障碍、周期性呕吐、儿童行为障碍及儿童焦虑障碍等儿童心理疾病,基因缺陷或突变、慢性肉芽肿病及慢性活动性EB病毒感染等免疫系统疾病,大部分是临床症状较重、难治和慢性疾病以及近年来在治疗方面有新进展的疾病,见表2。
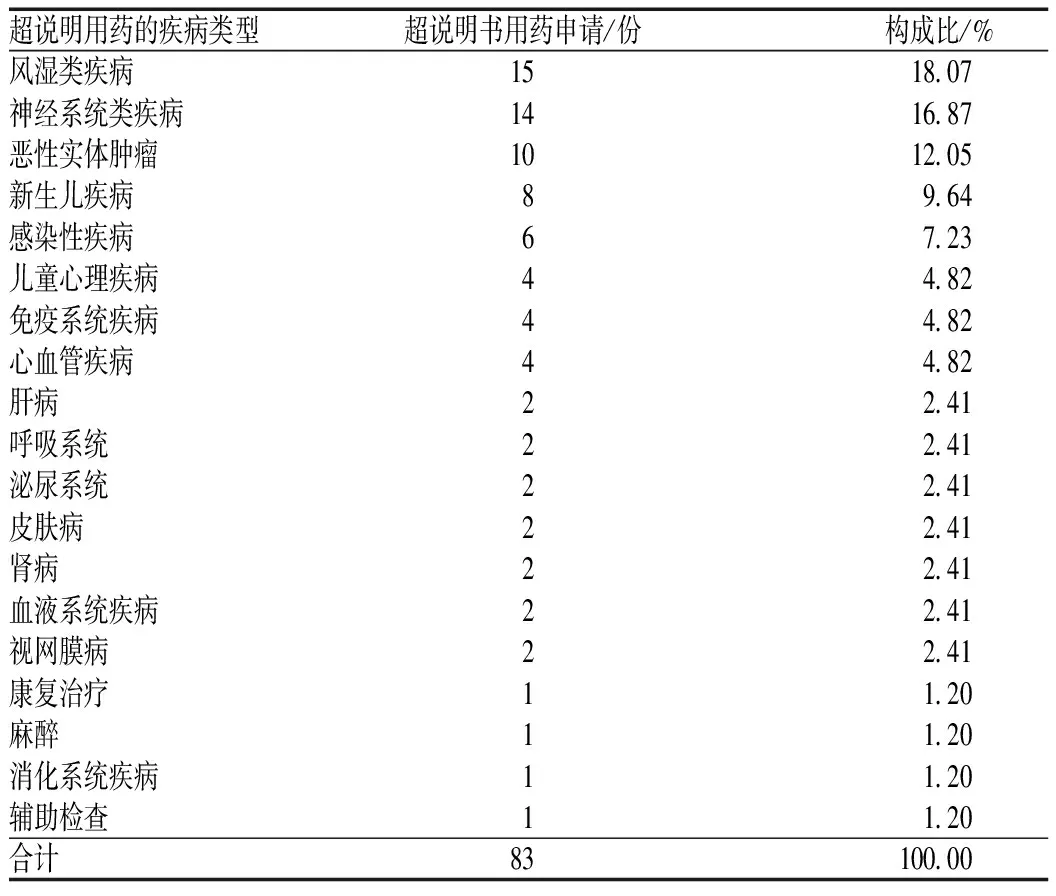
表2 超说明用药的疾病分类Tab 2 Distribution of types of diseases of off-label drug use
2.4 超说明用药涉及药品种类分布
超说明书用药申请数最多的为生物制剂,其次是抗菌药物、免疫抑制剂、抗癫痫药、抗精神病药、抗过敏药、补磷酸盐及激素等,见表3。提示临床上超说明书用药情况较多的为各种生物制剂及免疫抑制剂的超适应证、超年龄使用。
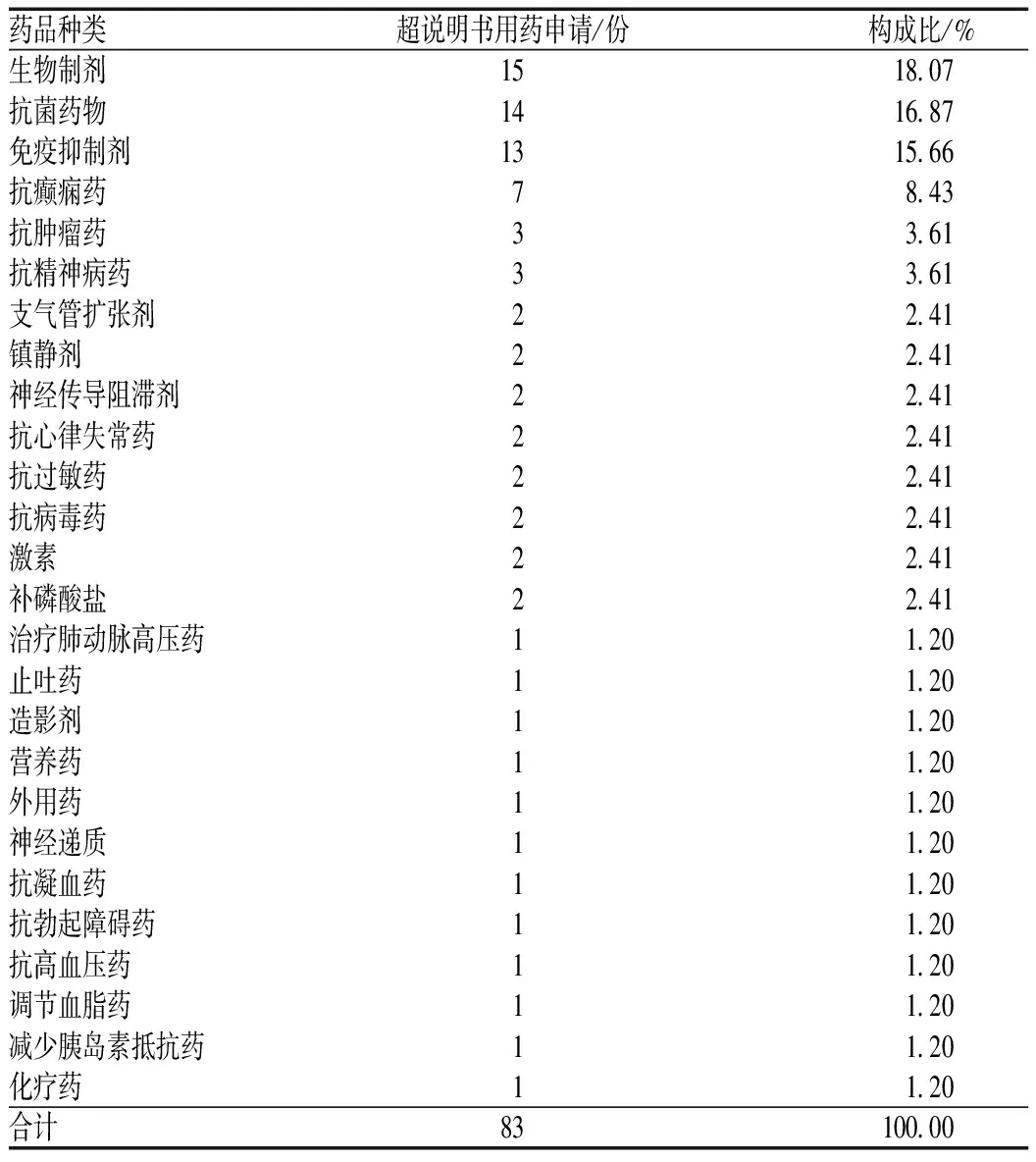
表3 超说明用药涉及药品种类分布Tab 3 Distribution of categories of drugs of off-label drug use
2.5 超说明用药的伦理审查结果
经伦理委员会审查,83份超说明书用药申请中,初始审查同意59份(占71.08%),修改后同意21份(占25.30%),不同意3份(占3.61%),见图3。21份修改后同意的申请中共29例次修改意见,主要包括:需明确超说明用药的适应证、用药方法(6例次,占20.69%);补充国内外儿童用药的文献依据支持(1例次,占3.45%);知情同意书中需告知超说明书用药(10例次,占34.48%);知情同意书中需告知药品不良反应(5例次,占17.24%);知情同意书中需告知替代药物/治疗方法(4例次,占13.79%);知情同意书需简明扼要、通俗易懂(3例次,占10.34%),见图4。不同意的理由主要为临床无用药经验、无文献依据以及有替代药物可使用。可见,确保药物使用的科学性、合理性和必要性,重视患者的知情权,是伦理重点考量的内容。
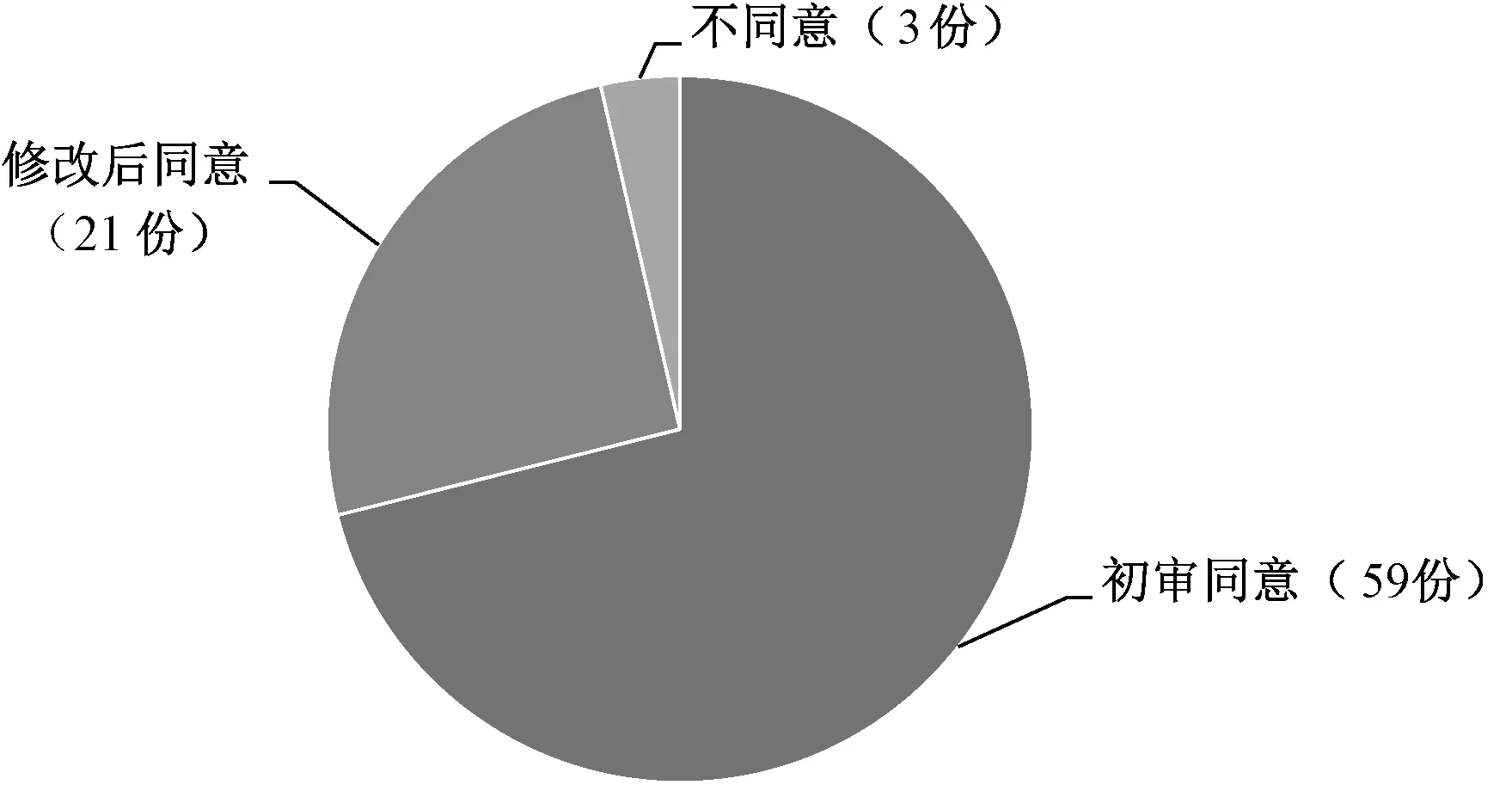
图3 超说明用药的伦理审查结果Fig 3 Results of ethical review of off-label drug use
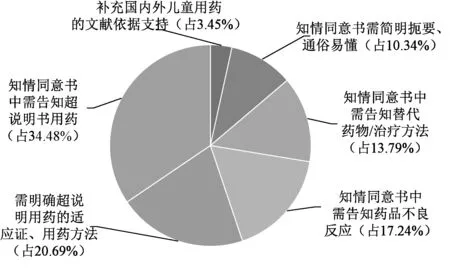
图4 超说明用药申请修改后同意的意见Fig 4 Opinions agreed upon after revision of application for off-label drug use
3 讨论
从我院超说明书用药的伦理申请概况可以看出,儿童超说明书用药是临床诊疗的实际需求,但在临床使用过程中也涉及到了很多伦理问题,伦理委员会从保护患者利益出发,以科学的视角和控制风险为主要目的进行审查。
3.1 严格把控超说明书用药伦理申请指征
在伦理审查时,需严格把控超说明书用药的申请指征,即超说明书用药的目的是为了患者的利益,是为了治疗危及患者生命且无其他合理治疗方案或替代药品的疾病状态。超说明书用药应当限于无合理可替代药品的前提下,如果市场存在可替代药品,应当优先选择该药品,而不应当超说明书用药[11]。
超说明书用药同时可以提高企业销售利润,据美国某研究机构2003年发布的报告,该机构所调查的15个类别的药品中销售金额排序居前3名的药品,其销售金额的21%来自超说明书用药[12]。因此,确实需要防止各种利益博弈等复杂因素参与超说明书用药的伦理审核过程。美国食品药品管理局(food and drug administration,FDA)认为,允许药品生产者提供超说明书用药信息等同于鼓励其越过FDA的新药申请流程,因此,FDA禁止制药公司向公共推广药品说明书之外的用法[13-14]。伦理审核机构一定要严格审核超说明书用药的动机,考量诊疗决策的恰当与否,超说明书用药是否符合患者利益的最大化,同时风险也在可控范围内,只有在相对风险最小、利益最大的前提下进行的超说明书用药,才是符合伦理的。
3.2 严格审核超说明书用药的科学性,应有充分的循证医学证据和临床实践依据
严格审核超说明书用药支持的证据,掌握超说明书用药的文献和循证学证据,预先评估安全性和有效性。2011年,FDA就超说明书用药向临床研究人员发布指南,强调医师必须在说明书之外用药时,要充分掌握所用药品的药理信息,找到效力高的证据支持,及时记录用法、用量和疗效等。美国药师协会在《美国医院处方药物服务信息》中也详细收录了药物的超说明书用法及相应的支持证据。此外,美国《医疗保险福利政策手册》还给出了评议文献资料证据的标准。英国药物与保健品管理局、德国联邦药品法、荷兰药物审评监管机构及中国广东省药学会等均指出,医师超说明书用药时,应当掌握科学、全面的医学证据[15-17]。因此,开展超说明书用药的伦理审查时,需要重点关注所提供的超说明书用药的循证依据的可靠性,包括在目标适应证中该药的有效性依据,如作用机制、文献资料、动物研究资料或人体试验性治疗的相关应用结果;其次是药物的安全性依据,如最小中毒剂量、药动学特点及药品不良反应等信息,从而降低副作用造成的风险。
3.3 做好患者知情同意
知情同意原则目前被认为是医疗活动中必须遵循的最基本原则,体现了医患互动、沟通的关系以及医患之间平等的权利、义务关系,也体现了对患者的尊重和保护。尊重患者是基本的伦理原则,主要体现在对超说明书用药的必要性、可能的风险、不良反应、放弃此方案的可能后果和替代方案等信息以通俗易懂的语言充分告知患儿监护人,使对方在完全理解的基础上做出是否接受超说明书用药的选择,遵循自愿的原则。
由超说明用药伦理审查结果可见,修改后同意的超说明用药申请中接近76%的知情同意书是有欠缺的,临床医师对超说明书用药可能出现的风险及药品不良反应简要带过,甚至不提,同时夸大药品疗效和获益,影响患者的自主判断。通过伦理委员会的审查,完善知情同意书,确保患者的知情权,尊重患者的选择权,降低医患风险,对于减少超说明书用药带来的医疗纠纷大有裨益。《侵权责任法》第五十五条规定,需要实施手术、特殊检查、特殊治疗的,医务人员应当及时向患者说明医疗风险、替代医疗方案等情况,应向患者或者近亲属充分说明,并取得其书面同意。超说明书用药属于特殊治疗,需要在对患者进行充分说明和告知的情况下签署知情同意书。美国、新西兰、英国和其他欧洲国家均明确规定,在超说明书用药前必须获得患者的知情同意[18-20]。
3.4 伦理审核通过并不能代表超说明书用药可被允许应用于临床
伦理审核关注的是患者的权益保护,重点的内容包括药物不可替代性、患者知情内容是否充分等,但是,伦理审核并不能取代药事管理委员会的临床专家们从专业角度作出的审核。《中国儿科超说明书用药专家共识》提出,超说明书用药需同时经伦理委员会和药事管理委员会审查通过后,才能被批准应用于临床[2]。
综上所述,儿童作为特殊人群,其超说明书用药情况较多,而临床医务人员对超说明书用药的法律意识及风险估计不足,因此,需要加强超说明书用药的伦理审查,严格把控风险,规范临床操作,保护患儿权益,减少医疗纠纷。
