右美托咪定调控PI3K/Akt通路对心肌再灌注大鼠心肌自噬的影响
2020-07-24王松迪
王松迪
(赤峰学院附属医院麻醉科,内蒙古 赤峰 024000)
在急性心肌梗死的溶栓治疗及心脏复苏、心脏移植等临床手术过程中,极易发生心肌缺血再灌注损伤,使心肌梗死面积增加,心肌细胞凋亡,引发心肌炎、心律失常等并发症,严重损伤心功能,严重时患者可因心力衰竭而死亡,严重损害居民身心健康及生活质量,因此,寻找有效的治疗方法减轻心肌缺血再灌注损伤具有重大的临床意义[1]。细胞自噬是降解并循环利用自身各种物质的生理过程,在心肌缺血再灌注损伤中具有重要的调控作用,在心肌再灌注阶段,细胞的过度自噬可导致心肌细胞凋亡,是造成心肌损伤的主要原因[2]。抑制心肌细胞的过度自噬,可减轻心肌梗死,保护心肌组织免于损伤[3]。研究结果发现,麻醉药右美托咪定可抑制海马神经元自噬,进而减轻创伤性脑损伤大鼠的脑损伤,恢复其神经功能[4]; 另外,以右美托咪定预处理缺血再灌注肺损伤大鼠,可降低肺细胞自噬作用,抑制其凋亡,对肺组织起到保护作用[5]。因此,预测右美托咪定可能通过抑制心肌细胞自噬而减轻心肌缺血再灌注损伤。PI3K/Akt是机体调控细胞自噬过程的主要信号通路,使其磷酸化激活可上调下游信号分子mTOR表达,进而抑制细胞自噬[6]。PI3K/Akt信号亦可调控心肌缺血再灌注损伤,七氟醚即可通过激活该通路对大鼠心肌组织起到保护作用[7]。但右美托咪定是否可通过调控PI3K/Akt通路影响心肌再灌注大鼠心肌自噬,目前尚不清楚,本研究通过建立大鼠心肌缺血再灌注模型,对此进行探讨,现报告如下。
1 材料与方法
1.1 材料
1.1.1 实验动物:SD大鼠(汕头大学医学院),许可证号为SCXK(粤)2017-0017,动物质量合格证号为11400135053540,雄性,SPF级,体重200~240 g,1个半月龄。所有大鼠在赤峰学院附属医院动物房饲养,保持环境清洁安静、通风良好。本研究对动物的操作和处置均遵循科学技术部颁布的《关于善待实验动物的指导性意见》进行,适性饲养1周后用于实验。
1.1.2 试剂与仪器:右美托咪定(江苏恩华药业股份有限公司,批准文号为国药准字H20110085);三苯基氯化四氮唑(2,3,5-TriPhenyte-trazoliumchloride,TTC,货号为17779,美国Sigma公司),PI3K抑制剂(货号分别为17779、L9908,美国Sigma公司);肌酸激酶同工酶(CK-MB)及肌钙蛋白 Ⅰ(cTnⅠ)酶联免疫吸附试剂盒、兔源Anti-LC3、Anti-Beclin1、Anti-P62、Anti-PI3K、Anti-Akt、Anti-P-Akt及Anti-GAPDH一抗、羊抗兔二抗(货号分别为ab187396、ab246529、ab48394、ab62557、ab109012、ab151549、ab179463、ab38449、ab181602及ab150077,英国Abcam公司);RNAiso Plus、逆转录试剂盒及荧光定量PCR试剂盒(货号分别为9108、RR037Q/A/B、639519,日本Takara公司);一步法TUNEL细胞凋亡检测试剂盒、DAPI染色液、BCA试剂盒及蛋白裂解液(上海碧云天公司,货号分别为C1088、C1006、P0011及P0013B)。BL-420F生物信号采集与分析系统购自成都泰盟软件有限公司;DHX-300型动物呼吸机购自成都仪器厂;RM2035型轮转切片机、EG1160型包埋机及HI1220型烤片机购自德国Leica 公司;SMZ745型光学显微镜购自日本尼康公司;Elx800型酶标仪、1659001型蛋白电泳仪及Trans-Blot SD型半干转膜仪购自美国Bio-Rad公司;Centrifuge 5424R型低温高速离心机购自德国 EPPendorf 股份公司等。
1.2 方法
1.2.1 大鼠模型制备及分组给药:参照文献,腹腔注射剂量为45 mg/kg的2.5%戊巴比妥钠对SD大鼠进行麻醉,接着将其仰卧固定在鼠板上,做气管插管连接呼吸机,监测大鼠心电图[8]。找到大鼠左侧第3、4 肋骨,于两根肋骨之间左侧约0.5 cm处切开大鼠胸腔,暴露心脏,分离左冠状动脉前降支,采用6-0无菌线结扎其根部,观察大鼠心电图,ST波抬高时,表示缺血成功,维持缺血30 min,恢复血流,继续观察大鼠心电图,当出现病理性Q波且ST波降至正常水平时,表明再灌注成功[9],最后关闭胸腔,迅速缝合切口后消毒。共建模53只,成功48只,随机分为模型组、右美托咪定组、LY294002(PI3K抑制剂)组和右美托咪定+LY294002组,每组12只,另取12只设为假手术组,仅打开胸腔暴露心脏,不进行结扎。参照文献,以0.9%氯化钠溶液溶解右美托咪定及LY294002,右美托咪定以30 μg/kg的剂量腹腔注射[10],LY294002以0.3 mg/kg的剂量尾静脉注射[11],模型组和对照组以等剂量的0.9%氯化钠溶液腹腔及尾静脉注射,1日1次,持续3 d。
1.2.2 标本采集及TTC染色:给药结束24 h后,各组大鼠麻醉后处死,抽取腹主动脉血2 ml,静置后以离心机离心,收集上清液得到血清,储存在-80 ℃冰箱中备用,各组大鼠随机选取6只,解剖得到心脏,沿冠状切面将其切为厚度大致相同的5片,以2%的TTC染液,于室温(25 ℃)避光孵育30 min,接着置于4%多聚甲醛中固定,使用相机拍照,以Image Pro软件对图片进行分析得出大鼠心肌梗死面积。计算公式为,心肌梗死面积=全心脏梗死面积/全心脏切片面积×100%。将各组剩余的6只大鼠剪取约1 g心肌组织剪碎后,加入蛋白裂解液,以匀浆机制备为匀浆液,以离心机离心后收集上清液,得到总蛋白样品液置于-80 ℃冰箱中储存备用,剩余心肌组织使用0.9%氯化钠溶液漂洗干净,经4%多聚甲醛固定、低浓度到高浓度酒精脱水、二甲苯透明及石蜡包埋后,使用切片机做常规病理切片备用。
1.2.3 TUNEL染色:选取“1.2.2”项中完整的切片,经脱蜡、高浓度到低浓度酒精处理后,采用TUNEL染色试剂盒参照说明书的操作步骤进行染色,然后置于DAPI染色液中孵育30 min,以PBS漂洗3次后,在显微镜下观察心肌细胞凋亡情况,DAPI着色细胞核,呈蓝色,凋亡细胞呈棕色,任选5个视野拍照,计数心肌细胞总数及凋亡数,计算凋亡心肌细胞比例。计算公式为,凋亡心肌细胞比例=心肌细胞凋亡数/心肌细胞总数×100%。
1.2.4 大鼠血清中CK-MB、cTnⅠ含量测定:取“1.2.2”项中血清于4 ℃冰箱中解冻,取96孔板经包被后,依次加入各组血清和酶标抗体,37 ℃孵育30 min,洗涤后加底物液37 ℃孵育10 min显色,最后加入0.05 ml硫酸(2 mol/L)终止反应,以酶标仪检测450 nm下吸光度,参照酶联免疫吸附试剂盒说明书计算血清CK-MB、cTnⅠ含量。
1.2.5 心肌组织中自噬相关蛋白及PI3K/Akt通路相关蛋白表达的检测:取“1.2.2”项中蛋白样品液于4 ℃冰箱中解冻,参照说明书的步骤使用BCA试剂盒测定其浓度,煮沸5 min使其变性,然后各组分别取含相同质量总蛋白的样品液进行SDS-PAGE电泳,分离蛋白后转移至PVDF膜上,接着将其置于5%的脱脂奶粉中,室温封闭2 h,加入兔源Beclin-1、LC3-Ⅰ、LC3-Ⅱ、P62、PI3K、P-PI3K、Akt及P-Akt一抗置于4 ℃冰箱中孵育过夜,经TBST漂洗后,加入羊抗兔二抗,放置在摇床上室温孵育2 h,经TBST再次漂洗后,以增强化学发光法显色,使用凝胶成像仪拍摄图像,并以Image-J软件分析条带进而得出各组蛋白相对表达量。
1.3 统计学分析

2 结果
2.1 右美托咪定处理对大鼠心肌梗死面积的影响
与假手术组相比,模型组大鼠心肌梗死面积明显增加(P<0.000 1);与模型组相比,右美托咪定组大鼠心肌梗死面积缩小(P<0.000 1),LY294002组大鼠心肌梗死面积增加(P=0.000 6);与右美托咪定组相比,右美托咪定+LY294002组大鼠心肌梗死面积增加(P<0.000 1);与LY294002组相比,右美托咪定+LY294002组大鼠心肌梗死面积缩小(P=0.000 3),上述差异均有统计学意义,见图1。

A.假手术组;B.模型组;C.右美托咪定组;D.LY294002组;E.右美托咪定+LY294002组;与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与右美托咪定组比较,cP<0.05;与LY294002组比较,dP<0.05A. sham-operation group; B. model group; C. dexmedetomidine group; D. LY294002 group; E. dexmedetomidine+LY294002 group;vs. sham-operation group, aP<0.05; vs. model group, bP<0.05; vs. dexmedetomidine group, cP<0.05; vs. LY294002 group, dP<0.05图1 TTC染色法检测五组大鼠心肌梗死情况Fig 1 Detection of myocardial infarction in five groups of rats by TTC staining
2.2 右美托咪定对大鼠心肌细胞凋亡的影响
与假手术组相比,模型组大鼠心肌细胞凋亡率明显升高(P=0.000 2);与模型组相比,右美托咪定组大鼠心肌细胞凋亡率降低(P=0.000 7),LY294002组大鼠心肌细胞凋亡率升高(P=0.000 4);与右美托咪定组相比,右美托咪定+LY294002组大鼠心肌细胞凋亡率升高(P=0.000 3);与LY294002组相比,右美托咪定+LY294002组大鼠心肌细胞凋亡率降低(P=0.001 1),上述差异均有统计学意义,见图2。
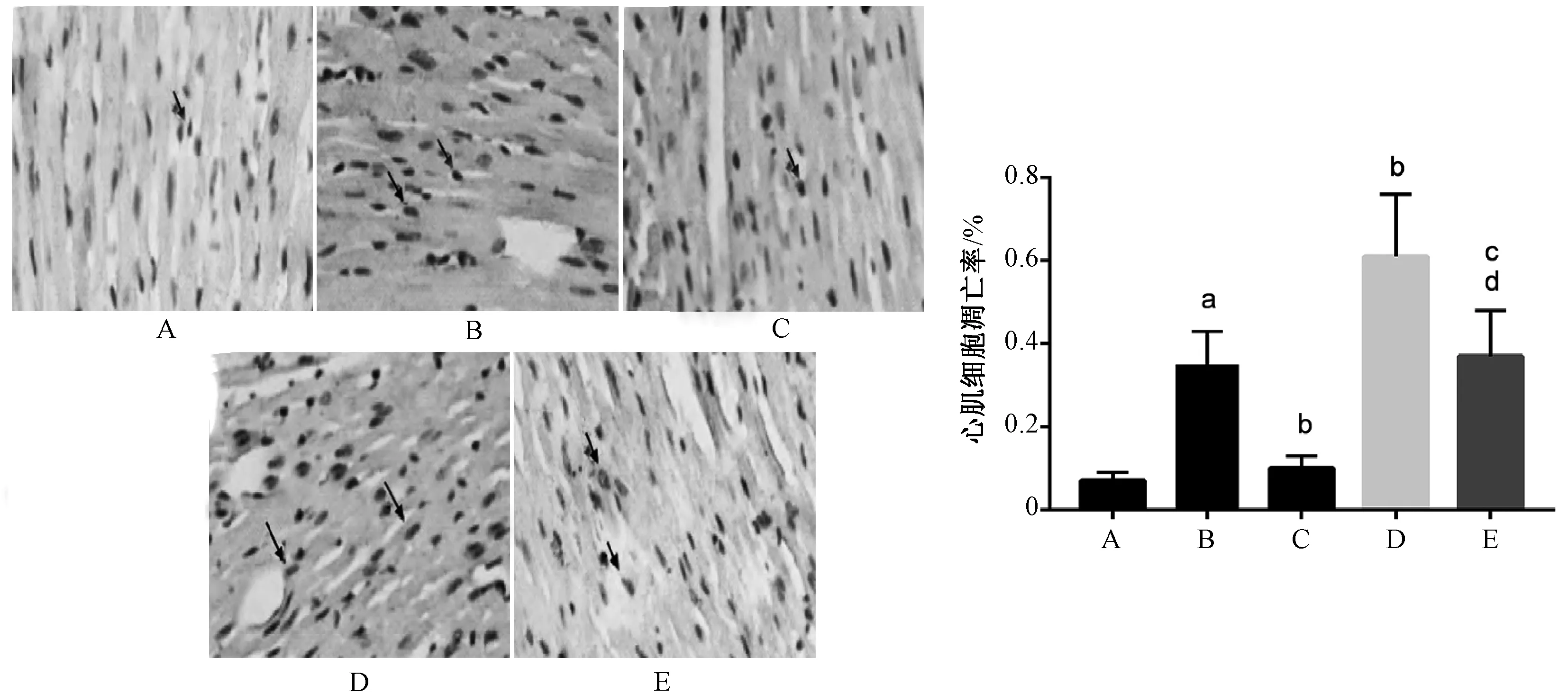
A.假手术组;B.模型组;C.右美托咪定组;D.LY294002组;E.右美托咪定+LY294002组;与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与右美托咪定组比较,cP<0.05;与LY294002组比较,dP<0.05A. sham-operation group; B. model group; C. dexmedetomidine group; D. LY294002 group; E. dexmedetomidine+LY294002 group; vs. sham-operation group, aP<0.05; vs. model group, bP<0.05; vs. dexmedetomidine group, cP<0.05; vs. LY294002 group, dP<0.05图2 TUNEL染色法检测五组大鼠心肌凋亡情况(×200)Fig 2 Detection of myocardial apoptosis in five groups of rats by TUNEL staining(×200)
2.3 右美托咪定对大鼠血清中CK-MB、cTnⅠ含量的影响
与假手术组相比,模型组大鼠血清中CK-MB、cTnⅠ含量明显升高(P均<0.000 1);与模型组相比,右美托咪定组大鼠血清中CK-MB、cTnⅠ含量降低(P<0.000 1,P=0.000 9),LY294002组大鼠血清CK-MB、cTnⅠ含量升高(P<0.000 1,P=0.001 1);与右美托咪定组相比,右美托咪定+LY294002组大鼠血清CK-MB、cTnⅠ含量升高(P<0.000 1,P=0.000 6);与LY294002组相比,右美托咪定+LY294002组大鼠血清CK-MB、cTnⅠ含量降低(P<0.000 1,P=0.001 7),上述差异均有统计学意义,见图3。
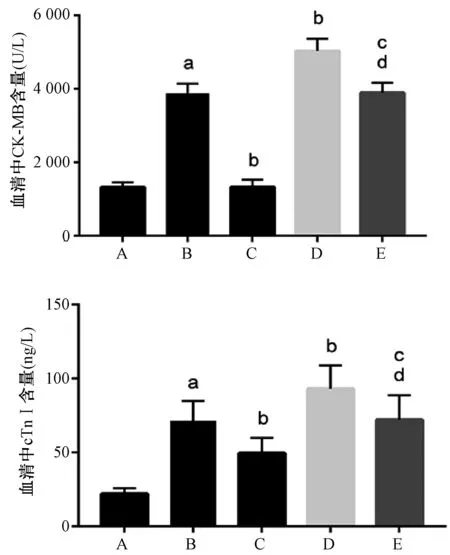
A.假手术组;B.模型组;C.右美托咪定组;D.LY294002组;E.右美托咪定+LY294002组; 与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与右美托咪定组比较,cP<0.05;与LY294002组比较,dP<0.05A. sham-operation group; B. model group; C. dexmedetomidine group; D. LY294002 group; E. dexmedetomidine+LY294002 group; vs. sham-operation group, aP<0.05; vs. model group, bP<0.05; vs. dexmedetomidine group, cP<0.05; vs. LY294002 group, dP<0.05图3 五组大鼠血清CK-MB、cTnⅠ含量比较Fig 3 Comparison of contents of serum CK-MB and cTnⅠ among five groups of rats
2.4 右美托咪定对大鼠心肌组织中Beclin-1、LC3-Ⅰ、LC3-Ⅱ、P62蛋白水平的影响
与假手术组相比,模型组大鼠心肌组织中Beclin-1、LC3-Ⅱ及P62蛋白水平明显升高,差异均有统计学意义(P<0.000 1,P=0.000 1,P<0.000 1),LC3-Ⅰ蛋白水平的差异无统计学意义(P=0.999 6)。与模型组相比,右美托咪定组大鼠心肌组织中Beclin-1、LC3-Ⅱ及P62蛋白水平明显降低,差异均有统计学意义(P<0.000 1,P=0.000 2,P<0.000 1),LC3-Ⅰ蛋白水平的差异无统计学意义(P=0.999 6);LY294002组大鼠心肌组织中Beclin-1、LC3-Ⅱ及P62蛋白水平明显升高(P=0.000 4,P=0.001 7,P=0.012 4),LC3-Ⅰ蛋白水平的差异无统计学意义(P=0.999 6)。与右美托咪定组相比,右美托咪定+LY294002组大鼠心肌组织中Beclin-1、LC3-Ⅱ及P62蛋白水平明显升高(P<0.000 1,P=0.000 1,P<0.000 1),LC3-Ⅰ蛋白水平的差异无统计学意义(P=0.999 6)。与LY294002组相比,右美托咪定+LY294002组大鼠心肌组织中Beclin-1、LC3-Ⅱ及P62蛋白水平明显降低,差异均有统计学意义(P=0.000 8,P=0.002 6,P=0.015 3),LC3-Ⅰ蛋白水平的差异无统计学意义(P=0.971 2),见图4。
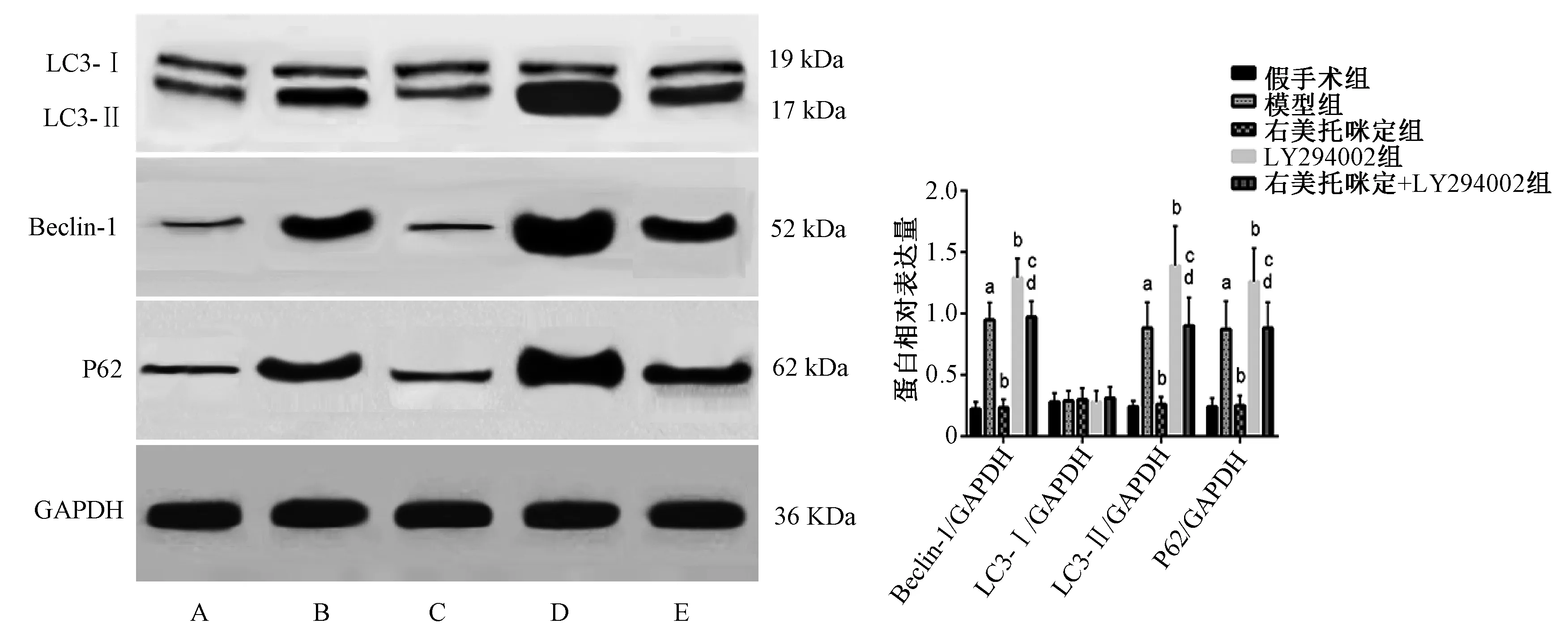
A.假手术组;B.模型组;C.右美托咪定组;D.LY294002组;E.右美托咪定+LY294002组;与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与右美托咪定组比较,cP<0.05;与LY294002组比较,dP<0.05A. sham-operation group; B. model group; C. dexmedetomidine group; D. LY294002 group; E. dexmedetomidine+LY294002 group; vs. sham-operation group, aP<0.05; vs. model group, bP<0.05; vs. dexmedetomidine group, cP<0.05; vs. LY294002 group, dP<0.05图4 免疫印迹法检测五组大鼠心肌组织中Beclin-1、LC3-Ⅰ、LC3-Ⅱ及P62蛋白表达水平Fig 4 Detection of expression levels of Beclin-1, LC3-Ⅰ, LC3-Ⅱ and P62 protein in myocardial tissue in five groups of rats by Western blotting
2.5 右美托咪定对大鼠心肌组织中PI3K/Akt通路蛋白(P-PI3K/PI3K、P-Akt/Akt)表达的影响
与假手术组相比,模型组大鼠心肌组织中P-PI3K/PI3K、P-Akt/Akt蛋白表达明显降低(P均<0.000 1);与模型组相比,右美托咪定组大鼠心肌组织中P-PI3K/PI3K、P-Akt/Akt蛋白表达明显升高(P均<0.000 1),LY294002组大鼠心肌组织中P-PI3K/PI3K、P-Akt/Akt蛋白表达明显降低(P=0.023 7,P=0.041 8);与右美托咪定组相比,右美托咪定+LY294002组大鼠心肌组织中P-PI3K/PI3K、P-Akt/Akt蛋白表达明显降低(P均<0.000 1);与LY294002组相比,右美托咪定+LY294002组大鼠心肌组织中P-PI3K/PI3K、P-Akt/Akt蛋白表达明显升高(P=0.011 8,P=0.041 8),上述差异均有统计学意义,见图5。
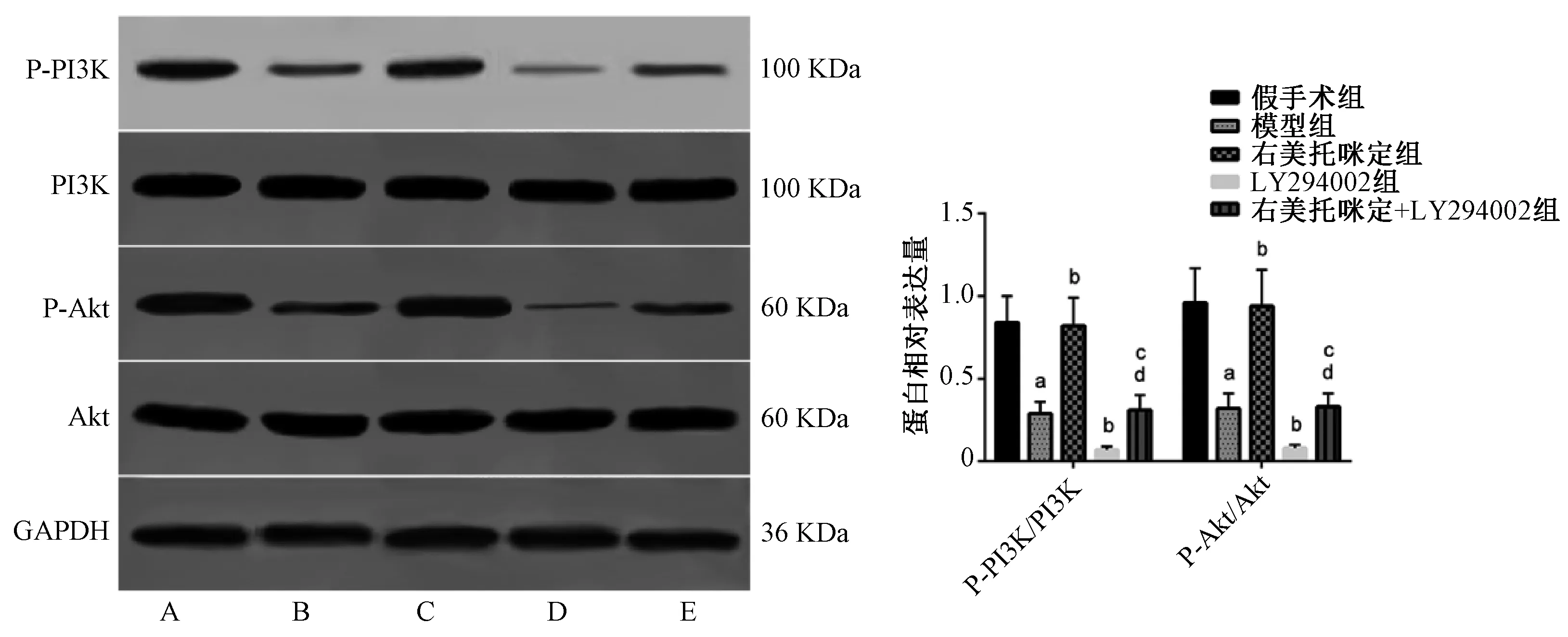
A.假手术组;B.模型组;C.右美托咪定组;D.LY294002组;E.右美托咪定+LY294002组; 与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与右美托咪定组比较,cP<0.05;与LY294002组比较,dP<0.05A. sham-operation group; B. model group; C. dexmedetomidine group; D. LY294002 group; E. dexmedetomidine+LY294002 group; vs. sham-operation group, aP<0.05; vs. model group, bP<0.05; vs. dexmedetomidine group, cP<0.05; vs. LY294002 group, dP<0.05图5 免疫印迹法检测五组大鼠心肌组织中PI3K/Akt通路蛋白表达水平Fig 5 Detection of expression level of PI3K/Akt pathway protein in myocardial tissue in five groups of rats by Western blotting
3 讨论
缺血再灌注损伤的病理机制复杂,其中缺血组织再灌注时,大量活性氧及自由基产生,并引发严重的炎症及氧化应激反应,造成细胞凋亡,进而严重损伤组织器官;而心脏为有极为丰富血液供应的器官,缺血再灌注时极易损伤心肌组织,是临床中导致心肌梗死、心力衰竭等心血管疾病患者死亡的主要原因[12]。本研究以结扎左冠状动脉前降支法制备大鼠心肌缺血再灌注模型,结果发现,建模大鼠心肌梗死面积明显增加,表明结扎左冠状动脉前降支可加重心肌梗死症状。CK-MB、cTnⅠ是临床及基础研究中广泛用于反映心肌损伤程度的标记物[13]。两者在建模大鼠血清中含量明显升高,表明结扎左冠状动脉前降支可造成大鼠心肌损伤,提示模型建立成功。
细胞自噬是溶酶体降解细胞自身损坏的细胞器、大分子蛋白,进而对物质进行循环利用的重要生理过程,在维持机体细胞物质和能量平衡中发挥着重要作用;LC3是自噬体标记物,与Beclin-1、P62蛋白一起可作为检测自噬的标志蛋白,LC3广泛表达在自噬体膜上,含有LC3-Ⅰ、LC3-Ⅱ 2种亚基,在自噬过程中,LC3-Ⅱ表达升高,Beclin-1、P62可促使自噬小体形成,是调控自噬作用的关键蛋白[14-15]。在心肌缺血再灌注损伤过程中,细胞自噬发挥了重要的调控作用,在心肌组织缺血再灌注时,严重的炎症及氧化应激反应会引起自噬过度激活,进而促使心肌细胞凋亡,造成心肌组织损伤,抑制自噬作用是潜在的防治缺血再灌注损伤的方法[16]。乙醛脱氢酶2即可通过抑制心肌细胞自噬而减轻阿霉素诱导的心肌损伤,改善心功能[17]。右美托咪定是一种高选择性α肾上腺素能受体激动剂,可抑制老年大鼠海马神经元自噬功能,改善其认知功能障碍,因此,右美托咪定可能抑制心肌细胞自噬,进而减轻心肌缺血再灌注损伤[18]。本研究结果显示,在大鼠心肌缺血再灌注损伤过程中,其心肌细胞自噬作用增强,以右美托咪定处理后,大鼠心肌梗死面积、CK-MB及cTnⅠ含量、Beclin-1、LC3-Ⅱ及P62蛋白表达水平降低,表明右美托咪定可下调心肌缺血再灌注大鼠心肌细胞中自噬蛋白表达,抑制自噬活性,进而减轻心肌梗死症状及心肌损伤。
PI3K/Akt通路是机体经典的细胞存活信号通路,与细胞增殖、代谢、存活及炎症密切相关,还可参与调控细胞自噬,升高通路蛋白PI3K、Akt的磷酸化水平可上调下游mTOR蛋白表达,抑制细胞的自噬作用,减轻阿霉素诱导的心肌细胞损伤[19-20]。因此,右美托咪定可能通过抑制PI3K/Akt通路激活而抑制心肌自噬,进而减轻心肌损伤。本研究结果显示,模型大鼠心肌组织中PI3K/Akt通路处于抑制状态,模型大鼠以右美托咪定处理可激活心肌组织中PI3K/Akt通路,减轻心肌损伤;以右美托咪定及PI3K/Akt通路抑制剂LY294002联合处理,LY294002可减弱右美托咪定缩小大鼠心肌梗死面积,降低CK-MB及cTnⅠ含量、Beclin-1、LC3-Ⅱ及P62蛋白表达的作用,表明LY294002可减弱右美托咪定抑制心肌自噬、缓解心肌损伤的作用,揭示激活PI3K/Akt通路是右美托咪定抑制心肌自噬,进而减轻心肌缺血再灌注损伤损伤的作用机制之一。
综上所述,右美托咪定可激活PI3K/Akt通路,下调心肌缺血再灌注损伤大鼠心肌细胞自噬蛋白表达,降低其自噬活性,保护心肌组织免于缺血再灌注损伤,上调PI3K/Akt通路蛋白磷酸化水平是其作用机制之一。但本研究未使用PI3K/Akt通路激动剂做对照研究,还存在不足,要完全阐明其分子机制还需要后续深入研究。
