沙苑子多糖促进兔半月板纤维软骨细胞增殖的作用机制研究
2020-07-23沈骅睿敖亮王立胜汪国友郝琦李婷
沈骅睿 敖亮 王立胜 汪国友 郝琦 李婷


中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2020)09-1097-06
DOI 10.6039/j.issn.1001-0408.2020.09.14
摘 要 目的:研究沙苑子多糖促进兔半月板纤维软骨细胞(以下简称“软骨细胞”)增殖的作用机制。方法:分离1月龄新西兰大白兔软骨细胞。将软骨细胞分为正常对照组(PBS)、阳性对照组(硫酸氨基葡萄糖,10 mg/mL)和沙苑子多糖高、中、低(40、20、10 mg/mL)剂量组,分组给药干预。采用光学显微镜观察软骨细胞的形态学特征;采用MTT法检测软骨细胞增殖抑制率,并用流式细胞术观察细胞周期;采用酶联免疫吸附试验(ELISA)检测软骨细胞中Ⅱ型胶原蛋白(Col Ⅱ)、碱性磷酸酶蛋白(ALP)的表达水平;采用逆转录-聚合酶链式反应和Western blotting法检测转化生长因子β1(TGF-β1)、骨形态发生蛋白2(BMP-2)mRNA及蛋白的表达水平。结果:软骨细胞培养72 h后,细胞融合成单层,多数呈现细长梭型外观。与正常对照组比较,阳性对照组和沙苑子多糖高、中、低剂量组软骨细胞的增殖抑制率、G1/G0期细胞百分比均显著降低(P<0.05),S期细胞百分比和Col Ⅱ、ALP蛋白表达水平及TGF-β1、BMP-2 mRNA及蛋白的表达水平均显著升高(P<0.05)。与阳性对照组比较,沙苑子多糖高剂量组软骨细胞的增殖抑制率、G1/G0期细胞百分比均显著降低(P<0.05),S期细胞百分比和Col Ⅱ、ALP蛋白表达水平及TGF-β1、BMP-2 mRNA及蛋白的表达水平均显著升高(P<0.05);沙苑子多糖低剂量组软骨细胞的增殖抑制率、G1/G0期细胞百分比均显著升高(P<0.05),S期细胞百分比和Col Ⅱ、ALP蛋白及TGF-β1、BMP-2 mRNA和蛋白的相对表达水平均显著降低(P<0.05);沙苑子多糖中剂量组上述指标差异均无统计学意义。结论:沙苑子多糖可促进软骨细胞增殖,降低G1/G0期细胞百分比,促进细胞向S期转化;其作用机制可能与上调TGF-β1、BMP-2 mRNA及蛋白表达,促进Col Ⅱ、ALP蛋白表达水平升高有关。
关键词 沙苑子多糖;半月板;纤维软骨细胞;增殖;Ⅱ型胶原蛋白;碱性磷酸酶蛋白;转化生长因子β1;骨形态发生蛋白2;机制
Study on the Mechanism of Enhancement Effects of Astragalus complanatus Polysaccharides on the Proliferation of Meniscal Fibrochondrocyte Cells in Rabbits
SHEN Huarui1,AO Liang1,WANG Lisheng1,WANG Guoyou1,HAO Qi1,LI Ting2(1.Dept. of Joint Surgery, the Affiliated Hospital of Traditional Chinese Medicine of Southwest Medical University, Sichuan Luzhou 646000, China;2.School of Pharmacy, Southwest Medical University, Sichuan Luzhou 646000, China)
ABSTRACT OBJECTIVE: To study the mechanism of enhancement effects of Astragalus complanatus polysaccharides (ACP) on the proliferation of meniscal fibrochondrocytes cells in rabbits. METHODS: The meniscal fibrochondrocytes cells were isolated from 1-month-old New Zealand white rabbits. The meniscal fibrochondrocytes cells were divided into normal control group (PBS), positive control group (glucosamine sulfate, 10 mg/mL) and ACP high-dose, medium-dose and low-dose groups (40, 20, 10 mg/mL). The morphology of meniscal fibrochondrocytes cells were observed under microscope. Cell proliferation rate was detected by MTT assay. Cell cycle was observed with flow cytometry. ELISA assay was used to detect relative expression of medium collagen type Ⅱ (Col Ⅱ) and alkaline phosphatase protein (ALP) in meniscal fibrochondrocytes cells. RT-qPCR and Western blotting assay were adopted to detect mRNA and protein expression of transforming growth factor β1 (TGF-β1) and bone morphogenetic protein 2 (BMP-2). RESULTS: After cultured for 72 h, meniscal fibrochondrocytes cells were fused into a single layer, and most of them were slender type in appearance. Compared with normal control group, the proliferation rate of meniscal fibrochondrocytes cells and the percentage of cells at G1/G0 phase were decreased significantly in positive control group and ACP high-dose, medium-dose and low-dose groups (P<0.05); the percentage of cells at S phase, protein expression of Col Ⅱ and ALP, mRNA and protein expression of TGF-β1 and BMP-2 were increased significantly (P<0.05). Compared with positive control group, inhibitory rate of meniscal fibrochondrocytes cells proliferation and the percentage of cells at G1/G0 phase were decreased significantly in ACP high-dose group (P<0.05), while the percentage of cells at S phase, protein expression of Col Ⅱ and ALP, mRNA and protein expression of TGF-β1 and BMP-2 were increased significantly (P<0.05). The inhibitory proliferation rate of meniscal fibrochondrocytes cells and the percentage of cells at G1/G0 phase were increased significantly in ACP low-dose group (P<0.05), while the percentage of cells at S phase, protein expression of Col Ⅱ and ALP, mRNA and protein expression of TGF-β1 and BMP-2 were decreased significantly (P<0.05). There was no statistical significance in above indexes of ACP medium-dose group. CONCLUSIONS: ACP can promote the proliferation of meniscal fibrochondrocytes cells, reduce the percentage of cells at G1/G0 phase, promote cell transformation to S phase; the mechanism of which may be related to up-regulating TGF-β1, BMP-2 mRNA and protein expression, promoting Col Ⅱ and ALP protein expression enhancement.
KEYWORDS Astragalus complanatus polysaccharides; Meniscal fibrochondrocytes cells; Proliferation; Col Ⅱ; ALP; TGF-β1; BMP-2; Mechanism
半月板是膝关节的重要组成部分,具有载荷、吸收震荡、润滑、增加关节接触面、营养关节软骨等功能,而半月板损伤会导致关节不稳定、甚至出现骨性关节炎[1]。据统计,我国每10万人中发生半月板损伤的患者约为60~70人[2]。半月板损伤患者多接受保留半月板或半月板重建和移植的治疗办法,但其疗效仍存在较大的提升空间[3-4]。因此,研究半月板损伤治疗的新途径符合临床需求。纤维软骨细胞和细胞外基质构成了半月板外部结构,纤维软骨细胞可从半月板中直接取出并进行体外培养、传代,是研究半月板损伤修复的重要细胞来源[5]。
沙苑子为豆科植物扁茎黄芪(Astragalus complanatus R.Br.)的干燥成熟种子,归肝肾经,具有补肾助阳、养肝明目等功效[6]。沙苑子多糖为沙苑子的主要有效成分,相關研究表明,沙苑子多糖具有体外促成骨细胞增殖的作用[7]。但是,沙苑子多糖对半月板纤维软骨细胞(以下简称“软骨细胞”)的增殖是否有促进作用,目前尚未见文献报道。
关节软骨的主要成分是胶原蛋白,其中Ⅱ型胶原蛋白(Col Ⅱ)是软骨细胞外基质的主要成分之一,具有抵抗外界压力、维持软骨结构的作用,其表达水平升高是软骨细胞增殖的特征性指标[8]。碱性磷酸酶(ALP)是软骨发育过程中的关键酶蛋白,其水平升高与软骨细胞的分化与成熟密切相关[9]。转化生长因子β(TGF-β)超家族对骨形成、纤维化、伤口愈合具有调节作用[10],其中TGF-β1是骨重建的关键因子,参与软骨细胞的增殖、分化、死亡等过程[11]。骨形态发生蛋白2(BMP-2)也是TGF-β超家族成员之一,是关节修复过程中必不可少的蛋白[12]。基于此,本文研究沙苑子多糖对软骨细胞增殖的促进作用,并检测细胞中Col Ⅱ、ALP蛋白和TGF-β1、BMP-2 mRNA及蛋白的表达水平变化,以期深入了解沙苑子多糖的作用机制。
1 材料
1.1 仪器
Gallios型流式细胞仪(美国Beckman Coulter公司);Multiskan fc型酶标仪(美国Thermo Fisher Scientific公司);BPN-50CHUV型二氧化碳培养箱(青岛名博环保科技有限公司); ECO 48型聚合酶链式反应(PCR)仪(英国PCRmax公司);MP4型垂直电泳仪(美国Bio-Rad公司);XSP-12CAC型光学显微镜(上海缔伦光学仪器有限公司)。
1.2 药品与试剂
沙苑子多糖(陕西斯诺特生物技术有限公司,批号:171211C,纯度:≥96%);四唑盐(MTT)比色法检测试剂盒(北京群晓科苑生物技术有限公司,批号:YS171211A);反转录试剂盒(日本Takara公司,批号:180223CC);RT-PCR试剂盒(南京威特森生物技术有限公司,批号:180115001);细胞裂解液(南京碧云天生物技术研究所,批号:180221A);胰蛋白酶(批号:20150623)、Ⅱ型胶原酶(批号:1225C071)均购自北京索莱宝生物科技有限公司;Col Ⅱ酶联免疫吸附试验(ELISA)试剂盒(批号:1803110001)、ALP ELISA试剂盒(批号:1802150002)均购自武汉云克隆科技股份有限公司;流式细胞周期检测试剂盒(美国Biovision公司,批号:YLN180111002);Col Ⅱ兔单克隆抗体(批号:1801002)、ALP兔单克隆抗体(批号:1802005)、TGF-β1兔单克隆抗体(批号:1804001)、BMP-2兔单克隆抗体(批号:1804009)、β-肌动蛋白(β-actin,批号:2015052250)、辣根过氧化物酶(HRP)标记山羊抗兔免疫球蛋白G(IgG)二抗(批号:1711160)均购自美国Abcam公司;PCR引物合成由南京科佰生物科技有限公司完成。
1.3 动物
SPF级新西兰大白兔1只,雄性,1月龄,体质量0.75 kg,购自中国农业科学院兰州兽医研究所,动物生产许可证号:SCXK(甘) 2018-0001。
2 方法
2.1 细胞分离
参考文献方法[13-14]分离软骨细胞。将新西兰大白兔适应性喂养1周后,剖取四肢膝关节半月板并剪碎成颗粒,加入0.25%的胰蛋白酶后置于37 ℃恒温水浴锅中消化30 min;以1 500 r/min离心15 min,弃上清,向沉淀中加入0.3%Ⅱ型胶原酶后置于37 ℃恒温水浴锅中消化4 h;取上层悬液,以1 500 r/min离心5 min,弃上清,向沉淀中加入含10% 胎牛血清的DMEM培养基进行重悬,再以5×104个/mL接种在细胞培养瓶中,于5%CO2、37 ℃条件下培养,备用。
2.2 沙苑子多糖对软骨细胞形态的影响观察
将软骨细胞以5×104个/孔接种于96孔板中,分为正常对照组、阳性对照组(硫酸氨基葡萄糖,10 mg/mL,剂量根据临床用药剂量及预试验结果确定)和沙苑子多糖高、中、低剂量组(40、20、10 mg/mL,剂量根据文献[15]及预试验确定),每组设置3个复孔,加入相应药物(用磷酸盐缓冲液配制),正常对照组加入等体积PBS。各组细胞于5%CO2、37 ℃条件下培养0、48、72 h后,用光学显微镜观察软骨细胞的生长情况。
2.3 沙苑子多糖对软骨细胞增殖抑制率的影响考察
采用MTT法检测。将软骨细胞以5×104个/孔接种于96孔板中,按“2.2”项下方法进行分组和给药,每组设置5个复孔,并于药物干预24、48、72、96 h后,每孔加入20 μL MTT溶液,继续培养4 h。弃细胞培养液,每孔加入150 μL二甲基亚砜,置于摇床避光孵育10 min后,于酶标仪上测定各孔的吸光度值,然后计算细胞增殖抑制率[15]:细胞增殖抑制率=(正常对照组吸光度值-试验组吸光度值)/正常对照组吸光度值×100%。
2.4 沙苑子多糖对软骨细胞周期的影响考察
采用流式细胞术检测。将软骨细胞以1×106个/孔接种于6孔板中,按“2.2”项下方法进行分组和给药,每组设置5个复孔,于5%CO2、37 ℃条件下培养72 h。收集细胞于1.5 mL离心管中,加入70%无水乙醇固定1 h后,按细胞周期检测试剂盒说明书进行相关操作,然后使用流式细胞仪检测细胞周期的变化。
2.5 沙苑子多糖对软骨细胞中Col Ⅱ、ALP蛋白表达水平的影响考察
采用ELISA法检测。将软骨细胞以5×104个/孔接种于96孔板中,按“2.2”项下方法进行分组和给药,每组设置5个复孔,于5%CO2、37 ℃条件下培养72 h后,按ELISA试剂盒说明书进行相关操作,检测Col Ⅱ、ALP蛋白表达水平。
2.6 沙苑子多糖对软骨细胞中TGF-β1、BMP-2 mRNA表达水平的影响考察
采用逆转录PCR(RT-PCR)法检测。将软骨细胞以1×106个/孔接种于6孔板中,按“2.2”项下方法进行分组和给药,每组设置5个复孔,于5%CO2、37 ℃条件下培養72 h。收集细胞至1.5 mL离心管中,加入1 mL Trizol试剂,静置30 min,加入1/5体积氯仿,涡旋振荡15 s后,以12 000 r/min离心15 min。取上层清液,加入等体积异丙醇,上下颠倒混匀后冰浴10 min,以12 000 r/min离心10 min,弃上清,沉淀中加入1 mL 70%无水乙醇,以12 000 r/min离心5 min,弃去乙醇,风干沉淀,加入无RNA酶水溶解沉淀。按反转录试剂盒说明书操作,将RNA反转录为 cDNA,再按PCR试剂盒说明书操作进行PCR扩增。TGF-β1上游引物为5′-TACCACTACGGATCGTTAGA-3′,下游引物为5′-GACTGAACTAGCTAGCAATCGA-3′,产物长度为131 bp;BMP-2上游引物为5′-TAAGCTGACATGGTACCAGAT-3′,下游引物为5′-TAACGTATGACCATAGGAAT-3′,产物长度为112 bp;β-actin上游引物为5′-ACAGTAATGCCGTAACGTTC-3′,下游引物为5′-GATGCAATGGCTCAGATAGCA-3′,产物长度为109 bp。扩增程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸60 s,共30个循环;最后72 ℃延伸10 min。然后采用荧光分析软件对各孔ct值进行分析,以β-actin为内参计算TGF-β1、BMP-2 mRNA的相对表达水平。
2.7 沙苑子多糖对软骨细胞中TGF-β1、BMP-2 蛋白表达水平的影响考察
采用Western blotting检测。将软骨细胞以1×106 个/孔接种于6孔板中,按“2.2”项下方法进行分组和给药,每组设置5个复孔,于5%CO2、37 ℃条件下培养72 h。收集细胞至1.5 mL离心管中,加入1 mL细胞裂解液,于4 ℃摇床上裂解4 h,再于4 ℃条件下以12 000 r/min离心10 min,取上清进行BCA蛋白定量。取蛋白,进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳,再转移至PVDF膜,室温封闭2 h后,加入TGF-β1、BMP-2一抗(1 ∶ 1 000),孵育过夜;以TBST缓冲液洗膜3次,每次5 min;再加入相应二抗(1 ∶ 10 000),室温孵育2 h;以TBST缓冲液洗膜2次,每次5 min;然后加入化学发光液,以β-actin为内参,采用化学发光成像系统分析蛋白条带的相对灰度值来表示目的蛋白的表达水平。
2.8 统计学方法
采用SPSS 23.0软件进行试验数据分析。计量资料以x±s表示,多组间数据比较采用单因素方差分析,组间两两比较采用SNK-q检验,组内不同时间点数据比较采用t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 细胞形态观察结果
软骨细胞培养0 h时,细胞呈现球形悬浮状态;培养48 h时,大部分细胞已出现贴壁,细胞形态拉长,呈多角形,偶见椭圆形贴壁细胞;培养72 h时,细胞融合成单层,多数呈现细长梭型外观,少部分仍为椭圆形外观,表明软骨细胞分离培养成功,详见图1。
3.2 细胞增殖抑制率测定结果
与正常对照组比较,阳性对照组和沙苑子多糖高、中、低剂量组细胞培养24、48、72、96 h后的细胞增殖抑制率均显著降低(P<0.05);与阳性对照组比较,沙苑子多糖高剂量组细胞培养24、48、72、96 h后细胞增殖抑制率均显著降低(P<0.05),沙苑子多糖低剂量组细胞培养24、48、72、96 h后细胞增殖抑制率均显著升高(P<0.05),沙苑子多糖中剂量组细胞培养24、48、72、96 h后细胞增殖抑制率差异无统计学意义,详见表1。
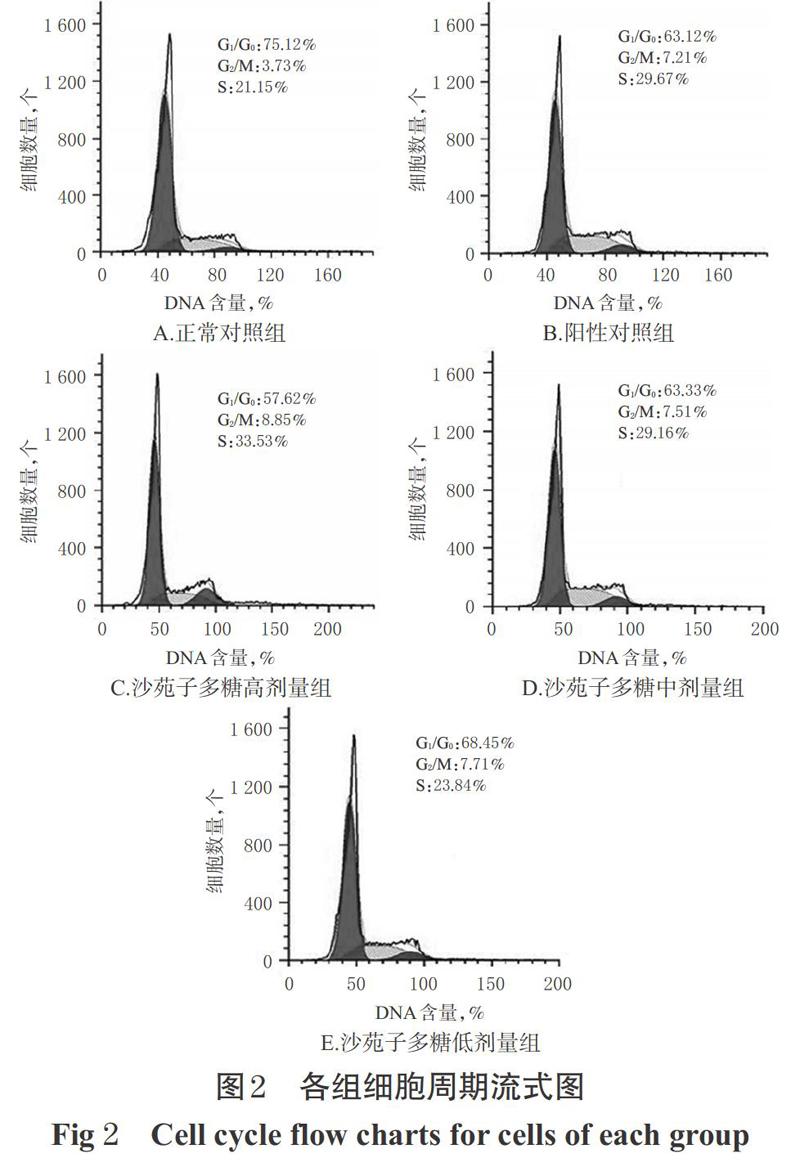
3.3 细胞周期检测结果
与正常对照组比较,阳性对照组和沙苑子多糖高、中、低剂量组G1/G0期细胞百分比均显著降低,S期细胞百分比均显著升高(P<0.05)。与阳性对照组比较,沙苑子多糖高剂量组G1/G0期细胞百分比显著降低,S期细胞百分比显著升高(P<0.05);沙苑子多糖低剂量组G1/G0期细胞百分比显著升高,S期细胞百分比显著降低(P<0.05);沙苑子多糖中剂量组G1/G0期和S期细胞百分比差异无统计学意义,详见图2、表2。
3.4 细胞中Col Ⅱ、ALP蛋白相对表达水平检测结果
与正常对照组比较,阳性对照组和沙苑子多糖高、中、低剂量组细胞中Col Ⅱ、ALP蛋白表达水平均显著升高(P<0.05);与阳性对照组比较,沙苑子多糖高剂量组细胞中Col Ⅱ、ALP蛋白表达水平均显著升高(P<0.05),沙苑子多糖低剂量组细胞中Col Ⅱ、ALP蛋白表达水平均显著降低(P<0.05),沙苑子多糖中剂量组细胞中Col Ⅱ、ALP蛋白表达水平差异无统计学意义,详见表3。
3.5 细胞中TGF-β1、BMP-2 mRNA表达水平检测结果
与正常对照组比较,阳性对照组和沙苑子多糖高、中、低剂量组细胞中TGF-β1、BMP-2 mRNA表达水平均显著升高(P<0.05);与阳性对照组比较,沙苑子多糖高剂量组细胞中TGF-β1、BMP-2 mRNA表达水平均显著升高(P<0.05),沙苑子多糖低剂量组细胞中TGF-β1、BMP-2 mRNA表达水平均显著降低(P<0.05),沙苑子多糖中剂量组细胞中TGF-β1、BMP-2 mRNA表达水平差异无统计学意义,详见表4。
3.6 细胞中TGF-β1、BMP-2蛋白表达水平检测结果
与正常对照组比较,阳性对照组和沙苑子多糖高、中、低剂量组细胞中TGF-β1、BMP-2蛋白表达水平均显著升高(P<0.05);与阳性对照组比较,沙苑子多糖高剂量组细胞中TGF-β1、BMP-2 蛋白表达水平均显著升高(P<0.05),沙苑子多糖低剂量组细胞中TGF-β1、BMP-2 蛋白表达水平均显著降低(P<0.05),沙苑子多糖中剂量组细胞中TGF-β1、BMP-2蛋白表达水平差异无统计学意义,详见图3、表5。
4 讨论
半月板损伤常出现在交通伤和运动伤中,常表现为关节的机械性阻碍,最终导致关节功能障碍[16]。该损伤可导致严重骨性关节炎,甚至致残[17]。目前,临床常用硫酸氨基葡萄糖治疗半月板损伤,其具有抗炎、改善关节功能、抑制关节软骨损伤的作用[18],故本研究将其作为阳性对照药。
“肾主骨,生髓”是传统中医理论,沙苑子具有补肾助阳的功效,常用于治疗遗尿、尿频[6]。有研究报道,沙苑子可清除骨骼肌氧化自由基,提高大鼠运动能力[19]。此外,沙苑子和狗脊、肉苁蓉等联合用药可治疗大鼠骨质疏松[20]。沙苑子多糖是沙苑子的主要成分之一,但其对软骨细胞的作用目前尚未见报道。基于此,本研究使用沙苑子多糖处理兔软骨细胞,结果发现,沙苑子多糖可促进软骨细胞的增殖,提高细胞增殖活性。另有研究表明,ALP活性增加可促进生长板软骨细胞分化成熟[21]。本研究使用沙苑子多糖处理兔半月板纤维软骨细胞后发现,细胞中Col Ⅱ、ALP蛋白的表达水平均显著升高,表明沙苑子多糖对Col Ⅱ和ALP的表达具有促进作用。
BMP-2可刺激蛋白多糖合成,促进软骨分化,促进软骨修复[22]。Col Ⅱ和ALP是TGF-β1/BMP-2信号通路的下游信号因子,当TGF-β1和BMP-2联合在骨髓基质细胞中过表达时,可促进Col Ⅱ、ALP蛋白的高表达,从而促进骨增殖与分化[23]。本研究结果显示,沙苑子多糖处理兔半月板纤维软骨细胞后可显著升高TGF-β1、BMP-2 mRNA及蛋白表达水平,由此表明,Col Ⅱ和ALP的表达升高可能与沙苑子多糖上调TGF-β1、BMP-2 mRNA及蛋白表达水平有关。
综上所述,沙苑子多糖可促进兔软骨细胞的增殖,降低G0/G1期细胞百分化,促进细胞向S期转化;其机制可能与上调TGF-β1、BMP-2 mRNA及蛋白表达,促进Col Ⅱ、ALP蛋白表达水平升高有关。
参考文献
[ 1 ] CHANG PS,BROPHY RH. As goes the meniscus goes the knee:early,intermediate,and late evidence for the detrimental effect of meniscus tears[J]. Clin Sports Med,2020,39(1):29-36.
[ 2 ] CENGIZ IF,PEREIRA H,P?GO JM,et al. Segmental and regional quantification of 3D cellular density of human meniscus from osteoarthritic knee[J]. J Tissue Eng Regen Med,2017,11(6):1844-1852.
[ 3 ] KRUTSCH W,ZELLNER J,BAUMANN F,et al. Timing of anterior cruciate ligament reconstruction within the first year after trauma and its influence on treatment of cartilage and meniscus pathology[J]. Knee Surg Sports Traumatol Arthrosc,2017,25(2):418-425.
[ 4 ] 顏学亮,陈小明,张洁,等.关节镜治疗退行性膝关节内侧半月板损伤患者的预后评价[J].中国内镜杂志,2018,24(1):39-44.
[ 5 ] 吴琪,何敢想,胡燕芬,等.丹皮酚致兔膝骨性关节炎软骨细胞凋亡及相关蛋白Bcl-2、Bax mRNA表达的时间与剂量效应研究[J].中国药房,2016,27(10):1337-1340.
[ 6 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:184.
[ 7 ] 沈骅睿,胡晓梅,杨松涛,等. 3种补肾中药有效成分促进体外培养成骨细胞增殖的研究[J].实用医院临床杂志,2013,10(5):63-66.
[ 8 ] ROLLER BL,MONIBI FA,STOKER AM,et al. Characterization of knee meniscal pathology:correlation of gross,histologic,biochemical,molecular,and radiographic measures of disease[J]. J Knee Surg,2015,28(2):175-182.
[ 9 ] ZHANG F,SUN X,YU H,et al. Effects of aluminum trichloride on the cartilage stimulatory growth factors in rats[J]. Biometals,2017,30(1):143-150.
[10] WENG FB,ZHU LF,ZHOU JX,et al. MOTS-c accelerates bone fracture healing by stimulating osteogenesis of bone marrow mesenchymal stem cells via positively regulating FOXF1 to activate the TGF-β pathway[J]. Eur Rev Med Pharmacol Sci,2019,23(24):10623-10630.
[11] TANG Y,XIAO J,WANG Y,et al. Effect of adenovirus- mediated TGF-β1 gene transfer on the function of rabbit articular chondrocytes[J]. J Orthop Sci,2017,22(1):149- 155.
[12] SALAZAR VS,GAMER LW,ROSEN V. BMP signalling in skeletal development,disease and repair[J]. Nat Rev Endocrinol,2016,12(4):203-221.
[13] 杨国勇.骺板软骨细胞培养作为半月板组织工程种子细胞的可行性研究[D].成都:四川大学,2007.
[14] 杨国勇,李箭.离心管内培养第1代骺板软骨细胞作为软骨移植材料的可行性[J].中国组织工程研究,2008,12(37):7207-7210.
[15] 金曉辉.沙苑子多糖的分离纯化与理化性质研究[D].西安:陕西师范大学,2008.
[16] GEE SM,TENNENT DJ,CAMERON KL,et al. The burden of meniscus injury in young and physically active populations[J]. Clin Sports Med,2020,39(1):13-27.
[17] KATAGIRI H,MIYATAKE K,NAKAGAWA Y,et al. The effect of a longitudinal tear of the medial meniscus on medial meniscal extrusion in anterior cruciate ligament injury patients[J]. Knee,2019,26(6):1292-1298.
[18] 张金虎.骨碎补总黄酮联合硫酸氨基葡萄糖对膝骨关节炎患者症状、骨代谢和炎症因子的影响[J].中国骨质疏松杂志,2018,24(7):884-887.
[19] 马兰军,刘根福,毛雁,等.沙苑子对运动大鼠骨骼肌自由基代谢及运动能力的影响[J].医学争鸣,2007,28(13):1168-1170.
[20] 董佳梓.沙苑子、狗脊、肉苁蓉和韭菜子对去卵巢大鼠骨质疏松症治疗作用的机理探讨[D].北京:中国中医科学院,2011.
[21] WANG WW,MAN GC,WONG JH,et al. Abnormal response of the proliferation and differentiation of growth plate chondrocytes to melatonin in adolescent idiopathic scoliosis[J]. Int J Mol Sci,2014,15(9):17100-17114.
[22] LEE SY,ABEL ED,LONG F. Glucose metabolism induced by BMP signaling is essential for murine skeletal development[J]. Nat Commun,2018,9(1):4831-4832.
[23] ZHANG YD,ZHAO SC,ZHU ZS,et al. Cx43- and smad- mediated TGF-β/BMP signaling pathway promotes cartilage differentiation of bone marrow mesenchymal stem cells and inhibits osteoblast differentiation[J]. Cell Physiol Biochem,2017,42(4):1277-1293.
(收稿日期:2020-01-12 修回日期:2020-03-11)
(编辑:唐晓莲)
