大鼠生前与死后损伤肌肉组织中自噬相关蛋白表达
2020-07-23
(山西医科大学法医学院,山西 晋中 030600)
自噬是发生在细胞质中的自我吞噬现象,通过降解细胞内受损的细胞器、错误折叠的蛋白为细胞的物质再合成提供原料[1-3]。有研究结果[4-9]表明,机体在饥饿、氧化应激损伤、肿瘤、神经退行性病变、颅脑损伤等病理状态下细胞的自噬水平会发生改变。
自噬是由一系列的自噬相关蛋白相互作用、相互介导的[10-13]。BECN1蛋白是自噬通路必需的磷酸肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)复合物的组成部分,许多自噬调控蛋白通过与BECN1蛋白的不同结构域或氨基酸发生直接或间接结合,进而调控自噬水平[14]。微管相关蛋白1-轻链-3(microtubule-associated protein 1 light chain 3,MAP1-LC3)是自噬体膜上的标志蛋白[10,12],有LC3-1和LC3-2两种形式。当自噬发生时,泛素结合蛋白p62靶向进入内质网,与LC3相互作用[10-11],LC3-1发生脂化,裂解成LC3-2锚定在自噬体上,p62蛋白降解。因此,LC3-2与LC3-1的比值(LC3-2/LC3-1)、LC3-2表达或者p62的降解被认为是监控细胞自噬活动的有效手段[10,12]。
有研究结果[15]表明,大鼠皮肤挫伤6h后,其挫伤区皮肤的免疫组织化学染色显示自噬蛋白BECN1、LC3呈阳性,损伤后3~7 d呈强阳性,而未损伤区的LC3和BECN1蛋白染色呈弱阳性;另一研究[16]通过观察绿色荧光蛋白(green fluorescent protein,GFP)-LC3转基因小鼠皮肤损伤修复过程中自噬荧光点LC3的变化,发现增殖的角质细胞自噬作用增强,说明自噬参与了损伤修复。ASAI等[17]通过研究大鼠皮肤损伤的成纤维细胞,也发现其胞内的LC3表达水平增高,而KIMURA等[18]则用蛋白印迹法研究了小鼠皮肤在损伤后短时间内(0.5~24h)自噬蛋白LC3和p62的表达变化,得出了与ASAI等[17]研究相反的结论,即在损伤≥0.5h时,LC3-2/LC3-1值下降,p62蛋白表达水平升高,即自噬受到了抑制。上述结果表明,无论损伤使自噬作用增强还是减弱,均提示细胞在受损后自噬水平会发生变化,并且这种变化可能在机体受损后的极短时间内即可出现,这为法医病理学实际案件中大体或者组织病理学难以区分的生前损伤和死后损伤的鉴别提供了研究基础。
骨骼肌在机体中分布广泛,是暴力性损伤中极易受累的器官,也是法医病理学研究的重要课题之一[19]。因此,本研究建立大鼠右后肢肌肉生前与死后损伤模型[20],通过蛋白印迹技术观察大鼠骨骼肌在生前损伤后24h内及死后损伤组织中自噬相关蛋白的表达变化,从而进一步验证自噬是否能够作为一种生活反应鉴别生前损伤和死后损伤。
1 材料与方法
1.1 主要仪器和材料
主要实验仪器:500g砝码、精密天平(美国OHAUS公司),Mini-PROTEAN Tetra垂直电泳仪(美国Bio-Rad公司),研钵、液氮、TE62槽式转印仪(美国Gene公司),Infinite®200 Pro NanoQuant酶标仪(瑞士TECAN公司),实验室用台式DHG-9145A 37℃恒温箱、振荡恒温金属浴(中国奥盛仪器有限公司),Freedom RockerTMBlotBot®全自动杂交洗涤工作站(美国Next Advance公司),Sigma 2-16PK台式冷冻离心机(德国SIGMA公司),UVP BioSpectrum 810凝胶成像系统(美国Ultra-Violet Products公司)等。
主要实验试剂:20%乌拉坦、液氮、BCA试剂盒,增强型ECL化学发光底物试剂盒、NovexTMTris-glycine SDS sample buffer(5×)、兔抗-甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、辣根过氧化物酶标记的二抗,以上试剂购自武汉博士德生物工程有限公司;兔抗-LC3A/B(mAb,美国Cell Signaling Technology公司)、兔抗-BECN1(pAbs,BBI Life Sciences公司)、兔抗-p62(pAbs,美国Cell Signaling Technology公司)等。
1.2 损伤模型制备
健康成年雄性Sprague-Dawley大鼠72只(购自山西医科大学实验动物中心),180~220 g,10~12周龄。所有大鼠均饲养在干净的笼中,饲养环境温度保持在22~24℃,湿度保持在40%~60%,自由饮食、饮水。经过一个昼夜的饲养循环,随机将大鼠分成对照组、生前损伤组(0.5、1、2、4、8、16和24h)和死后损伤组(0.5、1、2和4h),每组6只。生前损伤组大鼠在麻醉(20%乌拉坦溶液腹腔注射,剂量为0.7 mL/100 g)后,运用自由落体肌肉挫伤装置制造大鼠右后肢骨骼肌挫伤模型(500 g、直径为1.5 cm的砝码自由落体)[20],在损伤后相应时间点大剂量麻醉剂处死大鼠,取挫伤处骨骼肌。死后损伤组用大剂量麻醉剂处死大鼠后制作挫伤模型,并分别于损伤后0.5、1、2和4h取材,死后大鼠放置在气候箱中,温度保持在22~24℃,湿度保持在40%~60%。对照组大鼠以相同方法直接处死后取相同部位骨骼肌,每次取材200mg。上述检材-80℃保存备用。
以上动物饲养、处理均通过了山西医科大学伦理审查委员会的审查(伦理审查序号2016LL151)。
1.3 总蛋白提取和Western印迹法
在研钵中加入液氮充分预冷后,将骨骼肌样本研磨成粉末。将粉末置于2mL的微量离心管中并加入裂解液,0℃裂解20 min,以1 200×g于4℃离心20 min,取上清液。用BCA试剂盒中的蛋白标准品检测结果做标准曲线并检测、计算每个样本的蛋白浓度。将上清液与蛋白上样缓冲液(5×)以体积比4∶1相混合,95℃加热变性5min。将等量的变性液加入十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)中进行分离跑胶,然后转印至硝酸纤维素滤膜(nitrocellulose filter membrane,NC膜)(膜孔直径为0.22 μm)。5%的脱脂奶粉室温孵育2 h;一抗4℃分别孵育过夜(兔抗-LC3A/B,1∶1 000;兔抗-BECN1,1∶1 000;兔抗-p62,1∶1 000;GAPDH,1∶5 000)。然后加入辣根过氧化物酶标记的二抗(1∶2000)室温孵育2h。增强型化学发光剂VA液∶VB液=1∶1混合滴加至NC膜上,UVP BioSpectrum 810凝胶成像系统拍照。VisionWorks LS凝胶成像分析系统(美国Ultra-Violet Products公司)通过计算3种目的蛋白条带以及内参蛋白GAPDH[18]灰度值,对目的蛋白进行相对定量。
1.4 数据统计与分析
采用SPSS 17.0(美国IBM公司)和GraphPad Prism 6.0(美国GraphPad Software公司)进行统计分析,计量资料用±s表示,组间比较采用单因素方差分析。数据经过中心化和标准化处理,计算公式:

式中,u为所有样本数据的均值,σ为所有样本数据的标准差,并选用不同的灰阶对数值进行处理[21](当两变量均<0时,用黑色表示;当两变量>0时,用白色表示;当其中一个变量>0,而另一变量<0时,则用灰色表示)。通过SPSS 17.0对所取得的样本数据进行正态分布以及方差齐性检验,SIMCA 14.1(瑞典Umetrics公司)中的正交偏最小二乘判别分析(orthogonal partial least squares-discrimination analysis,OPLSDA)用于生前损伤和死后损伤的判别。检验水准α=0.05。根据评价模型质量的3个关键指标(模型解释率Rx2、建模稳定性Ry2及模型预测性Q2)验证模型是否成功,为防止模型过拟合,采用200次响应排序检验的方法来考察模型的质量,即回归线在Y轴上的截距>0,拟合线在Y轴上的截距<0,且两条线相交于第一象限表明模型质量良好未发生过拟合。
2 结 果
2.1 大鼠骨骼肌中自噬相关蛋白BECN1、p62和LC3-2/LC3-1在生前损伤和死后损伤的表达
Western印迹法分别检测生前损伤组、对照组和死后损伤组大鼠骨骼肌中自噬相关蛋白的相对表达量(图1、表1)。结果显示,BECN1、p62蛋白表达量及LC3-2/LC3-1值在生前损伤和死后损伤的肌肉组织中虽有不同程度的变化,但差异无统计学意义。由此说明,依据传统的数据处理方法,无法满足生前损伤和死后损伤的鉴别。
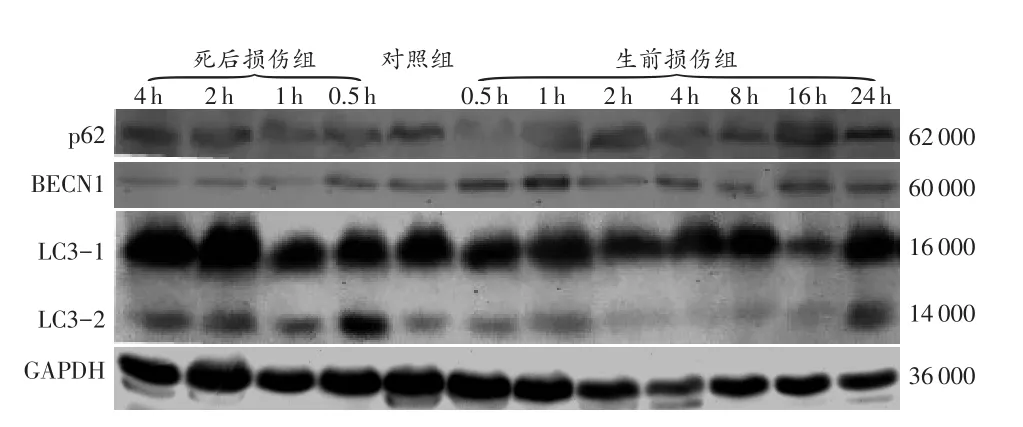
图1 3种自噬相关蛋白在大鼠骨骼肌中的表达Fig.1 Expressions of autophagy-associated proteins in the rat skeletal muscles
表1 大鼠生前损伤和死后损伤肌肉组织中自噬相关蛋白p62、LC3-2/LC3-1和BECN1的相对表达Tab.1 Expressions of autophagy-associated proteins p62,LC3-2/LC3-1 and BECN1 in the muscle tissues of rats in the antemortem and postmortem injury groups(n=6,±s)

表1 大鼠生前损伤和死后损伤肌肉组织中自噬相关蛋白p62、LC3-2/LC3-1和BECN1的相对表达Tab.1 Expressions of autophagy-associated proteins p62,LC3-2/LC3-1 and BECN1 in the muscle tissues of rats in the antemortem and postmortem injury groups(n=6,±s)
组别死后损伤4 h死后损伤2 h死后损伤1 h死后损伤0.5 0.4 5±0.3 7 0.2 0±0.1 3 0.2 7±0.1 8 0.5 8±0.3 9 0.1 5±0.1 7 0.2 9±0.1 5 0.7 7±0.4 3 0.2 3±0.3 8 0.3 4±0.1 3 h 0.5 2±0.4 1 0.7 2±1.4 8 0.3 0±0.1 9 0.6 2±0.5 1 0.1 5±0.1 1 0.3 7±0.2 2 h 0.5 3±0.8 9 0.2 3±0.1 7 0.9 6±0.8 5 0.8 8±1.0 4 0.6 5±0.8 0 0.6 4±0.3 4 0.6 0±0.7 1 0.9 5±0.9 5 0.3 3±0.2 1 0.9 0±0.8 8 0.3 9±0.5 9 0.6 9±0.4 7 0.7 0±0.4 3 0.6 1±0.9 7 0.9 7±1.0 2 h 0.9 4±0.8 1 0.3 1±0.2 3 1.1 5±1.1 1 h 0.7 4±0.3 8 0.8 2±0.5 6 1.8 5±2.1 3对照生前损伤0.5生前损伤1 h生前损伤2 h生前损伤4 h生前损伤8 h生前损伤1 6生前损伤2 4 p 6 2 L C 3-2/L C 3-1 B E C N 1
2.2 自噬相关蛋白BECN1和LC3-2/LC3-1值数据中心化
对BECN1自噬蛋白的表达量和LC3-2/LC3-1值中心化和标准化处理,结果如图2所示。
在数据处理过程中为了更直观地反映大鼠骨骼肌生前损伤和死后损伤蛋白表达的差异,本研究选用了不同的灰阶对BECN1和LC3-2/LC3-1值进行处理。结果显示,死后损伤和对照组均呈黑色,而生前损伤则呈现灰色或白色(图2),表明通过数据转换处理可以对生前损伤、死后损伤及对照组样本进行鉴别。
2.3 OPLS-DA对模型进行预测
本研究用BECN1和LC3-2/LC3-1值两个变量建立了有监督的OPLS-DA以区分生前损伤和死后损伤(图3)。用3个指标(BECN1、p62相对表达量及LC3-2/LC3-1值)在所有样本中的数值建立区分生前损伤和死后损伤的OPLS-DA模型(图3A),提取出两个主成分(图3B),其Rx2=0.563、Ry2=0.439、Q2=0.366。200次响应排序检验(图3C)以检测模型是否发生了过拟合,如图3C所示,回归线与Y轴的交点在0以上,而拟合线与Y轴的焦点在0以下,并且两直线相交于第一象限,表明模型未发生过拟合。

图2 BECN1的表达量和LC3-2/LC3-1值数据中心化和标准化处理情况Fig.2 Centralization and normalization of data of BECN1 and the ratio of LC3-2/LC3-1
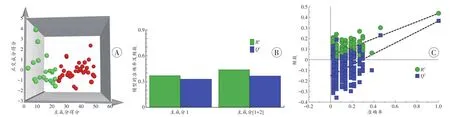
图3 大鼠骨骼肌生前损伤和死后损伤的OPLS-DA模型Fig.3 OPLS-DA model of antemortem and postmortem injury of the rat skeletal muscles
3 讨 论
自噬作用普遍存在于大部分真核细胞中,是细胞为了摆脱饥饿状态而将自己内部的部分蛋白质分解为氨基酸,从而获取养分的现象[1-5]。正常细胞中的自噬性溶酶体在消化、分解、自然更替一些细胞内的结构上起着重要作用。当细胞受到药物作用、射线照射和机械损伤时,其数量明显增多[4-7,12]。在组织细胞受到各种理化因素伤害时,自噬性溶酶体主要清除降解细胞内受损伤的细胞结构、衰老的细胞器以及不再需要的生物大分子等[1,3],因此对损伤的细胞起到保护作用。
本研究建立了大鼠肌肉挫伤模型,运用Western印迹法检测了3种自噬相关蛋白p62、BECN1和LC3的表达变化。结果显示,BECN1以及LC3-2/LC3-1值的变化情况与国内的大鼠皮肤挫伤后自噬作用增强的研究结果[15-16]较为一致,即自噬是细胞对损伤的一种反应。但与KIMURA等[18]研究中小鼠皮肤挫伤后自噬相关蛋白LC3-2/LC3-1值下降、p62表达水平升高的研究结果相反,其原因需要进一步研究。
为了明确机体在死亡过程中出现的骨骼肌缺氧、抽搐或收缩现象[22],以及在死后损伤中是否会诱发自噬现象发生,本研究检测了大鼠死后不同时间点在损伤肌肉组织中自噬相关蛋白表达的变化。结果表明,死后损伤0.5~4 h的大鼠肌肉组织中BECN1、p62和LC3均呈低表达水平,与未损伤的对照组差异无统计学意义,从而排除了死亡过程中肌肉缺氧、抽搐或收缩现象对自噬蛋白表达的影响,也为生前损伤和死后损伤(≥0.5h)的鉴别提供了可能。这一结果与KIMURA等[18]的发现相一致。
KIMURA等[18]同时以GAPDH为内参检测了LC3和p62在小鼠死后4 d内的自噬蛋白的降解,结果表明,LC3-2/LC3-1值在死后1d就出现了下降,但死后1~4d二者值差异无统计学意义。因此,在应用LC3-2/LC3-1值进行生前损伤和死后损伤鉴别时,要注意结合其他死后早期(死后4 h~1 d)征象,判断LC3-2/LC3-1值较低是未损伤或者死后损伤引起的,还是死后蛋白降解造成的。
传统的Western印迹法在获取蛋白的相对表达量时往往需要对数据进行标准化处理。这种标准化处理主要用于消除不同实验批次间的误差,却不能很好地反映实验样本间的变异情况[23]。数据中心化和标准化是一种类均值的标准化方法,即采用中心化和标准化的方法消除数据来源不同、量纲以及量纲单位不同的偏差,使数据具备了可比性,从而更真实地反映测量样本的生物学差异,达到更准确的聚类效果[23-24]。为了消除不同蛋白的基础表达量对生前损伤和死后损伤鉴别造成的偏差,本研究结果显示,对数据进行中心化和标准化处理,可以用两个指标的数值是否大于零,进行颜色赋值[21],从而更直观地区分大鼠生前损伤组和死后损伤组,其结果较KIMURA单纯用LC3-2/LC3-1值判断生前损伤与死后损伤有较高的准确性和客观性。
正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)是一种新型的多元统计方法,是在PLS-DA的基础上加入了正交信号矫正的分析方法,具有数据可视化强、模型的有效性和稳定性强等优势,其分析过程更侧重于样本的分组及组间差异[25-26]。本研究尝试用极少的变量(3种自噬相关蛋白)建立生前损伤和死后损伤的OPLS-DA 模型,Rx2、Ry2和Q2是反应模型准确性和预测性的3个重要指标。其中,Rx2和Ry2分别是提取的主成分对自变量和分类变量的解释程度,Q2是指该模型对样本变量的解释度。从3个变量提取的2个主成分对模型的解释度结果显示Rx2=0.563、Ry2=0.439,预测性结果显示Q2=0.366。即从3个变量中提取的2个主成分对模型的解释程度较好[27],但对模型的预测性较差,因此本研究采用OPLS-DA对小样本的3个指标建立的模型效果并不理想,这可能与小样本、少变量的数据进行降维处理时大量的变量信息丢失有关[25-26]。
同时,本研究也存在以下几点不足:(1)缺少对生前损伤组BECN1、p62和LC3在损伤对侧肌肉中的表达与损伤侧的对比;(2)未能增加样本量和指标,从而增加OPLS-DA对生前损伤和死后损伤模型的解释度与预测度;(3)未收集和检测法医学实践案例中的人体骨骼肌损伤样本加以验证。
机械性损伤可诱发大鼠骨骼肌细胞发生自噬,通过数据中心化处理自噬相关蛋白BECN1的表达量及LC3-2/LC3-1值可用于生前损伤与死后损伤的鉴别。
