甲醇芽孢杆菌蛋白酶的水解特性及酪蛋白水解产物活性分析
2020-07-23杨智杰罗天淇黎润坤曹永强杨贞耐
杨智杰,郑 喆,蔡 淼,赵 笑,罗天淇,黎润坤,陈 超,曹永强,杨贞耐,,*
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048;2.东君乳业(禹城)有限公司,山东 禹城 251200)
蛋白酶是一种具有复杂功能结构并能够催化蛋白质水解生成多肽以及小分子氨基酸的酶,主要来源于动物、植物和微生物,其中微生物是蛋白酶的良好来源[1]。微生物蛋白酶是细菌、酵母或者霉菌等一些微生物生长过程中产生的酶;由于微生物繁殖速率快、生长条件易于控制、具有良好的稳定性和特异性等优点,该类蛋白酶己经成为工业应用中的主要酶制剂来源。芽孢杆菌是生成蛋白酶最重要的微生物菌属之一[2-3];地衣芽孢杆菌作为生产中性和碱性蛋白酶的主要菌种己被报道多次[2,4]。
许多微生物蛋白酶在具有对酪蛋白高效的水解活力的同时,还可以切割牛乳中κ-酪蛋白的特定肽键,造成酪蛋白胶束被破坏,使牛乳由液态凝结为半固态,从而具有一定的凝乳活性。本实验所用的甲醇芽孢杆菌LB-1蛋白酶是一种从黄酒麦曲中分离出的具有较高凝乳活力的蛋白酶[5],含有759 个氨基酸,分子质量为80.37 kDa,pI值为9.23,最适凝乳温度和pH值分别为50 ℃和6.5。该酶应用于马苏里拉干酪加工中具备部分代替商业凝乳酶的潜力[6]。但是该酶的蛋白水解活力包括引起凝乳的关键水解位点、水解产物活性等仍鲜有深入研究。
本研究旨在了解蛋白酶LB-1的蛋白水解特性,特别是其蛋白水解的最适条件及稳定性、引起凝乳的关键水解位点,并对其酪蛋白水解产物的生物活性进行评价。以期为具有凝乳作用的甲醇芽孢杆菌蛋白酶在乳制品加工中的应用,以及该酶酪蛋白水解产物在功能性食品领域的研究开发提供理论支持。
1 材料与方法
1.1 材料与试剂
甲醇芽孢杆菌LB-1蛋白酶由本实验室提取分离纯化[5],并于-80 ℃冷冻保藏。
酪蛋白酸钠、乳清蛋白(均为食品级) 新西兰恒天然公司;2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基测定试剂盒 上海源叶生物科技有限公司。
1.2 仪器与设备
HWS12恒温水浴锅 上海一恒科学实验设备有限公司;CR21G III高速离心机 日本日立公司;Mini-Protein蛋白电泳设备、全自动凝胶成像设备 美国Bio-Rad公司;Infinite M200 PRO NanoQuant酶标仪 瑞士Tecan公司;PHTX-21电极放大器 美国Omega公司。
1.3 方法
1.3.1 不同条件对蛋白水解活力的影响测定
取1 g/100 mL酪蛋白酸钠溶液0.2 mL,加入0.001 g/mL酶液混匀,水浴恒温40 ℃,反应10 min后取出,加入0.4 mol/L三氯乙酸溶液0.4 mL终止反应,10 000 r/min离心5 min;取0.5 mL上清液,加入2 mL 0.4 mol/L Na2CO3溶液和0.5 mL福林-酚试剂;40 ℃反应20 min,测定在680 nm波长处吸光度A680nm。空白对照:取0.2 mL酶液与0.4 mol/L三氯乙酸0.4 mL混合,使其灭活,加入0.2 mL酪蛋白酸钠溶液,重复上述步骤,上清液作为空白对照,测吸光度A’680nm。本实验条件下,60 min引起A680nm增加0.001单位所需的酶量为1 个酶活力单位,1 mL酶液的蛋白水解活力计算公式如下:
蛋白水解活力/(U/mL)=2×(A680nm-A’680nm)
1.3.1.1 温度的影响
取1 g/100 mL的酪蛋白酸钠溶液0.2 mL,加入0.001 g/mL蛋白酶LB-1酶液0.2 mL;分别在22、27、32、37、42、47、52、57、62 ℃反应10 min;重复3 次测定蛋白水解活力。
1.3.1.2 pH值的影响
取pH值分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的1 g/100 mL酪蛋白酸钠溶液0.2 mL,加入0.001 g/mL蛋白酶LB-1酶液0.2 mL,重复3 次测定蛋白水解活力。
1.3.1.3 添加物的影响
酶在金属盐(氯化钾、氯化钠、氯化锂、氯化锌、氯化镁、氯化钙、氯化铜、氯化镉、氯化铅)、有机溶剂(甲醇、乙醇、异丙醇、乙腈和二甲基亚砜)、变性剂(尿素)、洗涤剂(曲拉通-100、SDS)的溶液中孵育2 h,测定其蛋白水解活力,计算剩余酶活力占未处理酶活力的百分比。
1.3.2 蛋白酶对乳清蛋白、酪蛋白水解作用分析
1.3.2.1 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
SDS-PAGE按照Laemmli[7]的方法进行。分离胶12.5%,浓缩胶4.5%;电泳开始时电压为45 V,当样品从浓缩胶进入分离胶后把电压调至65 V,直到样品离末端1.5 cm停止。使用考马斯亮蓝R250染色,脱色过夜。
1.3.2.2 水解过程中pH值和氧化还原电位(oxidationreduction potential,ORP)分析
采用Topcu等[8]的方法,用iCinac(12 VDC,96 W)测量pH值和ORP。在校准之后将Pt电极直接插入接种蛋白酶LB-1的10 g/100 mL乳清蛋白、酪蛋白溶液中,深度为5 cm。电极通过放大器连接到数据记录仪进行数据采集。每5 min记录一次数据,持续360 min。
1.3.2.3 水解时间和酶质量浓度对酪蛋白和乳清蛋白水解的影响
分别在1 mL 1 mg/mL酪蛋白和乳清蛋白溶液中加入100 μL 0.625 mg/mL的蛋白酶LB-1,在40 ℃分别反应0、5、15、30、60、120、180、360 min后沸水浴5 min灭酶,用SDS-PAGE分析测定蛋白水解程度。
将不同质量浓度(0、0.312 5、0.625、1.25、2.5、5、10、20 mg/mL)的酶液加入1 mL 1 mg/mL的酪蛋白和乳清蛋白中,水解30 min后沸水浴5 min灭酶,用SDS-PAGE分析测定蛋白水解程度。
1.3.3 酶质量浓度对酪蛋白不同组分标准品水解的影响
分别配制质量浓度为0、0.015 625、0.031 25、0.062 5、0.125、0.25、0.5、1 mg/mL蛋白酶LB-1溶液,取10 μL分别加入100 μL 10 mg/mL α-、β-、κ-酪蛋白标准品中,50 ℃反应30 min,沸水浴5 min灭酶,使用1.3.2.1节方法测定蛋白水解程度。
1.3.4 蛋白酶对κ-酪蛋白水解位点分析
参照王颜颜[9]的方法分别进行胶粒脱色、胶粒脱水、还原烷基化、酶切、肽段提取、质谱检测、数据库检索。
1.3.5 酪蛋白水解产物活性分析
酪蛋白水解活力肽的制备:制备10 g/100 mL的酪蛋白酸钠溶液,按照蛋白酶LB-1与酪蛋白1 000 U/g比例添加蛋白酶LB-1,并在最适pH值和温度下进行水解。分别水解0、1、3、6、12 h后沸水浴10 min终止酶促反应。10 000 r/min离心15 min,静置后收集上清液,-20 ℃保存,待进一步分析[10]。
1.3.5.1 DPPH自由基清除能力测定
取1 mL水解产物上清液样品与2 mL 0.2 mmol/L DPPH-甲醇溶液混合,室温下避光反应1 h,10 000 r/min离心10 min,取上清液,测定517 nm波长处的吸光度。空白组以等体积甲醇代替DPPH溶液,对照组以等体积无菌水代替样品。
1.3.5.2 ABTS阳离子自由基清除能力测定
采用ABTS阳离子自由基测定试剂盒。
1.3.5.3 α-淀粉酶抑制活性
多肽溶液对α-淀粉酶抑制作用分析依据Eleazu等[11]的方法进行。25 μL多肽样品与25 μL含α-淀粉酶(0.5 mg/mL)的磷酸盐缓冲液(20 mmol/L,pH 6.9)混合,25 ℃反应10 min,加入25 μL含0.5 g/100 mL淀粉的磷酸盐缓冲液(20 mmol/L,pH 6.9),25 ℃反应10 min,加入50 μL 196 mmol/L二硝基水杨酸显色剂,反应混合物沸水浴10 min,冷却至室温,测定540 nm波长处的吸光度。
1.3.5.4 α-葡萄糖苷酶抑制作用
5 μL α-葡萄糖苷酶溶液(1.0 U/mL)、20 μL多肽溶液与165 μL磷酸盐缓冲溶液(0.1 mmol/L,pH 6.8)混合,在96 孔板中37 ℃反应10 min,加入10 μL含0.95 mmol/L对硝基苯基-α-D-吡喃葡萄糖苷的磷酸盐缓冲液(0.1 mol/L,pH 6.9),37 ℃反应10 min,加入100 μL 1 mol/L Na2CO3溶液终止反应。测定405 nm波长处的吸光度。
1.3.5.5 钙离子、锌离子螯合能力测定
取等体积的多肽溶液和0.25 mol/L氯化钙溶液混合,用0.1 mol/L NaOH和0.1 mol/L HCl溶液将反应混合物调整为pH 6.0~7.5。然后将溶液在45 ℃、80 r/min的水浴摇床中孵育1 h,充分反应[12]。将螯合物加入9 倍体积的乙醇沉淀,6 000 r/min、4 ℃离心15 min,取上清液使用乙二胺四乙酸显色滴定法测定螯合能力。钙螯合使用铬黑T作为指示剂,锌螯合使用二甲酚橙作指示剂。
1.4 数据分析
数据均采用3 次平行实验取平均值,使用SPSS软件进行方差分析,P<0.05,差异显著。
2 结果与分析
2.1 不同条件对蛋白酶LB-1水解活力的影响
2.1.1 温度和pH值的影响
由图1A可以看出,水解活力在27~62 ℃之间呈现出先缓慢上升再骤降的趋势,在62 ℃时蛋白水解活力降至最低26.2 U/mL。原因可能是高温改变了酶的内部结构,使蛋白酶活性受到影响而导致其水解活力迅速降低。在52 ℃时,蛋白水解活力达到最大值46.49 U/mL,且温度低于55 ℃时,蛋白酶LB-1具有较好的热稳定性。由图1B可知,当pH值在5.5~6.0范围变化时,蛋白水解活力随着pH值增加快速上升,在pH值大于7.0时,蛋白水解活力稍有下降之后趋于平缓。说明此酶在弱酸性的条件下(pH 6.0~7.0)拥有较高的蛋白水解活力。己有研究表明,不同来源的微生物蛋白酶最适温度和pH值有所不同。地衣原体5A1蛋白酶[13]在pH 5.5、70 ℃时蛋白水解活力较高;枯草芽孢杆菌蛋白酶[14]在pH 6.0和60 ℃时具有最佳的水解活力;粪肠球菌2495L[15]的最佳水解温度在50 ℃,pH值在8.0~9.0。

图1 温度(A)和pH值(B)对甲醇芽孢杆菌LB-1蛋白酶水解活力的影响Fig. 1 Effect of temperature and pH on proteolytic activity of LB-1
2.1.2 添加物的影响
在金属离子、有机试剂、变性剂、洗涤剂等添加物存在的条件下,蛋白酶LB-1的稳定性如表1所示。大部分添加物,如单价阳离子(K+、Na+、Li+)、部分二价阳离子(Zn2+、Mg2+、Ca2+)、甲醇、乙醇、乙腈、二甲基亚砜、尿素、非离子去污剂曲拉通-100溶液,对蛋白酶活性影响较小,相对水解活力均保持在95%以上,没有明显的抑制作用。少数添加物对蛋白酶水解活力影响较大,如Cu2+使相对活力微弱降低至92.23%;异丙醇使酶的相对活力降低至82.13%;而重金属离子(Cd2+、Pb2+)、阴离子洗涤剂SDS尤其是Pb2+和SDS几乎使酶失活,蛋白酶的相对水解活力仅剩10%左右。
上述结果表明Cu2+对该蛋白酶水解活力产生了负面影响,但不是该蛋白酶的高效抑制剂。Eltanboly等[16]发现Cu2+抑制毛霉QM436蛋白酶活力程度也比较低,但蛋白酶LB-1受到的抑制作用更小。异丙醇能够破坏蛋白质周围的水结构,改变酶的中心构象,从而引起蛋白质功能的改变。重金属离子可能会破坏酶的构象,引起活性的大幅度改变。洗涤剂对蛋白质的影响取决于洗涤剂和蛋白质两者的性质以及环境条件[17],两种表面活性剂对酶活性的影响差异明显,可能的原因是对酶的界面性质改变情况不同,从而对酶的催化功能产生了不同的影响。

表1 不同添加物对甲醇芽孢杆菌LB-1蛋白酶水解活力的影响Table 1Effects of different additives on proteolytic activity of LB-1
2.2 蛋白酶LB-1对乳清蛋白和酪蛋白的水解作用对比


图2 甲醇芽孢杆菌LB-1蛋白酶对乳清蛋白和酪蛋白的水解作用Fig. 2 Hydrolysis ef ficiency of whey and caseins by LB-1
如图2A、B所示,在水解开始后的360 min内,乳清蛋白和酪蛋白的pH值均不断降低,分别由最初的6.52和6.66降至6.39和6.33。前30 min的pH值下降迅速,之后趋于缓慢。乳清蛋白的ORP在水解时间内,呈现先降低后缓慢升高的趋势,并于水解第140分钟时达到最低点(91.45 mV)。酪蛋白的ORP则呈现出先迅速下降,再快速上升的趋势,在水解第50分钟时达到最低值(137.86 mV),最终ORP值(172.64 mV)与初始值(176.88 mV)相差不大。
蛋白水解过程中,pH值和ORP的变化可能会影响到带电分子的电离状态,从而影响蛋白质的结构稳定性和蛋白酶的活性,因而会影响到蛋白水解程度[18]。蛋白酶LB-1在水解蛋白过程中pH值降低,可能是由于蛋白质水解生成氨基酸残基,在溶液中产生了游离的氢离子,这也是水解前期ORP变化迅速的可能原因。以酪蛋白为底物时,蛋白水解过程中pH值和ORP变化程度均大于乳清蛋白,说明该酶对酪蛋白的水解程度大于乳清蛋白。
如图2C所示,蛋白酶LB-1对乳清蛋白水解360 min内均未产生明显小于10 kDa的水解产物,随着时间的延长略有水解,但作用不明显。改变蛋白酶LB-1质量浓度后,对乳清蛋白水解过程SDS-PAGE分析的结果(图2E)显示,各电泳条带依旧无明显变化。
如图2D所示,随着水解时间延长,酪蛋白条带逐步消失,水解产物丰富。水解120 min后(第6泳道),25~30 kDa的酪蛋白基本水解完全,水解360 min后(第8泳道)基本只有水解产物存在。位于10~15 kDa和小于10 kDa的水解产物从水解5 min后(第2泳道)开始出现,含量随着时间延长逐步增加。从第120分钟开始出现了分子质量更小的水解产物,并在水解360 min后产量达到最大值。改变蛋白酶LB-1质量浓度(图2F),酪蛋白的水解程度随着酶质量浓度上升而逐步增大,在5 mg/mL(第6泳道)的酶质量浓度下,水解产物大量生成,在酶质量浓度增加至10 mg/mL(第7泳道)时,底物被完全水解。当酶质量浓度增加至20 mg/mL(第8泳道)时,大部分水解产物也会被进一步分解。
蛋白酶LB-1对乳清蛋白的水解作用并不明显,不同酶质量浓度下各泳道的蛋白条带没有明显变化,表明蛋白酶LB-1对乳清蛋白的水解活力比较低,且提高酶质量浓度也不能有效提高乳清蛋白水解程度;而绝大部分酪蛋白经过180 min己被水解完,说明酪蛋白拥有蛋白酶LB-1的多个水解位点,数量远大于乳清蛋白,且随着酶质量浓度的增大,酪蛋白的水解程度逐步增大,表明分解酪蛋白产生的肽段当中依旧存在酶的水解位点。与此结果相类似的是,Jiang等[19]从糯米酒中分离的微生物蛋白酶同样水解酪蛋白的程度显著大于乳清蛋白。因此本研究选取3 种酪蛋白标准品进行了进一步水解分析,以探究该酶具体的作用蛋白。
2.3 蛋白酶LB-1对不同酪蛋白标准品的水解作用对比

图3 不同蛋白酶质量浓度下酪蛋白标准品的水解Fig. 3 Hydrolysis efficiency of individual caseins by the protease at different concentrations
随着蛋白酶质量浓度从0 mg/mL增加到1 mg/mL,β-酪蛋白无明显变化(图3B),所有条带均与0 mg/mL时保持一致,α-酪蛋白(图3A)和κ-酪蛋白(图3C)水解明显。在1 mg/mL(第8泳道)的质量浓度下,α-酪蛋白和κ-酪蛋白几乎水解完全,对应条带消失。但是α-酪蛋白的水解产物稳定性较差,在1 mg/mL(图3B第8泳道)的酶质量浓度下产物降解为更小的肽段,对应条带消失。κ-酪蛋白(图3C)在较低酶质量浓度0.031 25 mg/mL时(图3C第2泳道)产生了一条明显的蛋白水解条带,分子质量大小约为11 kDa。
上述结果表明,LB-1蛋白酶对β-酪蛋白的水解不敏感,对α-、κ-酪蛋白的水解具有较高的活性,这与来源于粪肠球菌TUA2495L[15]和鸡枞菌MTCC5091[20]的微生物蛋白酶的水解特性一致。但是α-酪蛋白的水解产物稳定性较差,只有κ-酪蛋白具有存在于整个水解过程的水解产物,说明该蛋白条带为蛋白酶LB-1水解κ-酪蛋白的主要水解产物。由于该条带与凝乳酶使牛乳凝乳后所产生的副κ-酪蛋白分子质量接近(12.268 kDa),该主要肽段的生成很有可能是蛋白酶LB-1具有凝乳作用的关键。因此对κ-酪蛋白进行进一步的水解位点分析。
2.4 蛋白酶LB-1对κ-酪蛋白的水解位点分析

表2 胰蛋白酶处理显示的κ-酪蛋白序列片段Table 2 Peptide fragments of κ-casein treated with trypsin
将蛋白酶LB-1水解κ-酪蛋白得到的主要肽段(约11 kDa)用胰蛋白酶酶解,将酶解片段进行液相色谱-串联质谱指纹图谱分析,结果如表2所示。胰蛋白酶酶解得到12 条肽段,所有肽段均以赖氨酸或精氨酸结尾,符合胰蛋白酶的水解规律。从图4可以看出,κ-酪蛋白裂解出的主要肽段中,多肽肽段序列从κ-酪蛋白氨基端的第22位异亮氨酸开始,到第112位的赖氨酸结束,且未检测到113位的天冬氨酸残基,表明蛋白酶LB-1对κ-酪蛋白的水解位点主要有2 个,分别为Lys21-Ile22和Lys112-Asn113。这个主肽含有90 个氨基酸,分子质量为10.537 kDa,这与凝胶电泳分析(图3C)的大小一致。

图4 κ-酪蛋白的主要裂解位点分析Fig. 4 Analysis of the key cleavage sites of κ-casein
近年来多种植物与微生物来源的蛋白酶对κ-酪蛋白水解位点相继被报道,生姜源蛋白酶[21]的水解位点位于Ala90-Glu91和His102-Leu103,中华猕猴桃源蛋白酶[22]的水解位点为Arg97-His98或Lys111-Lys112,向日葵种子提取物凝乳酶[23]和鸡枞菌MTCC5091蛋白酶[20]的水解位点均为Phe105-Met106,合欢种子提取物凝乳酶[23]的水解位点为Lys116-Thr117。不同来源的蛋白酶对κ-酪蛋白的水解位点有所差异,但这些主要水解位点的断裂,均可产生一定的凝乳作用。
2.5 蛋白酶LB-1水解酪蛋白的产物活性分析
2.5.1 酪蛋白水解产物抗氧化活性分析

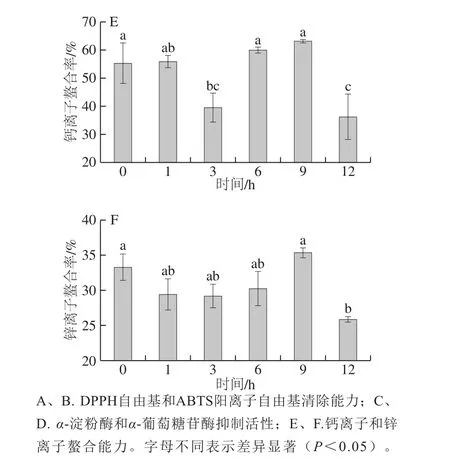
图5 酪蛋白水解产物的生物活性Fig. 5 Bioactivity of casein hydrolysates
如图5A所示,水解0 h的酪蛋白具有62.58%的DPPH自由基清除率,在水解的前6 h,DPPH自由基清除能力随着酪蛋白水解程度的升高而逐步升高,达到最大清除率75.4%,上升了12.81%。在第9小时趋于稳定,第12小时略有降低。清除率下降的原因可能是水解12 h几乎己无酪蛋白存在,部分具有活性的产物也水解成了更短的肽段,消减了其抗氧化的能力。如图5B所示,各水解产物的ABTS阳离子自由基清除率较第0小时均有升高,其中3~9 h清除率稳定在42%左右,第12小时到最大值48.45%,清除率相对升高了13.75%。
DPPH法和ABTS法均为常用的测定抗氧化功能的方法,国内外己有众多研究。高婷等[24]通过优化AS1398中性蛋白酶水解酪蛋白的条件,使酶解产物的DPPH自由基清除率达到了80.43%。韩娜等[25]通过分离纯化肽段,得到与酪蛋白酶解液DPPH自由基清除率差异显著的结果。Mohamed[26]以牛乳和水牛乳为底物,得到的水解产物ABTS阳离子自由基清除率在34.12%~58.44%之间,这与本实验的结果类似。
2.5.2 酪蛋白水解产物降血糖活性分析
由图5C可知,蛋白酶LB-1水解酪蛋白所有时间段的酶抑制率均在70%以上,能够起到良好的酶抑制作用。加入蛋白酶后,不同水解时间产物的α-淀粉酶抑制率均有不同程度的升高,第1小时和第6小时的抑制率最高,均在80.89%,相对增高了7.65%。α-葡萄糖苷酶的抑制率(图5D)在第0小时只有13.81%,水解开始后,抑制率迅速上升,3 h后水解程度和α-葡萄糖苷酶抑制率不断升高,在第12小时达到最大值93.12%,相比第0小时上升了79.31%。经水解后的酪蛋白相比第0小时未水解酪蛋白的α-葡萄糖苷酶抑制率均有明显增加,说明蛋白酶LB-1水解酪蛋白产生的多肽对α-葡萄糖苷酶的抑制作用十分明显,且肽段越小抑制作用越强。
抑制α-淀粉酶和α-葡萄糖苷酶的活性能够降低餐后血糖水平,减缓淀粉的消化与分解,这对II型糖尿病患者和边缘性糖尿病患者具有积极作用[27]。目前己有类似研究发现,酪蛋白水解产生的含有7 个氨基酸残基的寡肽(YPFPGPI)[28]能够抑制小肠对葡萄糖的吸收从而达到降血糖的目的[29]。
2.5.3 酪蛋白水解产物金属螯合活性分析
如图5E所示,第3小时和第12小时的钙离子螯合率在40%以下,其他时间水解产物螯合率都在55%以上,第9小时螯合率最高达到63.13%,第12小时最低只有36.27%。锌离子螯合率(图5F)与钙离子的趋势相类似,但螯合率均比钙离子低。水解第0小时的螯合率(33.26%)仅次于第9小时(35.31%),第12小时最低为25.83%。
钙离子、锌离子的螯合需要多肽上特定的氨基酸序列或者氨基酸残基提供的结合位点,12 h的长时间水解己经使大部分水解产物多次水解,仅剩小分子肽段,造成与金属螯合率降低。而对于0 h的酪蛋白而言,其本身就具备一定的金属结合能力[30],且大分子的蛋白结构,亦有可能会对金属离子进行掩埋,从而造成螯合率较高的现象。但是,酪蛋白在肠胃进行消化时,会失去原有结构以及序列,导致螯合的金属离子无法被肠道直接吸收利用,而无法达到金属补充剂的目的。
3 结 论
本研究测定了甲醇芽孢杆菌蛋白酶LB-1在不同温度、pH值、添加物条件下的水解活力,结果表明该蛋白酶最适水解温度为52 ℃,最适pH值为6.0~7.0,对大部分金属离子、有机试剂、变性剂和洗涤剂表现出了较高的稳定性。
分别以乳清蛋白和酪蛋白为底物进行的水解实验表明,蛋白酶LB-1对乳清蛋白的水解不明显,但对酪蛋白水解作用显著。以α-、β-、κ-酪蛋白标准品作为底物进行的水解实验进一步表明,该酶对κ-酪蛋白具有较高的水解活力和水解产物稳定性,水解位点主要位于Lys21-Ile22和Lys112-Asn113,得到分子质量为10.537 kDa的主要肽段。
对蛋白酶LB-1在最适条件下水解酪蛋白的产物进行生物活性分析,结果表明其DPPH自由基和ABTS阳离子自由基的清除率分别可达75.4%和48.45%,α-淀粉酶和α-葡萄糖苷酶的最高抑制率分别为80.89%和93.12%,钙离子和锌离子的最高螯合率分别为63.13%和35.31%;表明该酶具有一定的抗氧化能力和降血糖作用,以及良好的金属离子螯合能力。甲醇芽孢杆菌蛋白酶LB-1水解酪蛋白的产物可作为新型功能性食品配料,在功能性干酪加工和乳源活性肽开发方面具有潜在的应用价值。
