ARTP-DES连续诱变选育高产ε-聚赖氨酸突变株
2020-07-23席志文黄林娜翟一畅惠丰立
席志文,黄林娜,翟一畅,惠丰立
(南阳师范学院生命科学与技术学院,河南 南阳 473061)
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是由链霉菌产生的由25~35赖氨酸单体组成的一种天然聚合物。由于其具有广谱抑菌性[1],被广泛应用于食品保鲜行业[2-3]。此外,ε-PL还具有水溶性好、热稳定强、安全性能高等优点,在医学、农药等领域也有很大的应用潜力[4-5]。野生型菌株ε-PL产量很低,无法满足工业化生产。对野生菌株进行选育以提高其ε-PL产量在工业化生产中占有举足轻重的地位。日本学者最早通过选育S-2-氨乙基-L-半胱氨酸抗性菌株,获得了摇瓶产量2.1 g/L的高产ε-PL菌株,提高了近20 倍[6]。国内也有一些文献报道[7-12]。陈纬纬等[7]对Kitasatospora PL623采用硫酸二乙酯(diethyl sulfate,DES)诱变,将其ε-PL摇瓶产量提高了2 倍,达到1.17 g/L;Zong Hong等[8]通过对Streptomyces albulus A-29进行ARTP诱变,其ε-PL产量从0.40 g/L提高至1.59 g/L。近年来核糖体工程技术[13-17]、原生质体融合[18-21]以及分子学手段[22-23]等也引入到ε-PL高产菌的选育中。吴光耀等[13]对S. albulus AS3-14连续引入链霉素和利福平两种抗生素,获得1 株双抗高产突变株S. albulus WG-608,ε-PL摇瓶产量达到3.7 g/L,较出发菌株提高42.3%;Wang Liang等[14]通过基因组重排技术结合庆大霉素抗性筛选,得到1 株抗性突变株S. albulus AG3-28,ε-PL摇瓶产量为3.43 g/L,较出发菌株提升49.1%。可见不管采用何种选育手段,只要确定合适的条件,都能一定程度提高目的菌株的ε-PL产量。
传统诱变不需要了解菌株自身复杂的遗传背景,可以直接进行诱变,诱变过程简单[24]。其关键在于确定合适的诱变及筛选手段。新兴的诱变技术虽然筛选效率较高,但是由于代谢合成过程的高度复杂,也面临着遗传稳定性较低、过程繁琐等问题。目前对于产ε-PL菌株的选育主要是以传统诱变为基础的非理性改造,主要集中在单因子诱变及多因子间断诱变[7-11],诱变效果不尽相同。对于多因子连续诱变的研究较少。有学者对1 株工业酿酒酵母采用己烯雌酚和紫外线连续复合诱变,得到的高产菌株乙醇产量高于常规诱变获得的菌株,且此方法正突变率也高于常规复合诱变[25]。因此,本研究以传统诱变为基础,对1 株ε-PL产生菌小白链霉菌S. albulus进行常温室压等离子体(atmospheric and room temperature plasma,ARTP)与DES两因子连续诱变,通过ARTP诱变创造丰富的突变基因组文库,以突变文库作为DES诱变的“出发菌株”,并改进突变菌筛选方法,探究一种更高效的选育方法,以期获得1 株性能稳定的高产突变株,为其工业化打下基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
工业菌株小白链霉菌为本实验室保存。
1.1.2 培养基
贝特纳固体培养基:葡萄糖1%,蛋白胨0.2%,酵母粉0.1%,琼脂2%,pH 7.5;M3G种子(发酵)培养基:葡萄糖5%,酵母粉0.5%,硫酸铵1%,磷酸二氢钾0.14%,磷酸氢二钾0.08%,七水合硫酸镁0.05%,硫酸锌0.004%,硫酸铁0.003%,pH 6.8;优化培养基[13]:葡萄糖6%,酵母粉0.8%,硫酸铵0.5%,七水合硫酸镁0.2%,磷酸二氢钾0.2%,硫酸锌0.003%,硫酸铁0.004%,pH 6.8;RSM培养基[13]:葡萄糖6%,牛肉膏1%,硫酸铵0.5%,七水合硫酸镁0.08%,磷酸二氢钾0.4%,硫酸铁0.004%,pH 6.8;亚甲基蓝培养基:固体培养基加0.002%亚甲基蓝。上述培养基均在115 ℃灭菌20 min。
1.2 仪器与设备
ARTP诱变育种系统 无锡源清天木生物科技有限公司;多功能酶标仪 美国PerkinElmer公司;ZWYR-D2403型恒温培养振荡器 上海智城分析仪器制造有限公司;SGD-IV型还原糖测定仪 山东省科学院生物研究所;MB100-4A型微孔板恒温振荡器 杭州奥盛仪器有限公司;CT14RD11台式离心机 上海天美生化仪器设备有限公司。
1.3 方法
1.3.1 单孢子悬浮液制备
将出发菌株在贝特纳固体平板上活化,30 ℃培养5~7 d至孢子长满平板,用15%的灭菌甘油冲洗下孢子,经4 层无菌擦镜纸过滤2 次,适当稀释孢子悬液,使其浓度在108CFU/mL左右,-80 ℃保藏备用。
1.3.2 小白链霉菌的连续诱变
1.3.2.1 ARTP诱变
取出发菌株孢子悬液10 μL均匀涂到无菌金属诱变片上,将装有诱变片的平皿转移至提前灭菌的ARTP诱变仪工作室中。工作电压110 W,照射距离2 mm,工作气流10 slpm,设置照射时间30、45、60、90、105、120、150、180 s。将处理过的诱变片于1 mL生理盐水的EP管中充分混匀,稀释涂布平板,每个时间设置3 个平行,30 ℃培养3~5 d,记录每个平板的菌落数,以出发菌株的菌落数作对照,计算致死率。
1.3.2.2 ARTP-DES连续诱变
选取合适的ARTP诱变条件对出发菌株进行诱变,将所得孢子悬液于恒温摇床30 ℃培养30 min后加入到pH 7.0磷酸缓冲液中,配成20 mL反应体系,分别加入40、80、120、160、200 μL DES,使其反应体积分数分别为0.2%、0.4%、0.6%、0.8%、1.0%,30 ℃避光反应20 min后加入25%硫代硫酸钠(Na2S2O3)终止反应,稀释涂布平板,30 ℃培养3~5 d,以孵育后的孢子悬液为对照,根据平板菌落数计算连续诱变致死率。图1为连续诱变技术流程图。
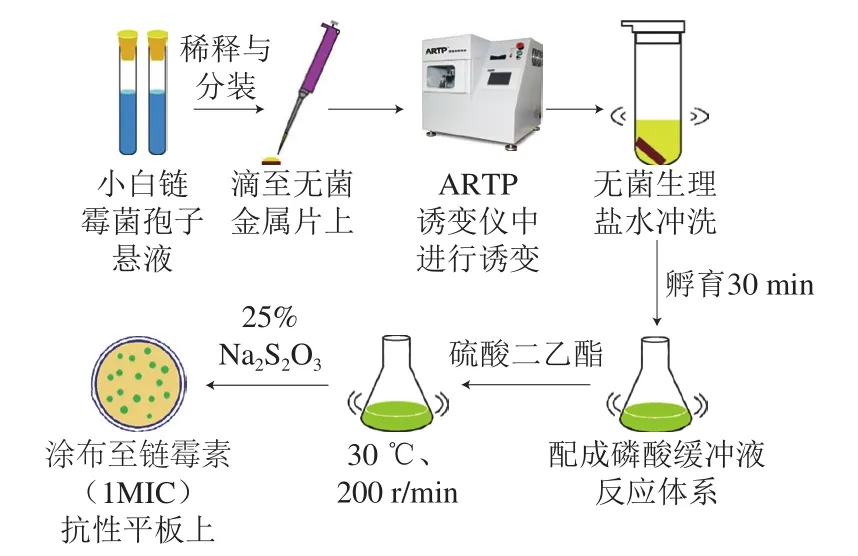
图1 连续诱变流程Fig. 1 Flowchart of continuous mutagenesis
1.3.3 突变菌株的筛选
将诱变后的孢子悬液梯度稀释,均匀涂布链霉素最小抑菌浓度(minimum inhibitory concentration,MIC)抗性平板,30 ℃培养5~7 d。初筛时用无菌牙签挑取抗性平板上刚长出的单菌落至亚甲基蓝平板中,30 ℃培养5~7 d,选取透明圈较大的单菌落划线贝特那固体平板培养3~5 d。挑取平板上成熟孢子接种至M3G种子培养基的48微孔板中(装液量0.5 mL),30 ℃、500 r/min培养24 h;以10%接种量转接种子液至M3G发酵培养基中,每孔3 个平行,30 ℃、500 r/min培养84 h。采用酶标仪对其ε-PL含量快速测定。挑选ε-PL产量得到提升的菌株划线贝特那固体平板。
复筛时挑取初筛所得菌株的孢子至装有20 mL M3G种子培养基的100 mL三角瓶中,培养24 h,以10%接种量转接种子液至M3G发酵培养基中,培养84 h。摇瓶培养条件为30 ℃、200 r/min。测定ε-PL含量,选出高产菌株。
1.3.4 指标分析测定
1.3.4.1 突变率及正突变率
突变率及正突变率计算如式(1)、(2)所示:

式中:T为挑选菌落总数;M为突变菌总数(为避免误差,选取产量高于或低于出发菌株5%以上的菌株);P为ε-PL产量大于出发菌株5%以上的突变菌总数。
1.3.4.2 ε-PL含量测定
参考甲基橙测定法[26]:取1 mL发酵液,8 000 r/min离心15 min,上清液用0.7 mmol/L pH 6.9磷酸缓冲液稀释,使ε-PL质量浓度在0.01~0.12 g/L之间。2 mL稀释液与等体积1 mmol/L甲基橙溶液振荡反应,30 ℃、200 r/min反应30 min。离心上清稀释20 倍后吸取250 μL加入96 微孔板中,用酶标仪测定465 nm波长处的OD值,根据标准曲线计算ε-PL质量浓度。
1.3.4.3 菌体干质量测定
取10 mL发酵液,8 000 r/min离心10 min,弃上清液,用无菌水洗涤2 次,用提前称量的滤纸过滤,100 ℃过夜烘至质量恒定,得到菌体干质量。
1.3.4.4 发酵液葡萄糖含量测定
采用SGD-IV型还原糖测定仪测定。
1.3.5 高产菌株生理特性
1.3.5.1 不同培养基发酵性能测试
刮取平板上突变菌株AD-9与出发菌株孢子接种至装有20 mL M3G种子培养基的100 mL三角瓶中,30 ℃、200 r/min培养24 h,后按10%接种量分别接种至M3G发酵培养基、RSM培养基及优化培养基中,30 ℃、200 r/min培养84 h。检测发酵液ε-PL质量浓度。
1.3.5.2 发酵过程中菌丝球差异
刮取平板上突变菌株AD-9与出发菌株孢子接种至M3G种子培养基,30 ℃、200 r/min培养24 h,以10%接种量转接至优化培养基。取发酵至24、48、72 h的发酵液,采用微分干涉显微镜观察菌丝球形态。
1.3.5.3 高产菌株与出发菌株摇瓶自然发酵过程比较
刮取平板上突变菌株AD-9与出发菌株孢子接种至M3G种子培养基,30 ℃、200 r/min培养24 h,后按10%接种量接种至优化培养基,培养84 h。测定发酵过程中pH值、菌体干质量及ε-PL含量,每隔12 h取一次样,每瓶3 个重复。
1.4 数据处理
数据分析和图像绘制均采用GraphPad Prism5软件处理。
2 结果与分析
2.1 小白链霉菌的连续诱变
2.1.1 ARTP诱变时间确定
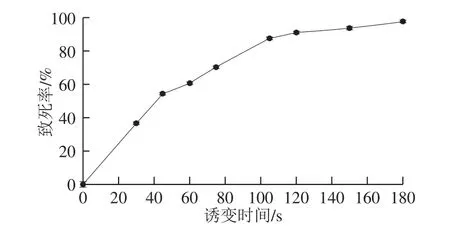
图2 小白链霉菌ARTP诱变致死率曲线Fig. 2 Death rate of S. albluus caused by ARTP
图2 结果表明,致死率随诱变时间的延长不断变大,180 s致死率达到97.4%,接近100%。本研究为构建多样基因组文库,选取低(照射时间30 s、致死率36.8%)、中(照射时间60 s、致死率60.8%)、高(照射时间105 s、致死率87.6%)3 个致死率对出发菌株进行诱变。
2.1.2 DES诱变剂量的确定
按1.3.2.2节方法取出发菌株孢子悬液200 μL加入19.8 mL磷酸缓冲液中,分别加入40、80、120、160、200 μL DES原液,使其体积分数为0.2%、0.4%、0.6%、0.8%、1.0%,30 ℃避光反应20 min,反应结束后立即加入1 mL 25% Na2S2O3溶液终止反应,以出发菌株孢子悬液作为对照,稀释涂布平板,30 ℃培养3~5 d,根据平板菌落数计算致死率。出发菌株DES诱变致死率曲线如图3所示,DES体积分数为1.0%时,致死率达到97.1%,DES体积分数为0.6%时,致死率为81.1%。本研究选取体积分数0.6%为小白链霉菌的DES诱变剂量。
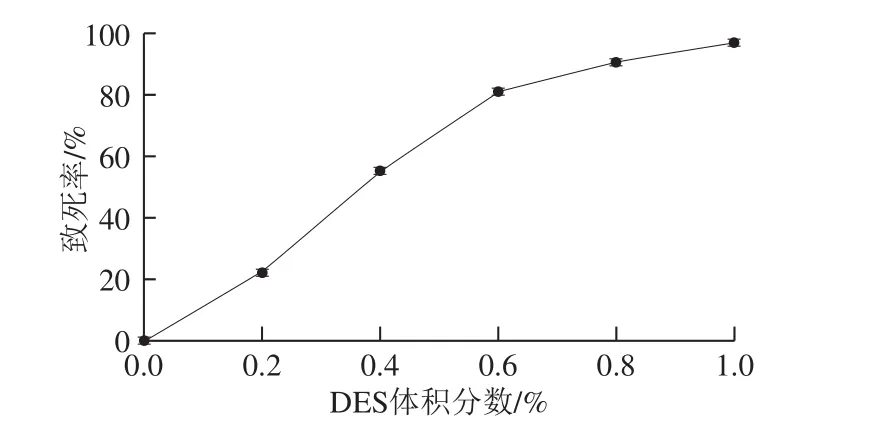
图3 小白链霉菌DES诱变致死率曲线Fig. 3 Death rate of S. albluus caused by DES
2.1.3 ARTP-DES连续诱变剂量的确定
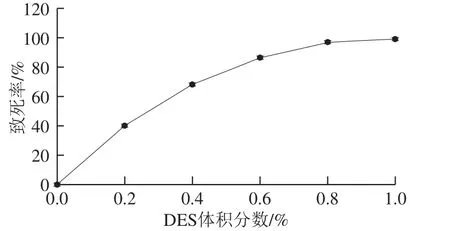
图4 小白链霉菌ARTP-DES连续诱变致死率曲线Fig. 4 Death rate of S. albluus caused by ARTP-DES
连续诱变由于各种诱变因子的作用机制不同,因此可以取长补短,动摇DNA分子上多种基因的遗传稳定性,以弥补某种不亲和性或热点饱和现象,得到更多的突变类型[24]。根据小白链霉菌ARTP致死率曲线,以低、中、高3 个致死率对小白链霉菌诱变,得到的孢子悬液孵育30 min后配成20 mL DES反应体系。以孵育后的孢子悬液为对照计算连续诱变致死率。如图4所示,DES体积分数为0.6%时,致死率达到86.45%。比相同剂量出发菌株DES诱变高5.35%,说明经过一轮ARTP诱变后,突变孢子基因发生改变,对DES的敏感程度增强。根据育种经验,本研究选取DES体积分数0.6%作为最佳诱变剂量。
2.2 突变菌株初筛方法的确定
2.2.1 链霉素MIC分析
核糖体工程通过对菌株引入抗生素抗性突变,进而影响其核糖体结构和次级代谢过程,造成次级代谢产物的大幅提升[27]。链霉素是作用于核糖体上的一种常用抗生素,它可以抑制mRNA翻译起始,进而影响微生物次级代谢,己有不少学者利用链霉素抗性突变并取得显著效果[10,13,16]。将小白链霉菌孢子悬液涂布链霉素抗性平板,在链霉素质量浓度1 μg/mL(图5a)和3 μg/mL(图5b)的平板上,菌落生长受到抑制,生长5 d之后未长孢子,而链霉素质量浓度在4 μg/mL(图5c)时,平板有生长很小的单菌落,生长极为缓慢,说明小白链霉菌生长受到强烈抑制。MIC是指菌落在抗性平板上正好不生长或只有极少数菌落生长的最小浓度。本研究中链霉素对小白链霉菌具有明显抑制作用,说明它可以作为抗性“筛子”对突变菌进行筛选。为了扩大筛选范围,选取4 μg/mL为小白链霉菌对链霉素的MIC。
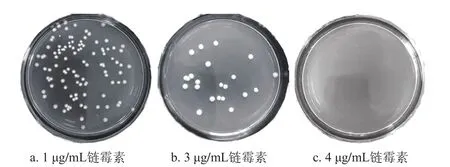
图5 小白链霉菌在不同质量浓度链霉素平板上的生长情况Fig. 5 Growth of S. albulus on medium plates containing streptomycin at different concentrations
2.2.2 亚甲基蓝透明圈法
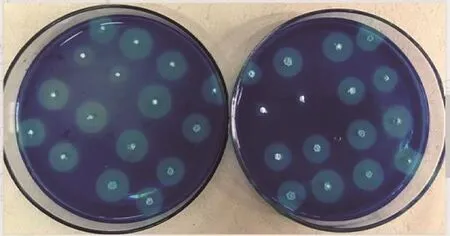
图6 突变菌株在亚甲基蓝平板上的透明圈Fig. 6 Transparent circles on methylene blue plates produced by mutant strains
小白链霉菌ARTP诱变所得突变菌在亚甲基蓝平板上的生长情况如图6所示,平板上呈现大小不同的透明圈。挑选透明圈较大的菌株进行48微孔板发酵。突变菌ε-PL产量见图7,在亚甲基蓝平板上挑取的大部分菌株ε-PL产量提升。对初筛ε-PL产量提高的菌株进行摇瓶复筛,得到1 株突变菌A-6,摇瓶产量为0.701 g/L,较出发菌株提高了16.8%。可见链霉素抗性结合亚甲基蓝透明圈筛选可以作为快速筛选高产菌株的一种方法。有学者通过测量菌落透明圈的H/C值筛选高产菌株[28]。而本研究中挑取的单菌落为刚长出的单菌落,大小基本一致,因此可以在同一条件肉眼比较透明圈的大小,省去了测量的繁琐过程。
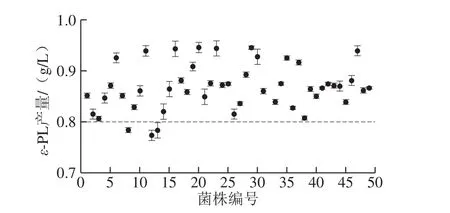
图7 ARTP诱变初筛结果Fig. 7 Results of primary screening of ARTP-induced mutants
2.3 ARTP-DES连续诱变筛选结果
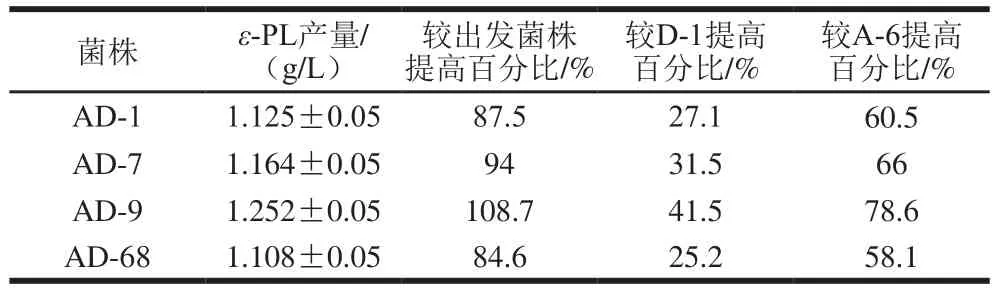
表1 ARTP-DES连续诱变突变株ε-PL产量比较Table 1 Comparison of ε-PL yields in ARTP-DES-induced mutants

表2 3 种诱变方法的突变率及正突变率Table 2 Mutation rates and positive mutation rates
挑取抗性平板上菌株898 株至亚甲基蓝平板中,从中选择透明圈较大的菌株547 株,对其进行48 微孔板及摇瓶含量测定,摇瓶部分复筛结果见表1,突变菌株表现出ε-PL产量的大幅提升,其中菌株AD-1、AD-7、AD-9、AD-68摇瓶产量均超过1 g/L,AD-9的ε-PL产量为1.252 g/L,较出发菌株提升108.7%。为比较诱变效果,本研究也对出发菌株进行单一的ARTP与DES诱变筛选,得到ARTP高产菌株A-6,ε-PL产量为0.701 g/L;DES高产菌株D-1,ε-PL产量为0.885 g/L。AD-9的ε-PL产量较A-6高78.6%,较D-1高41.5%。同时,在进行ARTP诱变、DES诱变、ARTP-DES连续诱变的过程中,随机挑选链霉素抗性平板菌落各100 株进行发酵测试,以ε-PL产量为指标计算每种诱变100 个菌株的突变率及正突变率。由表2可知,3 种诱变突变率都较高,这得益于链霉素抗性筛选。DES诱变突变率及正突变率高于ARTP诱变,说明DES对细胞的诱变效应更强;连续诱变的突变率及正突变率都高于ARTP诱变和DES诱变,说明ARTP与DES连续诱变效果显著,结合筛选得到的高产菌株,进一步说明连续诱变可用于筛选高产ε-PL突变菌。AD-9经多次传代表明遗传性能稳定,因此选择AD-9进行下一步的生理特性研究。
2.4 高产菌株生理特性
2.4.1 不同培养基发酵性能
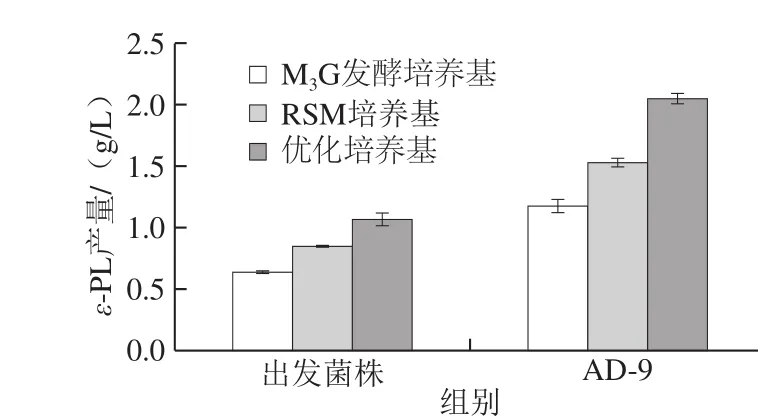
图8 不同培养基ε-PL产量对比Fig. 8 Comparison of ε-PL production of S. albulus and AD-9 with different media
菌株经过诱变,自身基因发生改变,造成代谢过程发生改变,引起目标产物的大幅度提升。伴随着产量的提升,其营养需求可能也会发生改变。为发挥高产菌株的最大发酵潜能,本研究设置了3 种培养基(M3G发酵培养基、RSM培养基、优化培养基)以测试菌株发酵性能。从图8可以看出,出发菌株与AD-9在3 种培养基中ε-PL 产量呈现相同的趋势,产量由高到低分别为优化培养基、RSM培养基、M3G发酵培养基,说明优化培养基可以更高效地合成ε-PL。AD-9在3 种培养基中的ε-PL产量都高于出发菌株的ε-PL产量。说明经过连续诱变,AD-9的ε-PL合成能力得到加强。
2.4.2 发酵过程中菌丝球差异
在发酵过程中,不同菌丝球形态会影响菌株养料和氧气的获取,为进一步了解高产菌株AD-9发酵过程中的变化,观察出发菌株与AD-9在发酵不同时期菌丝球形态。如图9、10所示,在第24小时,出发菌株菌球较少,直径较大,且菌丝球相互缠绕呈现不规则的形态;AD-9菌球致密,菌丝球直径较小,大部分菌丝球呈现规则的椭圆形。发酵48 h,出发菌株菌丝球继续缠绕,形成不规则的椭圆和条状,有裂解的趋势,AD-9菌丝球直径稍增大,仍保持致密的状态。到第72小时,出发菌株大部分菌丝球己出现了裂解现象,而AD-9仍保持致密状态,菌丝球边缘只出现少部分裂解。Hobbs等[29]通过向培养基中添加2 g/L的聚丙烯酸,发现Streptomyces coelicolorJ802菌丝球明显分散,直径变小,并且生物量和放线菌紫素含量得到大幅提升。王国良等[30]向培养基中添加0.5 g/L Mg2+,发酵过程中菌丝球直径明显减小,ε-PL比对照组提高了30.91%。可见菌体发酵中保持一定的菌丝球形态更有利于目的产物的分泌与积累。菌株AD-9优势在于发酵过程中能保持致密且均匀的菌丝球形态,促进ε-PL持续分泌。
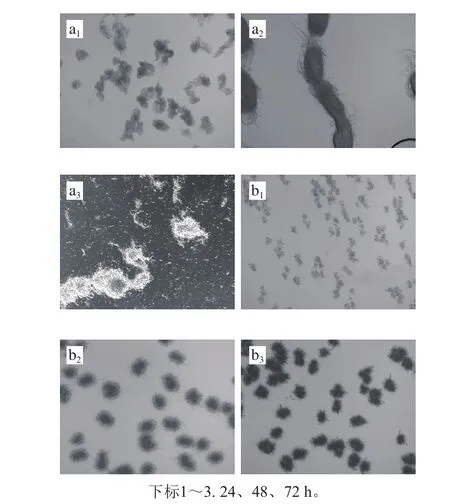
图9 出发菌株(a)与AD-9(b)发酵过程菌体形态比较(×10)Fig. 9 Comparison of pellet morphology of the original strain (a) and AD-9 (b) on during fermentation (× 10)

图10 出发菌株(a)与AD-9(b)菌丝球直径比较(×20)Fig. 10 Comparison of the diameter of mycelial pellets of the original strain (a) and AD-9 (b) (× 20)
2.4.3 摇瓶自然发酵过程比较
如图11所示,两个菌株在发酵过程中pH值变化基本一致,在12~48 h内pH值下降较快,从最初的pH 6.8降到pH 3.2左右,此后开始缓慢下降,其中在12~24 h,出发菌株pH值下降幅度较AD-9大,这一阶段出发菌株菌体干质量斜率高于AD-9,说明此阶段出发菌株生长代谢强于AD-9。发酵过程中葡萄糖消耗趋势基本一致,AD-9的葡萄糖消耗速率高于出发菌株,说明经过诱变,AD-9的生长代谢得到加强。AD-9发酵过程中的菌体干质量一直高于出发菌株,第84小时达到最大值5.52 g/L,比出发菌株的菌体干质量(4.18 g/L)高了1.3 g/L。对比ε-PL产量的变化,发现菌株AD-9 ε-PL的合成速率一直高于出发菌株,到第84小时,达到最大值2.1 g/L,而出发菌株第84小时的ε-PL产量为1 g/L,是其产量的2.1 倍。通过对菌体单位细胞ε-PL产量计算得到,出发菌株单位细胞产量为0.241 6 g/g,AD-9为0.380 4 g/g,突变后菌株单位细胞产量也得到加强。说明AD-9自身代谢过程发生改变,合成ε-PL能力增强。

图11 出发菌株与AD-9自然摇瓶发酵过程比较Fig. 11 Comparison of shake flask fermentation characteristics of the original strain and AD-9
3 结 论
优良的菌株对于ε-PL工业化生产非常重要,而高效的诱变及筛选方法是获得高产菌株的前提。传统诱变仍是目前工业菌种选育的有效手段,但是传统诱变耗时、耗力,缺乏高效筛选方法。本研究基于传统诱变,将ARTP与DES连续诱变引入ε-PL高产菌株的选育中,并建立了链霉素抗性、亚甲基蓝透明圈法定性检测的快速筛选方法,大大提高了筛选效率。最终获得1 株性状优良的突变菌AD-9,其ε-PL摇瓶产量达到2.1 g/L,是出发菌株的2.1 倍。对比ARTP或DES诱变筛选得到的突变菌株,其产量提升幅度及正突变率远远领先,说明连续诱变对于产ε-PL菌株的产量提升效果明显。对高产菌株和出发菌株进行生理特性比较,发现诱变后突变菌株发酵过程菌丝球形态及营养需求均发生了变化,对比不同培养基对菌株产ε-PL的影响,发现AD-9在所选培养基中的ε-PL产量都高于出发菌株,说明AD-9合成ε-PL的代谢过程得到加强,其代谢机制还需进一步研究。
