载单宁酸铁和紫杉醇相变型纳米粒用于体外超声显像及治疗视网膜母细胞瘤
2020-07-23鞠丰翼王志刚杜之渝
袁 勋,鞠丰翼,张 玙,乔 斌,王志刚,杜之渝
(1.重庆医科大学附属第二医院眼科,重庆 400010;2.重庆明达眼科医院眼科,重庆 400010;3.重庆医科大学超声分子影像重庆市重点实验室,重庆 400010)
视网膜母细胞瘤(retinoblastoma, Rb)为儿童最常见原发性眼内恶性肿瘤[1-2],目前临床常用影像学检查方法有CT、MRI、超声及光学相干断层扫描(ophthalmic optical coherence tomography, OCT)等,治疗方法包括化学治疗(简称化疗)、放射治疗及手术等,各有其不足[3-5]。纳米技术用于治疗肿瘤高效而安全[6]。单宁酸(tannic acid, TA)为多酚化合物,可通过绿色合成途径与Fe3+合成具有强黏附能力的光热材料单宁酸铁(FeIII-tannic acid, FeⅢTA)[7]。全氟戊烷(perfluoropentane, PFP)沸点低(29℃)且易相变,可促进药物释放,同时增强超声显像效果[8]。紫杉醇(paclitaxelaclitaxel, PTX)为常用化疗药物,将其与纳米技术结合可获得更高运载效率,提高肿瘤部位药物浓度,增强治疗效果[9-10]。本研究以FeⅢTA、PTX、PFP相结合制备光响应性PLGA纳米粒,并体外评估其超声显像及治疗Rb效果。
1 材料与方法
1.1 主要材料 羟基端乳酸/羟基乙酸共聚物(PLGA-COOH,分子量12 000 Da,聚合比50∶50,上海丽昂化学有限公司),PTX(上海金穗生物科技有限公司),PFP(Strem Chemicals公司),TA(Sigma-Aldrich公司),六水三氯化铁[Iron(Ⅲ)chloride hexahydrate,FeCl3,赛默飞世尔科技有限公司],聚乙烯醇(polyvinyl alcohol,PVA,Sigma公司)以及异丙醇、二氯甲烷、琼脂糖、RPMI1640培养基和胎牛血清、细胞增殖及毒性检测试剂盒CCK-8(上海纪宁实业有限公司)、活/死细胞双染试剂盒(荧光探针细胞染色,上海复申生物科技有限公司)。Y79细胞系(人Rb细胞系)、人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)由重庆医科大学超声影像学研究所提供。
1.2 主要仪器 Sonics & Materials声振仪,磁力搅拌器,低温离心机,Olympus光学显微镜,Zeta SIZER3000HS马尔文粒度仪,Htachi H-7600透射电子显微镜,Agilent Cary 3500紫外可见分光光度计,Shmadzu LC-2-1-A HT高效液相仪(日本岛津公司),808 nm激光仪,热成像仪,Esaote Mylab 90型彩色超声诊断仪(探头频率5~9 MHz),ELX800酶标仪,蔡司激光共聚焦显微镜LSM800等。
1.3 制备纳米粒 以双乳化法制备PLGA/PTX/PFP纳米粒,将50 mg PLGA和5 mg PTX加入2 ml二氯甲烷中并充分溶解。加入200 μl PFP,冰浴下乳化5 min(声振、停止间隔5 s),再加入4% PVA溶液5 ml,再次乳化5 min(声振、停止间隔5 s)。加入2%异丙醇溶液10 ml,加磁珠冰浴搅拌6 h,经超纯水离心、洗涤3次,获得PLGA/PTX/PFP纳米粒。取1 mg PLGA/PTX/PFP纳米粒均匀重悬于2 ml超纯水,依次加入10 μl TA溶液(40 g/L)和10 μl FeCl3溶液(10 g/L),充分混合均匀,经超纯水洗涤、离心3次,完成FeⅢTA/PLGA/PTX/PFP纳米粒制备。
1.4 测定相关表征 以光学显微镜观察纳米粒大小、分散性及相变特性,马尔文粒径分析仪检测其粒径、分布及电位。采用紫外分光光度计检测1.000 g/L PLGA/PTX/PFP及不同浓度(0.125、0.250、0.500、1.000 g/L)FeⅢTA/PLGA/PTX/PFP纳米粒的吸光度。以透射电子显微镜分析纳米粒的结构。配制不同浓度(6.25、12.50、25.00、50.00、100.00、200.00 μg/ml)PTX,用高效液相色谱仪绘制PTX标准曲线(色谱柱:Welch-C18,4.6 mm×250 mm,流动相:甲醇∶水=77∶23,波长227 nm,流速:1 ml/min),以有机溶剂(二甲基亚砜∶甲醇=1∶1)破坏纳米粒后再次检测并分析PTX含量,根据PTX标准曲线计算包载的PTX质量,得出PTX的包封率和载药率。
将FeⅢTA/PLGA/PTX/PFP纳米粒随机等量分成808 nm激光辐照组和未受激光辐照组,分别装入透析袋,置于缓冲介质中。于0.5、1、2、4、6、12、24 h对2组分别取样,对激光辐照组在1 h采样结束后立刻用808 nm激光(1 W/cm2)辐照5 min,再将透析袋放回缓冲溶液中继续上述流程。以高效液相色谱仪检测并绘制2组PTX药物释放率。
1.5 测定体外光热效应 对FeⅢTA/PLGA/PTX/PFP纳米粒按不同浓度(0.125、0.250、0.500、1.000 g/L)分组,以1.000 g/L PLGA/PTX/PFP为纳米粒组,磷酸缓冲盐溶液(phosphate buffer saline, PBS)为空白对照组,每组取200 μl分别置于96孔板中,经808 nm激光(1 W/cm2)辐照10 min。以热成像仪检测各组温度变化,光镜下观察FeⅢTA/PLGA/PTX/PFP纳米粒相变。
1.6 体外超声显像 取9 g琼脂糖粉置于烧杯中,加入350 ml脱气水,以微波炉加热并充分搅拌溶解,将200 μl规格枪头盒装满枪头,将琼脂溶液缓慢注满枪头盒,待其等待自然冷却,得到凝胶模型。取上述各浓度FeⅢTA/PTX/PLGA/PFP纳米粒悬液和PBS各200 μl置于96孔板中,以PBS为对照组,用808 nm激光(1 W/cm2)辐照5 min后取出,置于琼脂糖凝胶模型中,以超声诊断仪分析显像效果,测量超声信号灰度值。
1.7 细胞培养 以含1%双抗、10%胎牛血清RPMI1640培养液于37℃、5% CO2培养箱中孵育人源性Y79细胞系及HUVEC。
1.8 测定生物安全性 将HUVEC和Y79细胞分别置于96 孔板中孵育12 h,弃去孔中旧培养基,加入含0.125、0.250、0.500、1.000、2.000 g/L FeⅢTA/PLGA/PFP纳米粒的新鲜培养基100 μl,继续孵育24 h,然后弃去孔中旧培养基,用PBS清洗3次,再每孔加入100μl含10% CCK-8新鲜培养基孵育2 h,检测吸光值A450;每组测量5次并分析。
1.9 CCK-8法检测Y79细胞存活 将Y79细胞于96孔板中孵育12 h,弃掉旧培养基,分为空白对照组、激光组、FeⅢTA/PLGA/PTX/PFP(FPTP)组、FeⅢTA/PLGA/PTX/PFP+激光(FPTP+激光)组,分别加入纳米粒后孵育4 h,再次弃掉培养基,加入100 μl无血清培养基;予激光组和FPTP+激光组激光(1 W/cm2)辐照5 min,再次孵育6 h后加入CCK-8试剂并孵育30 min,酶标仪检测吸光值A450,每组测量5次并分析。检测不同浓度(0、0.250、0.500、1.000 g/L)FPTP+激光组纳米粒的杀伤作用,方法同上。
1.10 活/死细胞法检测Y79细胞存活 共聚焦皿板中孵育细胞12 h,弃掉培养基,加入1 ml浓度1.000 g/L的不同纳米粒无血清培养基,分为空白对照组、激光组、FPTP组、FPTP+激光组,加入不同纳米粒后孵育4 h,再次弃掉培养基,加入1 ml新鲜血清培养基,予激光组和FPTP+激光组经激光(1 W/cm2)辐照5 min,再孵育6 h后,各皿中加入200 μl活/死细胞双染试剂并孵育15 min,观察各组细胞存活情况。
1.11 流式细胞法检测Y79细胞存活 将Y79细胞置于48孔板中孵育12 h,弃掉培养基,加入浓度为1.000 g/L的无血清培养基200 μl,分为空白对照组、激光组、FPTP组、FPTP+激光组,分别加入纳米粒后孵育4 h,再次弃掉培养基,加入200 μl无血清培养基;予激光组和FPTP+激光组经激光(1 W/cm2)辐照5 min,再次孵育6 h后送检。
1.12 统计学分析 采用SPSS 22.0统计分析软件。计量资料以uation.3±s表示,多组均数比较采用单因素方差分析,两两比较采用t检验,两变量之间关系采用线性相关分析。P<0.05为差异有统计学差异。
2 结果
2.1 纳米粒表征 成功制备出FeⅢTA/PLGA/PTX/PFP纳米粒,粒径(155.8±55.68)nm(图1A),分散指数(PdI:0.100),电位(-27.3±5.14)mV,其大小均匀,分散性好;透射电镜下观察,中心的PLGA/PTX/PFP纳米粒被FeⅢTA外壳包裹(图1B)。FeⅢTA/PLGA/PTX/PFP的吸光度明显高于PLGA/PTX/PFP,且随浓度变化(图1C)。PTX的标准曲线回归方程为y=19 414x+12 788,r=0.997 2;其包封率为(70.89±8.03)%,载药率为(9.61±0.63)%,0.5 h和1 h时释药率差异无统计学意义(P>0.05),而激光辐照组PTX释药率明显升高(P<0.05,图1D)。
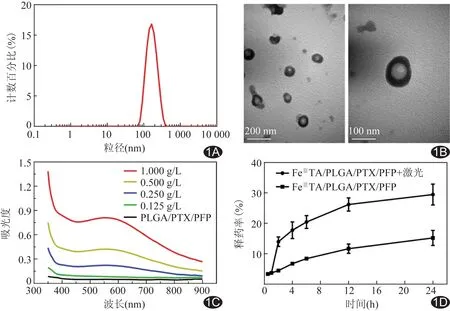
图1 载FeⅢTA/PTX/PFP的PLGA纳米粒相关表征 A.纳米粒粒径分布图; B.透射电镜图; C.PTP纳米粒和不同浓度FPTP纳米粒吸光光度图; D.FPTP纳米粒体外紫杉醇释放曲线图
2.2 体外光热效应及光致相变 激光辐照不同浓度FPTP纳米粒, 5 min时温度上升趋于平稳,浓度越高温度上升越快、越高,而PTP纳米粒和PBS对照组温度均未见升高(图2A)。对于不同浓度FPTP纳米粒,5 min时热成像图(图2B)和温度定量分析结果均呈正相关(r=0.842 8,P<0.05,图2C)。光镜下观察,随辐照时间增加,发生相变的FPTP纳米粒逐渐增多(图2D)。
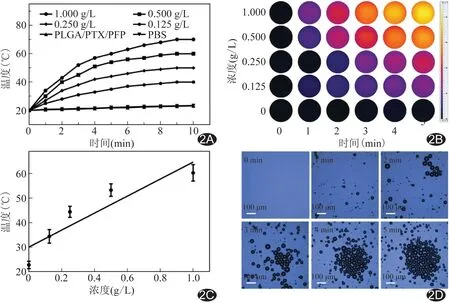
图2 纳米粒光热图与光致相变图 A.PTP纳米粒和不同浓度FPTP纳米粒经近红外激光辐照的升温曲线图; B.纳米粒组激光辐照5 min的热成像图; C.不同浓度FPTP纳米粒激光辐照5 min时温度与浓度关系定量分析图; D.FPTP纳米粒经激光辐照后相变图
2.3 体外超声显像 超声显像中,激光辐照后,B模式和造影模式均可见明显信号增强(图3);定量分析信号强度变化,随纳米粒浓度增加,B模式信号(r=0.991,P<0.01)及造影模式信号(r=0.992,P<0.01)均明显增强并呈正相关。

图3 不同浓度FPTP纳米粒体外超声显像图
2.4 生物安全性 不同浓度FPP纳米粒对人正常细胞和肿瘤细胞均无细胞毒性(P>0.05),见图4A。
2.5 CCK-8法检测Y79细胞存活情况(表1) 激光组对Y79细胞毒性杀伤作用与空白对照组纳米粒比较差异无统计意义(P>0.05),而FPTP+激光组强于FPTP组(P<0.01,图4B)。0.250 g/L、0.500 g/L、1.000 g/L FPTP纳米粒对Y79细胞的毒性杀伤作用均高于对照组(P均<0.01),0.500 g/L、1.000 g/L组高于0.250 g/L组(P均<0.01),而1.000 g/L组高于0.500 g/L组(P<0.01),见图4C。
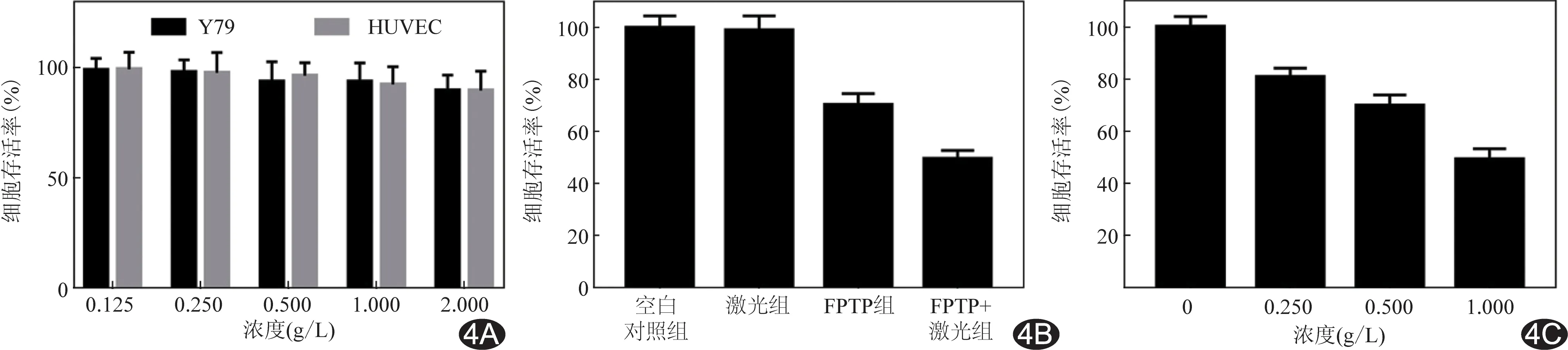
图4 纳米粒细胞毒性作用 A.FPP纳米粒对Y79细胞和HUVEC细胞的毒性; B.不同纳米粒组对Y79细胞的杀伤情况; C.不同浓度FPTP+激光纳米粒组对Y79细胞的杀伤情况
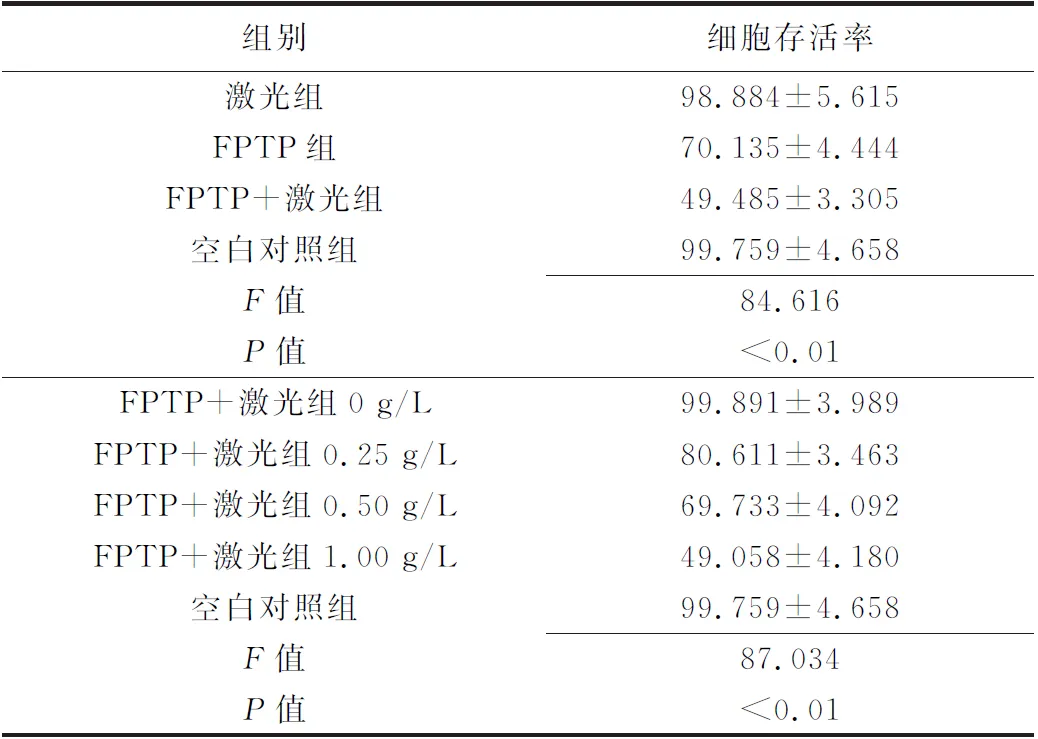
表1 各组Y79细胞存活情况(%)
2.6 活/死细胞法和流式细胞法检测Y79细胞存活(表2) 空白对照组和激光组Y79细胞存活率均较高 (P>0.05);FPTP组、FPTP+激光组Y79细胞存活率均低于空白对照组(P<0.01);FPTP组Y79细胞存活率高于FPTP+激光组(P<0.01),见图5。空白对照组和激光组Y79细胞凋亡均较少 (P>0.05);FPTP组、FPTP+激光组Y79细胞凋亡率均高于空白对照组(P均<0.01);FPTP组Y79细胞凋亡率低于FPTP+激光组(P<0.01),见图6。

图6 流式细胞仪检测不同纳米粒组细胞凋亡 A.空白对照组; B.激光组; C.FPTP组; D.FPTP+激光组
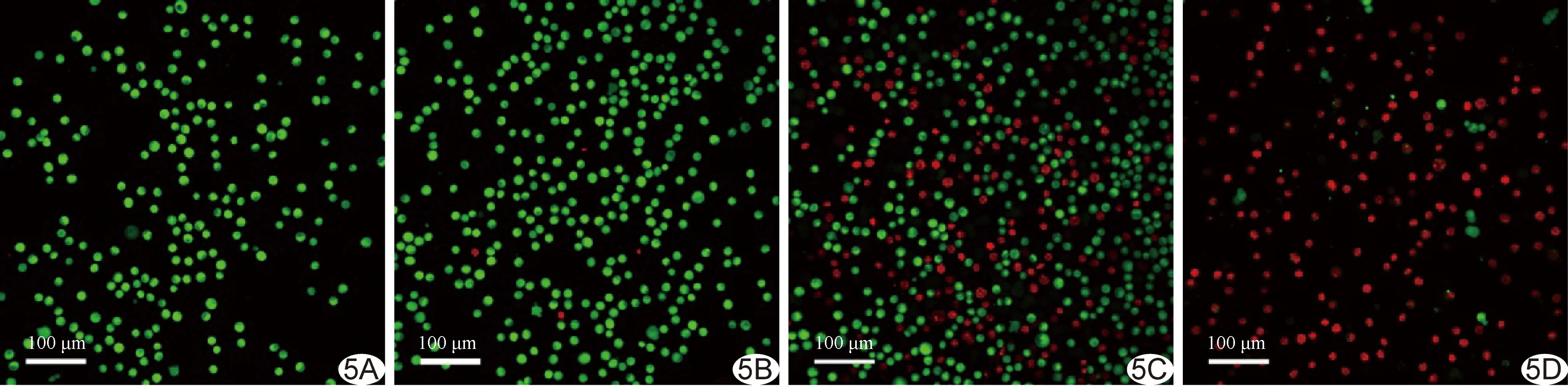
图5 激光共聚焦显微镜观察细胞存活情况 A.空白对照组; B.激光组; C.FPTP组; D.FPTP+激光组 (绿/红色分别为活/死细胞)

表2 各组Y79细胞存活情况(%)
3 讨论
目前治疗Rb的优先级顺序依旧是拯救生命、保留眼球和保存视力[11]。对于较小肿瘤,经瞳孔810 nm聚焦激光温热疗法是首选治疗方法,OCT引导光凝治疗对于治疗肉眼不可见的新生Rb具有重要临床价值[12];但对较大肿瘤需多次由外至内进行光凝治疗并结合化疗[13],在提高肿瘤部位药物浓度、抑制肿瘤生长的同时降低药物全身毒副作用[14-16]。通过结合纳米技术和相变材料,可制备超声分子探针,实现增强超声显像效果[17]。
相变材料的激发方式有多种选择[18-19]。本研究将光凝治疗、化疗与超声显像相结合,制备出诊疗一体FPTP纳米粒,可同时增强疗效和超声显像效果,其粒径为(155.8±55.68)nm,电位为(-27.3±5.14)mV,有利于通过肿瘤血管进入肿瘤[20];电镜可见电子密度较高的FeⅢTA呈黑色,包裹住中间灰白色的PFP;FeⅢTA/PLGA/PTX/PFP的吸光度主要来自FeⅢTA壳,也表明FeⅢTA成功搭载在纳米粒上。PLGA/PTX/PFP纳米粒和PBS均无法经激光辐照产热,提示FeⅢTA/PLGA/PTX/PFP纳米粒的光热效应来源于FeⅢTA。体外超声显像显示,FeⅢTA经激光激发产热,促进PFP相变,从而增强超声显像效果,两种模式下回声均随纳米粒浓度增加而逐渐增强。体外检测FPTP纳米粒在经激光和未经激光辐照下的PTX释放结果表明PFP经光热激发后发生相变,促进PTX的药物释放。体外生物安全性实验结果显示,高浓度FPP纳米粒在未经激光激发的情况下不会对正常细胞和肿瘤细胞造成损害,具有较好的生物安全性。体外细胞实验结果显示,单一激光辐照不会对细胞造成杀伤效果,同时FPTP纳米粒未经激光辐照时虽可缓慢地释放PTX,但对肿瘤的杀伤效果有限,而FPTP纳米粒经激光辐照可迅速提高药物浓度,达到光热治疗和化疗协同杀伤肿瘤细胞的目的。将光热治疗和化疗相结合,肿瘤细胞杀伤效果明显增强,且随浓度升高而增强。激光共聚焦显微镜和流式细胞仪观察结果显示FPTP+激光组对肿瘤细胞杀伤效果最强,为进一步开展体内动物实验奠定了基础。
